

2024-2025学年人教版九年级上册化学期末专题训练:计算题(含解析)
展开
这是一份2024-2025学年人教版九年级上册化学期末专题训练:计算题(含解析),共20页。试卷主要包含了查阅资料可知,中国天宫空间站用电解水制氧气,兴趣小组对过氧化氢溶液进行探究等内容,欢迎下载使用。
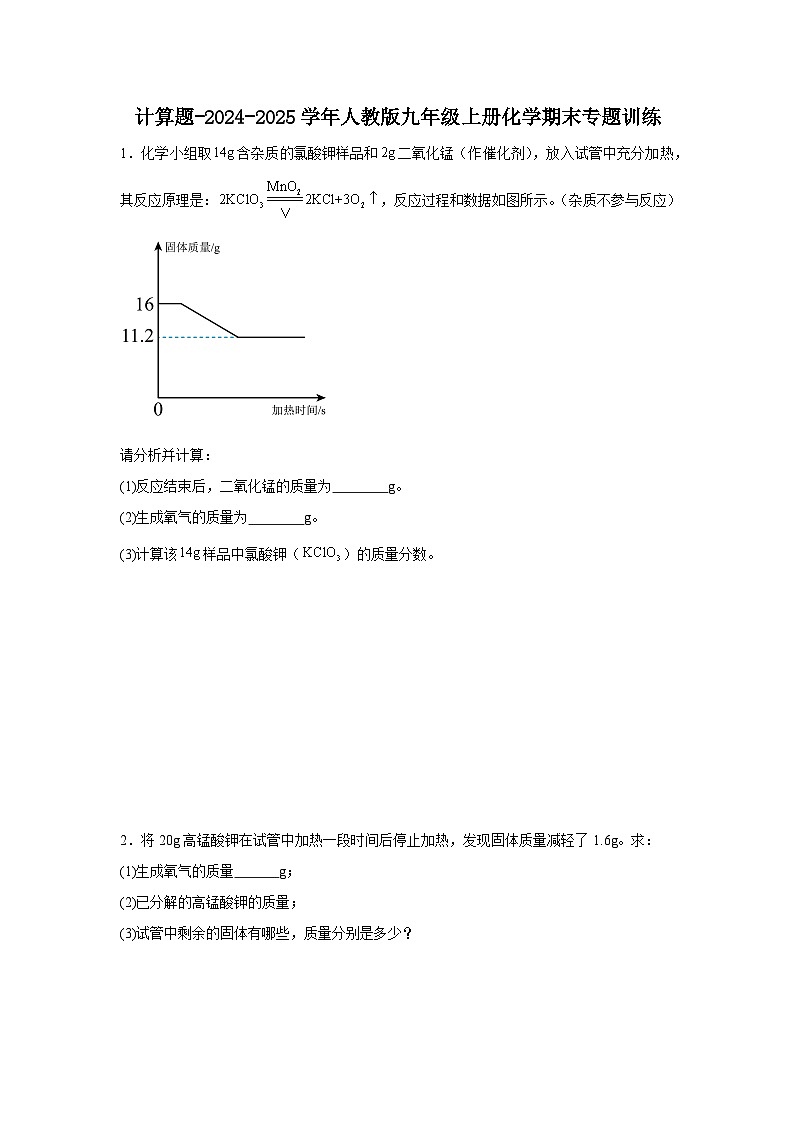
请分析并计算:
(1)反应结束后,二氧化锰的质量为 g。
(2)生成氧气的质量为 g。
(3)计算该样品中氯酸钾()的质量分数。
2.将20g高锰酸钾在试管中加热一段时间后停止加热,发现固体质量减轻了1.6g。求:
(1)生成氧气的质量 g;
(2)已分解的高锰酸钾的质量;
(3)试管中剩余的固体有哪些,质量分别是多少?
3.过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应生成氢氧化钙和氧气。某养殖场把14.4 kg过氧化钙加入鱼塘中完全反应。请计算:
(1)过氧化钙中钙元素的质量分数为 (精确到0.1%)。
(2)生成氧气的质量(写出计算过程)。
4.实验室用过氧化氢溶液和二氧化锰制取氧气,实验中锥形瓶内非气态物质的总质量随时间变化如图所示。
(1)反应结束后锥形瓶内剩余物质是 。
(2)请计算过氧化氢溶液中过氧化氢的质量是多少。
5.查阅资料可知:实验室制备氧气,也可以利用高锰酸钾分解生成锰酸钾二氧化锰和氧气,发生反应的化学方程式为:,现将31.6g高锰酸钾加热至质量不再减少,冷却后称量固体物质总质量为28.4g。试回答:
(1)上述过程中固体混合物在反应后质量减少了 g,原因是生成了 (填化学式)。
(2)请计算生成锰酸钾和二氧化锰的质量。(计算结果精确至0.1g)
6.《天工开物》中有“煤饼烧石成灰”的记载,“烧石成灰”发生的反应为:CaCO3CaO+CO2↑。
(1)CO2中碳、氧元素质量之比 。
(2)计算,10g碳酸钙充分反应后。可制得氧化钙的质量是多少?(写出计算过程)
7.把干燥纯净的氯酸钾和二氧化锰的混合物15.5g装入大试管中,给试管加热来制得氧气。当反应不再发生时,待试管冷却,称得固体质量为10.7g,求:
(1)制得氧气多少克?
(2)10.7g固体物质中氯化钾的质量?
8.某兴趣小组用如图所示装置制取,加热固体一段时间后,称量试管中剩余固体的质量为,回答下列问题:
(1)该反应中生成的氧气的质量是 。
(2)剩余固体中的质量是多少克?
9.中国天宫空间站用电解水制氧气。若用电解水的方法制取1.6kg氧气,
请分析:
(1)该反应的基本反应类型为 反应
(2)根据化学方程式计算,消耗水的质量是多少?(写出计算过程)
10.兴趣小组对过氧化氢溶液进行探究。取25g过氧化氢溶液放入烧杯中,进行如图所示的实验。请回答:
(1)反应后产生气体的质量是 g。
(2)写出反应的化学方程式,并在各物质下方写出其相对分子质量。
11.小明用图示装置验证质量守恒定律。
请回答下列问题:
(1)实验时若取用红磷的量不足,对实验的结果 (选填“有”或“没有”)影响。
(2)计算参加反应的红磷的质量(结果精确到0.01g)。
12.盐酸是一种重要的化工原料,氢气在氯气中燃烧生成氯化氢的反应可用于工业制备盐酸。该反应的微观示意图如下,请回答:
(1)该反应中最小的粒子是 (用化学用语表示)
(2)计算氢气完全反应生成氯化氢的质量。(写出计算过程,结果保留一位小数)
13.中国天宫空间站三名航天员每日需要,固体燃料氧气发生器制氧,是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠();点燃铁粉,铁粉剧烈燃烧,放出大量的热,受热分解为NaCl和。
(1)氯酸钠受热分解所需的能量来自于 ;
(2)三名航天员4天所需共9.6kg,则理论上至少需要加热分解的质量为多少?(的相对分子质量为106.5,列出化学方程式写出完整过程计算)
14.发射卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)做助燃剂,反应的化学方程式为 (不完整)。
(1)从环保的角度看,该反应用于发射火箭的优点是 。
(2)某次发射火箭共载燃料N2H4和助燃剂N2O4总计31.2吨,若所载的N2H4恰好和N2O4完全反应,则火箭载有N2O4多少吨?
15. 实验室用高锰酸钾制取氧气,某次实验中固体的质量变化如下,
请计算:
(1)写出该反应的化学方程式
(2)生成氧气的质量是多少?
(3)反应后剩余固体混合物中二氧化锰的质量?
16.实验室用高锰酸钾制取氧气,某次实验中固体的质量变化如下。
请计算:
(1)生成氧气的质量是多少?
(2)求参加反应的高锰酸钾的质量是多少?
17.小明取26.3g氯酸钾和二氧化锰的混合固体均匀混合后加热,充分反应称得剩余固体质量为16.7g。求:
(1)生成的氧气的质量为 g。
(2)原固体混合物中氯酸钾的质量。
(3)二氧化锰的质量。
18.将一定质量的高锰酸钾固体充分加热,冷却后称量剩余固体质量比反应前减少了3.2g,请完成下列分析及计算。
(1)该反应属于 (选填“化合反应”或“分解反应”)。
(2)高锰酸钾的质量是多少?(写出计算过程)
19.过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应的化学方程式为2CaO2 +2H2O= 2Ca(OH)2+ O2↑。某养殖场把14.4 kg过氧化钙加入鱼塘中完全反应。请计算:
(1)过氧化钙中钙元素的质量分数为 (精确到0.1%)。
(2)生成氧气的质量(写出计算过程)。
20.芯片被称为“现代工业的粮食”,高纯度的硅可用于制造计算机芯片。工业上常用焦炭在高温下和二氧化硅反应制取硅,主要反应为:
(1)硅在地壳中的含量居第 位。
(2)SiO2中硅元素与氧元素的质量比为 (写最简整数比)。
(3)根据化学方程式计算,若要制取5.6 kg的硅,至少需要焦炭的质量是多少?(写出计算过程)
21.2023年5月30日,神舟十六载人飞船顺利升空,六位航天员在空间站胜利会师。神舟飞船内为降低CO2的含量,放置了含有LiOH的过滤网。已知:LiOH能吸收CO2生成Li2CO3和H2O。请完成下面问题:
(1)LiOH中Li的质量分数为 。(结果精确到0.1%)
(2)完全吸收110gCO2,理论上需要LiOH的质量是多少?(请列式计算)。
22.将MnO2和KClO3,的固体混合物 35.0 g加热至质量不再变化为止(已知KClO3,在MnO2的催化和加热条件下生成KCl 和氧气),冷却后称得剩余固体的质量为 25.4 g。回答下列问题:
(1)生成O2的质量为
(2)计算反应前固体混合物中MnO2的质量分数。(写出计算过程)
高锰酸钾20g
剩余的固体混合物18.4g
参考答案:
1.(1)2
(2)4.8
(3)87.5%
解:设样品中氯酸钾()的质量为x,
样品中氯酸钾()的质量分数为=87.5%;
答:样品中氯酸钾()的质量分数为87.5%。
【详解】(1)二氧化锰是该反应的催化剂,化学反应前后质量不变,则反应结束后,二氧化锰的质量为2g,故填:2;
(2)根据质量守恒定律,反应后固体减少的质量为生成氧气的质量,则生成氧气的质量为16g-11.2g=4.8g,故填:4.8;
(3)见答案。
2.(1)1.6
(2)解:设已分解的高锰酸钾的质量为x。
解得
答:已分解的高锰酸钾的质量为15.8g。
(3)由(2)可知,已分解的高锰酸钾的质量为15.8g,则剩余固体中高锰酸钾的质量为
设生成锰酸钾的质量为,生成二氧化锰的质量为z。
答:剩余固体中高锰酸钾的质量为4.2g,锰酸钾的质量为9.85g,二氧化锰的质量为4.35g。
【详解】(1)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,则固体减少的质量=生成氧气的质量,即生成氧气的质量为1.6g,故填:1.6;
(2)详见答案;
(3)详见答案。
3.(1)55.6%
(2)解:设生成氧气的质量为x,
解得x=3.2kg
答:生成氧气的质量为3.2kg。
【详解】(1)过氧化钙中钙元素的质量分数为;
(2)见答案。
4.(1)水和二氧化锰
(2)解:该过程中生成的氧气的质量为70g-66.8g=3.2g。
设过氧化氢溶液中过氧化氢的质量为x。
x=6.8g
答:过氧化氢溶液中过氧化氢的质量是6.8g。
【详解】(1)过氧化氢在二氧化锰的催化条件下反应生成水和氧气,二氧化锰是反应的催化剂,反应前后质量和化学性质不变,故反应结束后锥形瓶内剩余物质是水和二氧化锰。
(2)见答案。
5.(1) 3.2 O2
(2)反应生成氧气3.2g,设生成锰酸钾的质量为x,生成二氧化锰的质量为y。
,
x=19.7g,y=8.7g
生成锰酸钾的质量为19.7g,生成二氧化锰的质量为8.7g。
【详解】(1)高锰酸钾放入试管中加热制取氧气,充分反应至不再产生气体为止,剩余固体物质是锰酸钾和二氧化锰,实际就是减少了氧气的质量。固体混合物在反应后质量减少了31.6g-28.4g=3.2g,原因是生成氧气,化学式为:O2。
(2)见答案。
6.(1)3:8
(2)解:设10g碳酸钙充分反应后,可制得氧化钙的质量为x
答:10g碳酸钙充分反应后,可制得氧化钙5.6g。
【详解】(1)CO2中碳、氧元素质量之比12:(16×2)=3:8;
(2)见答案。
7.(1)根据质量守恒定律可知,氧气的质量等于氯酸钾和二氧化锰的总质量减去剩余固体的质量,即氧气的质量为15.5g-10.7g =4.8g。
答:制得氧气4.8g。
(2)设生成4.8g的氧气的同时,生成氯化钾的质量是,则
答:10.7g固体物质中氯化钾的质量为7.45g。
【详解】(1)见答案
(2)见答案
【点睛】解答本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量结合化学方程式进一步计算。
8.(1)1.6
(2)解:设生成二氧化锰的质量为x。
答:剩余固体中的质量为4.35g。
【详解】(1)高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,根据质量守恒定律可知,化学反应前后物质的总质量不变,则该反应中生成的氧气的质量是;
(2)计算过程见答案。
9.(1)分解
(2)解:设制取1.6kg氧气需要电解水的质量为x
答:若用电解水的方法制取1.6kg氧气,消耗水的质量是1.8kg。
【详解】(1)电解水生成氢气和氧气,符合一变多,属于分解反应;
(2)见答案。
10.(1)3.2
(2)
【详解】(1)过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出,由质量守恒定律可知,反应后产生气体的质量是:126.0g-122.8g=3.2g;
(2)过氧化氢在二氧化锰催化作用下分解生成水和氧气,2H2O2的相对分子质量=2×(1×2+16×2)=68,2H2O相对分子质量=2×(1×2+16)=36,O2相对分子质量=16×2=32,反应的化学方程式以及各物质下方写出其相对分子质量:
11.(1)没有
(2)解:设参加反应的红磷的质量为x。
参加反应的氧气的质量为:
解得
答:参加反应的红磷的质量为0.04g。
【详解】(1)红磷燃烧发生了化学变化,就能验证质量守恒定律,所以若取用的红磷的量不足,对实验结果没有影响,故填:没有;
(2)详见答案。
12.(1)H、Cl
(2)解:设氢气完全燃烧生成化氢的质量为x
答:氢气完全燃烧生成氛化氢的质量为克。
【详解】(1)化学反应的本质是分子分解成原子,原子重新组合成新的分子,原子是化学变化过程中的最小粒子,氢气在氯气中燃烧生成氯化氢的反应中的最小粒子是氢原子和氯原子,故填:H、Cl;
(2)过程见答案。
13.(1)铁粉的剧烈燃烧
(2)解:设理论上至少需要加热分解NaClO3的质量为x
答:理论上至少需要加热分解NaClO3的质量为21.3kg。
【详解】(1)根据题目信息,点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2,所以氯酸钠受热分解所需的能量来自于铁粉的剧烈燃烧。
(2)见答案。
14.(1)生成物为氮气和水,无污染,比较环保
(2)解:设火箭载有N2O4的质量是x,则载有N2H4的质量是:31.2t-x
x=18.4t
答:火箭载有N2O4的质量为18.4t。
【详解】(1)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含N、H、O的个数分别是6、8、4,生成物中含N、H、O的个数分别是6、0、0,故生成物中还应含8个H、4个O,故缺少的化学式为:H2O,故从环保的角度看,该反应用于发射火箭的优点是:生成物为氮气和水,无污染,比较环保;
(2)见答案。
15.(1)
(2)解:根据质量守恒定律,则生成氧气的质量是;
答:生成氧气的质量是1.6g。
(3)解:设生成二氧化锰的质量为x。
x=4.35g
答:反应后剩余固体混合物中二氧化锰的质量为4.35g。
【详解】(1)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式为;
(2)见答案;
(3)见答案。
16.(1)1.6g;
(2)
解:设参加反应的高锰酸钾的质量是x。
,x=15.8g
答:参加反应的高锰酸钾的质量是15.8g。
【详解】(1)根据质量守恒定律,生成氧气的质量为:20g-18.4g=1.6g。
(2)见答案
17.(1)9.6
(2)解:设消耗氯酸钾的质量为x。
x=24.5g
答:消耗氯酸钾的质量为24.5g。
(3)二氧化锰的质量为1.8g
【详解】(1)根据质量守恒定律可以知道,制得氧气的质量为:26.3g-16.7 g=9.6 g;
(2)见答案;
(3)由上述分析可知,氯酸钾的质量为24.5g,氯酸钾和二氧化锰的混合固体的质量为26.3g,则二氧化锰的质量为26.3g-24.5g=1.8g。
18.(1)分解反应
(2)设高锰酸钾的质量为x;
答:高锰酸钾的质量是31.6g.
【详解】(1)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,该反应属于一变多即分解反应;
(2)反应后生成物只有氧气是气体,因此反应前后固体质量差为氧气的质量即生成氧气3.2g,计算过程见答案。
19.(1)55.6%
(2)设生成氧气的质量为x,则
解得x=3.2kg
答:生成氧气的质量为3.2kg。
【详解】(1)过氧化钙中钙元素的质量分数为。
(2)见答案。
20.(1)二/2
(2)7:8
(3)解:设至少需要焦炭的质量为x
x=4.8kg
答:若要制取5.6 kg的硅,至少需要焦炭的质量是4.8kg。
【详解】(1)地壳中元素含量由高到低依次是:O、Si、Al、Fe,故硅在地壳中的含量居第二位;
(2)二氧化硅中硅元素与氧元素的质量比为:;
(3)见答案。
21.(1)29.2%
(2)设需要LiOH的质量为x,则
解得x=120g
答:理论上需要LiOH的质量是120g。
【详解】(1)LiOH中Li的质量分数为。
(2)见答案。
22.(1)9.6g
(2)解:设参加反应的氯酸钾的质量为x。
x=24.5g
反应前固体混合物中二氧化锰的质量分数=30%。
答:反应前固体混合物中MnO2的质量分数为30%。
【详解】(1)根据质量守恒定律,生成氧气的质量为35.0 g-25.4 g=9.6g;
(2)见答案。
相关试卷
这是一份2024中考化学压轴专题训练-专题09计算类-实验计算题(含解析),共23页。
这是一份2024中考化学压轴专题训练-专题08计算类-框图计算题(含解析),共13页。
这是一份2024中考化学压轴专题训练-专题07计算类-文字计算题(含解析),共10页。










