




所属成套资源:【备战2025】高考化学一轮复习核心考点讲练专题(新高考通用)(解析版)
- 微考点03 化学反应速率与化学平衡图像(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用) 试卷 0 次下载
- 微考点04 晶胞计算(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用) 试卷 0 次下载
- 考点01 物质的分类及转化(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)(解析版) 试卷 0 次下载
- 考点02 离子反应 离子方程式(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)(解析版) 试卷 0 次下载
- 考点03 离子共存 离子检验与推断(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)(解析版) 试卷 0 次下载
微考点05 电解质溶液的图像分析(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)
展开这是一份微考点05 电解质溶液的图像分析(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用),文件包含微考点05电解质溶液的图像分析核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用原卷版docx、微考点05电解质溶液的图像分析核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用解析版docx等2份试卷配套教学资源,其中试卷共63页, 欢迎下载使用。
TOC \ "1-3" \h \u \l "_Tc32062" PAGEREF _Tc32062 \h 1
\l "_Tc13609" 1.高考真题考点分布 PAGEREF _Tc13609 \h 1
\l "_Tc20226" 2.命题规律及备考策略 PAGEREF _Tc20226 \h 1
\l "_Tc20059" PAGEREF _Tc20059 \h 2
\l "_Tc29838" 考法01 电解质溶液微粒变化图像 PAGEREF _Tc29838 \h 2
\l "_Tc13419" 考法02 沉淀溶解平衡图像9
\l "_Tc21759" 15
1.高考真题考点分布
2.命题规律及备考策略
【命题规律】
高频考点从近几年全国高考试题来看,酸碱中和滴定、沉淀滴定、沉淀溶解平衡曲线、中和滴定曲线、对数曲线等仍是高考命题的热点。
【备考策略】
【命题预测】
预计2025年高考会以新的情境载体考查沉淀溶解平衡曲线、中和滴定曲线、对数曲线、分布曲线等知识,考查数形结合能力、信息整合能力,题目难度一般较大。
考法01 电解质溶液微粒变化图像
1.滴定曲线特殊点的分析
(1)强酸与强碱滴定过程中pH曲线
(以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例)
(2)强酸(碱)滴定弱碱(酸)pH曲线比较
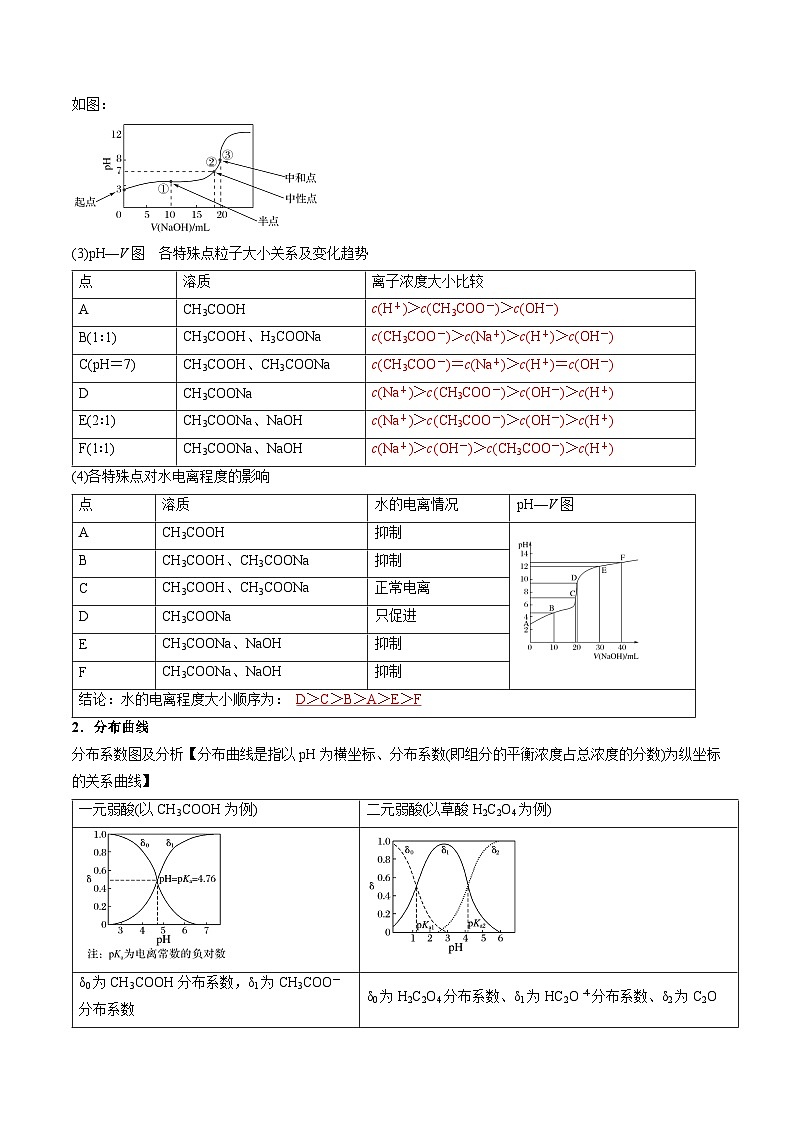
案例:常温下,用0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1 CH3COOH溶液所得滴定曲线如图:
(3)pH—V图 各特殊点粒子大小关系及变化趋势
(4)各特殊点对水电离程度的影响
2.分布曲线
分布系数图及分析【分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线】
3.坐标为对数或负对数的图像分析
(1)pC:类比pH,即为C离子浓度的负对数,规律是pC越大,C离子浓度越小。
(2)pK:平衡常数的负对数,规律是pK越大,平衡常数越小,对于一元弱酸(HX):pKa=pH-lg eq \f(c(X-),c(HX)),lg eq \f(c(X-),c(HX))越大,HX的电离程度越大。
(3)AG=lgeq \f(c(H+),c(OH-)),氢离子浓度与氢氧根离子浓度比的对数;规律是:AG越大,酸性越强,中性时AG=0。
【图像示例】
(1)pOH—pH曲线
eq \b\lc\{(\a\vs4\al\c1(Q点为中性,c(H+)H2O=c(OH-)H2O=1×,10-a ml·L-1,M点为酸性,c(OH-)H2O=1×10-b ml·L-1,N点为碱性,c(H+)H2O=1×10-b ml·L-1))
(2)常温下,二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
eq \b\lc\{(\a\vs4\al\c1(L1代表\f(c(HY-),c(H2Y))-pH,H2Y的Ka1=10-1.3,Ka2=10-4.3,e点:c(H2Y)=c(Y2-)))
(3)常温下将KOH溶液滴加到二元弱酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图:
eq \b\lc\{(\a\vs4\al\c1(二元弱酸(H2X)一级电离程度远大于二级,电离程度,lg\f(c(X2-),c(HX-))越大,表示电离程度越大,因而,N代表一级电离的曲线,M代表二级电离,曲线可以根据m点,n点的坐标计算pKa1,和pKa2))
考向01 考查滴定曲线
【例1】(2024·陕西商洛·模拟预测)室温下,用的二甲胺溶液(二甲胺在水中的电离与一水合氨相似)滴定盐酸溶液。溶液随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
A.x=1,y=7
B.a、b两点的溶液中,不相等
C.本实验应该选择酚酞作指示剂
D.b点溶液中存在:
【答案】D
【解析】A.的盐酸溶液的,加入溶液,两者恰好完全反应生成强酸弱碱盐,溶液呈酸性,故,A项错误;
B.常温下,在任何溶液中均相等,B项错误;
C.因为两者恰好完全反应生成,溶液显酸性,故本实验应该选择甲基橙作指示剂,C项错误;
D.b点溶液中元素质量守恒:,D项正确;
选D。
考向02 考查分布曲线图像
【例2】(2024·江苏苏州·模拟)H2C2O4为二元弱酸,20 ℃时,配制一组c(H2C2O4)+c(HC2Oeq \\al(-,4))+c(C2Oeq \\al(2-,4))=0.1 ml ·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.pH=2.5的溶液中:c(H2C2O4)+c(C2Oeq \\al(2-,4))>c(HC2Oeq \\al(-,4))
B.pH=7的溶液中,c(Na+)=2c(C2Oeq \\al(2-,4))
C.c(HC2Oeq \\al(-,4))=c(C2Oeq \\al(2-,4))的溶液中:c(Na+)>0.1+c(HC2Oeq \\al(-,4))
D.c(Na+)=0.1 ml ·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2Oeq \\al(2-,4))
【答案】D
【解析】A.由图像可知,pH=2.5的溶液中c(H2C2O4)和c(C2Oeq \\al(2-,4))浓度之和小于c(HC2Oeq \\al(-,4)),则c(H2C2O4)+c(C2Oeq \\al(2-,4))<c(HC2Oeq \\al(-,4)),A错误;B.20 ℃时, pH=7的溶液中,显中性,(H+)=c(OH-),根据电荷守恒c(H+)+c(Na+)=2c(C2Oeq \\al(2-,4))+c(HC2Oeq \\al(-,4))+c(OH-),所以c(Na+)>2c(C2Oeq \\al(2-,4)),B错误;C.c(H2C2O4)+c(HC2Oeq \\al(-,4))+c(C2Oeq \\al(2-,4))=0.100 ml ·L-1,c(HC2Oeq \\al(-,4))=c(C2Oeq \\al(2-,4)),电荷守恒c(H+)+c(Na+)=2c(C2Oeq \\al(2-,4))+c(HC2Oeq \\al(-,4))+c(OH-),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100 ml ·L-1+c(HC2Oeq \\al(-,4)),C错误;D.依据溶液中电荷守恒和元素质量守恒分析,c(Na+)=0.100 ml/L的溶液中为NaHC2O4溶液,溶液中存在电荷守恒c(H+)+c(Na+)=2c(C2Oeq \\al(2-,4))+c(HC2Oeq \\al(-,4))+c(OH-),元素质量守恒c(Na+)=c(C2Oeq \\al(2-,4))+c(HC2Oeq \\al(-,4))+c(H2C2O4),代入计算得到c(H+)+c(H2C2O4)=c(OH-)+c(C2Oeq \\al(2-,4)),D正确。
考向03 考查坐标为对数或负对数的图像
【例3】(2024·河北衡水·模拟))已知常温下HF酸性强于HCN,分别向1 L 1 ml·L-1的HF、HCN溶液中加NaOH固体(忽略温度和溶液体积变化),溶液pH随lgeq \f(c(X-),c(HX))(X表示F或者CN)变化情况如图所示,下列说法错误的是( )
A.lgKa(HF)-lgKa(HCN)=6
B.溶液中对应的c(X-):d点>c点
C.b点溶液的pH=5.2
D.e点溶液中c(Na+)>c(HCN)>c(OH-)>c(H+)
【答案】B
【解析】由题干信息可知,常温下HF酸性强于HCN,即Ka(HF)>Ka(HCN),当横坐标为0时,即lgeq \f(c(F-),c(HF))=0或者lgeq \f(c(CN-),c(HCN))=0即c(F-)=c(HF)或c(CN-)=c(HCN),则有Ka(HF)=eq \f(c(F-)·c(H+),c(HF))=c(H+)=10-3.2, Ka(HCN)=eq \f(c(CN-)·c(H+),c(HCN))=c(H+)=10-9.2,即Ⅰ代表HF,Ⅱ代表HCN,据此分析解题。A.由分析可知,Ka(HF)=10-3.2, Ka(HCN)=10-9.2,则lgKa(HF)-lgKa(HCN)=6,A正确;B.由于弱电解质的电离是微弱的,故溶液中c(HF)=c(HCN)≈1 ml/L,则溶液中对应的c(X-):d点为:c(CN-)=eq \f(c(HCN)·Ka(HCN),c(H+))=eq \f(1 ml/L×10-9.2,10-7),c点为:c(F-)=eq \f(c(HF)·Ka(HF),c(H+))=eq \f(1 ml/L×10-3.2,10-7),则c>d,B错误;C.由分析可知,Ⅰ代表HF,Ka(HF)=10-3.2,b点溶液中lgeq \f(c(F-),c(HF))=2,则有:c(H+)=eq \f(c(HF)·Ka(HF),c(F-))=10-5.2,故b点对应溶液的pH=5.2,C正确;D.由图像可知,e点溶液中pH为9.2,此时lgeq \f(c(CN-),c(HCN))=0即c(CN-)=c(HCN),根据电荷守恒可知:c(Na+)+ c(H+)=c(CN-)+c(OH-),结合c(OH-)>c(H+),则有c(Na+)>c(CN-)>c(OH-)>c(H+) 即有c(Na+)>c(HCN)>c(OH-)>c(H+),D正确。
【对点1】(2024·山西朔州·模拟)T K时,现有25 mL含KCl和KCN的溶液,用0.1000 ml⋅L的硝酸银标准溶液对该混合液进行电位滴定(与的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。下列说法不正确的是
已知:Ⅰ.与的反应过程为①,
②;
Ⅱ.T K时,,.
A.,A→B发生反应:;
B.原溶液中,
C.C点时,溶液中
D.D点:
【答案】D
【分析】已知曲线上的转折点为化学计量点,根据题意和图像,结合化学方程式可知:A点为完全反应生成的终点,B点为转化为AgCN沉淀,看作第一滴定终点,C点生成AgCl沉淀,看作第二滴定终点。
【解析】A.根据与反应过程:①、②可知:A点体积为2.50 mL,B点体积为5.0 mL,故A正确;
B.原溶液中ml/L.ml/L.根据物料守恒关系可知:,故B正确;
C.C点,和完全沉淀,溶液中同时存在二者的沉淀溶解平衡,,故C正确;
D.D点,硝酸银溶液过量,根据和图像关系可知:,故D错误;
故选D。
【对点2】(2024·河南濮阳·模拟)以酚酞为指示剂,用0.100 0 ml ·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布分数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布分数:δ(A2-)=eq \f(c(A2-),c(H2A)+c(HA-)+c(A2-))],下列说法错误的是( )
A.曲线①代表δ(HA-),曲线②代表δ(A2-)
B.H2A溶液的浓度为0.100 0 ml ·L-1
C.A2-+H2OHA-+OH-的平衡常数为1.0×10-9
D.VNaOH=40 mL 时,溶液中c(Na+)=2c(A2-)+2c(HA-)
【答案】C
【解析】A.没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),故A正确;B.根据反应2NaOH+H2A===Na2A+2H2O,c(H2A)=eq \f(0.100 0 ml/L×40 mL ,20 mL ×2)=0.100 0 ml ·L-1,故B正确;C.根据曲线当δ(HA-)=δ(A2-)时溶液的pH=2,则HA-的电离平衡常数Ka=eq \f(c(A2-)·c(H+),c(HA-))=c(H+)=1×10-2,所以A2-+H2OHA-+OH-的平衡常数为eq \f(Kw,Ka)=1.0×10-12,故C错误;D.当加入40.00 mL NaOH溶液时,溶液的pH发生突变,说明恰好完全反应,根据反应2NaOH+H2A===Na2A+2H2O知,溶质为Na2A,由物料守恒可得c(Na+)=2c(A2-)+2c(HA-),D正确。
【对点3】(2024·黑龙江鸡西·模拟)常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是( )
A.曲线M表示pH与lgeq \f(c(HY-),c(H2Y))的变化关系
B.Ka2(H2Y)=10-4.3
C.a点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D.交点c的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)
【答案】D
【解析】Ka1(H2Y)=eq \f(c(H+)·c(HY-),c(H2Y)),随着pH增大,c(H+)减小,eq \f(c(HY-),c(H2Y))增大,lgeq \f(c(HY-),c(H2Y))增大,故曲线M表示pH与lg eq \f(c(HY-),c(H2Y))的变化关系,A项正确;曲线N表示pH与lgeq \f(c(HY-),c(Y2-))的变化关系,当pH=3时,c(H+)=10-3ml·L-1,lgeq \f(c(HY-),c(Y2-))=1.3,eq \f(c(Y2-),c(HY-))=10-1.3,Ka2(H2Y)=eq \f(c(H+)·c(Y2-),c(HY-))=10-3×10-1.3=10-4.3,B项正确;a点溶液中存在电荷守恒:c(H+)+c(K+)=2c(Y2-)+c(HY-)+c(OH-),故c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),C项正确;交点c的溶液中:lgeq \f(c(HY-),c(H2Y))=lgeq \f(c(HY-),c(Y2-))=1.5,则c(H2Y)=c(Y2-)
一、沉淀溶解平衡Ksp曲线的分析
1.阳离子—阴离子单曲线
2.阴、阳离子浓度——温度双曲线图
二、有关沉淀溶解平衡对数图像分析
1.对数图像
将溶液中某一微粒的浓度[如c(A)]取常用对数,即lg c(A),反映到图像中是:
(1)若c(A)=1时,lg c(A)=0
(2)若c(A)>1时,lg c(A)取正值且c(A)越大,lg c(A)越大
(3)若c(A)<1时,lg c(A)取负值,且c(A) 越大,lg c(A)越大,但数值越小
(4)当坐标表示浓度的对数时,要注意离子浓度的换算,如lg c(X)=a,则c(X)=10a
(5)当坐标表示浓度的负对数[-lg c(X)=pX]时,pX越大,c(X)越小,c(X)=10-pX
2.正对数[lg c(M+)~lg c(R-)]曲线
3.负对数[-lg c(M+)~-lg c(R-)]曲线
3.沉淀滴定曲线分析
向10 mL 0.2ml/L CuCl2 溶液中滴加 0.2 ml/L 的 Na2S 溶液:
4.沉淀溶解平衡图像题解题策略
(1)沉淀溶解平衡曲线类似于溶解度曲线,曲线上任意一点都表示饱和溶液,曲线上方的任意一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任意一点均表示不饱和溶液。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Q与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Q的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
考向01 考查沉淀溶解平衡Ksp曲线的分析
【例1】(2024·浙江嘉兴·一模)常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.在任何溶液中,c(Ca2+)、c(SOeq \\al(2-,4))均相等
B.b点将有沉淀生成,平衡后溶液中c(Ca2+)和c(SOeq \\al(2-,4))都等于3×10-3 ml·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
【答案】C
【解析】只有在单一CaSO4溶液中c(Ca2+)、c(SOeq \\al(2-,4))才相等,A项错误;b点Q>Ksp,故有沉淀生成,开始c(Ca2+)、c(SOeq \\al(2-,4))不相等而反应消耗的Ca2+、SOeq \\al(2-,4)相等,因此平衡后的两种离子浓度也不会都等于3×10-3 ml·L-1,B项错误;在沉淀溶解平衡曲线上的Ksp均相等,C项正确;d点通过蒸发后各离子浓度都增大,不可能保持SOeq \\al(2-,4)浓度不变而到达c点,D项错误。
考向02 考查有关沉淀溶解平衡对数图像分析
【例2】(2024·湖北鄂州·模拟)T ℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是( )
A.曲线 Ⅰ 是CdCO3的沉淀溶解平衡曲线
B.加热可使溶液由X点变到Z点
C.Y点对应的Cd(OH)2溶液是过饱和溶液
D.T ℃,在CdCO3(s)+2OH-(aq)Cd(OH)2(s)+COeq \\al(2-,3)(aq)平衡体系中,平衡常数K=102
【答案】D
【解析】A.CdCO3(s) Cd2+(aq)+COeq \\al(2-,3)(aq),则c(Cd2+)=c(COeq \\al(2-,3)),CdCO3的沉淀平衡中pCd2+=pN,故曲线Ⅱ是CdCO3的沉淀溶解平衡曲线,A错误;B.由A分析可知,曲线Ⅰ是Cd(OH)2的沉淀溶解平衡曲线,Cd(OH)2 (s)Cd2+(aq)+2OH- (aq),则2c(Cd2+)=c(OH-),加热平衡正向移动,Cd2+、OH-离子浓度变大,但是不会相等,B错误;C.曲线上的点为达到了沉淀溶解平衡,pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数,则数值越大,离子浓度越小,Y点在曲线上方,说明离子浓度小,故为不饱和溶液,C错误;D.T ℃,由图可知,pN=4时,CdCO3中pCd2+为8,即Ksp(CdCO3)=c(COeq \\al(2-,3))·c(Cd2+)=10-12;pN=4时,Cd(OH)2中pCd2+为6,即Ksp[Cd(OH)2]=c2(OH-)·c(Cd2+)=10-14;在CdCO3(s)+2OH-(aq)Cd(OH)2(s)+COeq \\al(2-,3)(aq)平衡体系中,平衡常数K=eq \f(c(COeq \\al(2-,3)),c2(OH-))=eq \f(c(COeq \\al(2-,3))·c(Cd2+),c2(OH-)·c(Cd2+))=eq \f(Ksp(CdCO3),Ksp[Cd(OH)2])=102,D正确。
考向03 考查沉淀滴定曲线分析
【例2】(2024·江西上饶·模拟)某温度下,分别向10.00 mL 0.1 ml/L的KCl和K2CrO4溶液中滴加0.1 ml/L AgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrOeq \\al(2-,4))与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是( )
A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NOeq \\al(-,3))>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05 ml/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
【答案】D
【解析】A.KCl和硝酸银反应的化学方程式为:KCl+AgNO3===AgCl↓+KNO3,铬酸钾和硝酸银反应的化学方程式为:K2CrO4+2AgNO3===Ag2CrO4↓+2KNO3,根据反应方程式可知在相同浓度的KCl和K2CrO4溶液中加入相同浓度的硝酸银溶液,氯离子浓度减小的更快,所以L1代表是-lgc(Cl-)与V(AgNO3)的变化关系,故 A正确;B.M点加入的硝酸银溶液体积是15 mL,根据反应方程式KCl+AgNO3===AgCl↓+KNO3可知,生成0.001 ml硝酸钾和0.001 ml氯化银,剩余0.000 5 ml硝酸银,则c(NOeq \\al(-,3))>c(K+)>c(Ag+),银离子水解使溶液表现酸性,则c(H+)>c(OH-),所以M点溶液中,离子浓度为:c(NOeq \\al(-,3))>c(K+)>c(Ag+)>c(H+)>c(OH-),故 B正确;C.N点纵坐标的数值是4,则Ag2CrO4在沉淀溶解平衡中c(CrOeq \\al(2-,4))=10-4,c(Ag+)=2×10-4ml/L,Ksp(Ag2CrO4)=c(CrOeq \\al(2-,4))×c2(Ag+)=10-4×(2×10-4)2=4.0×10-12,故C正确;D.相同实验条件下同一种溶液的Ksp相同,平衡时溶液中c(CrOeq \\al(2-,4))=10-4,Q对应的纵坐标数值是4.0,即c(CrOeq \\al(2-,4))=10-4,曲线L2中N点移到Q点上方,故D错误。
【对点1】(2024·广东深圳·模拟)一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(COeq \\al(2-,3))增大,溶液中c(Ba2+)的变化曲线如图所示。下列说法正确的是( )
A.该温度下,Ksp(BaSO4)>Ksp(BaCO3)
B.加入Na2CO3固体,立即有BaCO3固体生成
C.BaCO3的Ksp=2.5×10-9
D.曲线BC段内,eq \f(c(COeq \\al(2-,3)),c(SOeq \\al(2-,4)))=eq \f(1,25)
【答案】C
【解析】当c(COeq \\al(2-,3))=0时,c(SOeq \\al(2-,4))=c(Ba2+)=1.0×10-5 ml·L-1,故BaSO4的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。由题图可知当c(COeq \\al(2-,3))>2.5×10-4 ml·L-1时,开始有BaCO3生成,BaCO3的溶度积Ksp=2.5×10-4×1.0×10-5=2.5×10-9,A、B项错误,C项正确。曲线BC段内,BaSO4(s)和BaCO3(s)在溶液中都达到了沉淀溶解平衡状态,故eq \f(c(COeq \\al(2-,3)),c(SOeq \\al(2-,4)))=eq \f(c(COeq \\al(2-,3))·c(Ba2+),c(SOeq \\al(2-,4))·c(Ba2+))=eq \f(Ksp(BaCO3),Ksp(BaSO4))=eq \f(2.5×10-9,1.0×10-10)=25,D项错误。
【对点2】(2024·安徽巢湖·模拟)已知298 K时, Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是( )
(已知:eq \r(6)≈2.4,eq \r(10)≈3.2)
A.M点对应的溶液中, c(S2-)≈3.2×10-11 ml·L-1
B.与P点相对应的NiS的分散系是均一稳定的
C.FeS+Ni2+NiS+Fe2+的平衡常数K=6 000
D.向N点对应的溶液中加水,可转化成Q点对应的溶液
【答案】C
【解析】已知298 K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18,可知NiS较难溶于水,则图中Ⅰ为FeS、Ⅱ为NiS,直线上的点为平衡点。A.M点对应的溶液中,c(S2-)=eq \r(6.0×10-18) ml/L=2.4×10-9 ml/L,A错误;B.对于NiS,P点在平衡点以下,为过饱和溶液,会有沉淀生成,为悬浊液,是不稳定的分散系,B错误;C.FeS+Ni2+NiS+Fe2+的平衡常数K=eq \f(Ksp(FeS),Ksp(NiS))=6 000,C正确;D.N点为平衡点,向N点对应的溶液中加水,Ni2+和S2-的浓度同时减小,故无法转化成Q点对应的溶液,D错误。
【对点3】(2024·山东枣庄·模拟)某温度下,向10 mL 0.01 ml·L-1 PbCl2溶液中滴加0.01 ml·L-1的Na2S溶液,滴加过程中-lgc(Pb2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是( )
A.该温度下,Ksp(PbS)=1.0×10-28
B.a、b、c三点对应的溶液中,水的电离程度最小的为a点
C.若改用0.02 ml·L-1 Na2S溶液,b点应该水平右移
D.若改用0.02 ml·L-1 PbCl2溶液,b点移向右下方
【答案】A
【解析】该温度下,平衡时c(Pb2+)=c(S2-)=10-14 ml·L-1,则Ksp(PbS)=c(Pb2+)·c(S2-)=(10-14)2=10-28,A项正确;Pb2+单独存在或S2-单独存在均会水解,促进水的电离,b点时恰好形成PbS的沉淀,此时水的电离程度最小,B项错误;若改用0.02 ml·L-1的Na2S溶液,由于温度不变,Ksp(PbS)=c(Pb2+)·c(S2-)不变,即平衡时c(Pb2+)不变,纵坐标不变,但消耗的Na2S体积减小,故b点水平左移,C项错误;若改用0.02 ml·L-1的PbCl2溶液,则消耗的Na2S的体积增大,反应终点时c(Pb2+)不变,纵坐标不变,即b点应向右平移,D项错误。
1.(2024·四川成都·模拟预测)已知。初始温度25℃时,向氨水中滴加的稀硫酸,测得混合溶液的温度T、pOH随加入稀硫酸体积V的变化如图所示。下列说法不正确的是
A.水的电离程度:c
C.a、b、c三点对应的水解平衡常数:
D.若,则c点对应溶液中
【答案】C
【解析】A.b点温度最高,说明b点氨水和硫酸恰好反应,b点溶质只有(NH4)2SO4,a点溶质为(NH4)2SO4、氨水,c点溶质为(NH4)2SO4、H2SO4、(NH4)2SO4促进水电离、H2SO4和氨水都抑制水电离,b点水的电离程度最大,故A正确;
B.b点温度最高,说明b点氨水和硫酸恰好反应,b点溶质只有(NH4)2SO4,(NH4)2SO4水解呈酸性,所以b点溶液中,,故B正确;
C.水解吸热,温度越高的水解平衡常数越大,a、b、c三点对应的水解平衡常数:,故C错误;
D.若,根据物料守恒①,根据电荷守恒②,综合①②得,故D正确;
选C。
2.(2024·福建厦门·模拟预测)在时,用溶液滴定溶液,加入的溶液体积与溶液变化曲线如图所示,其中时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的溶液体积为时,溶液的稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述不正确的是
已知:,,。
A.总反应的化学方程式:
B.点的混合溶液:
C.点的混合溶液,的数量级为
D.的过程中,水的电离程度不断增大
【答案】D
【分析】由图可知,a点之前,和未发生反应,随的加入浓度增大,水解增强,溶液pH逐渐增大;过程中,溶液中出现白色浑浊且无气体生成,说明发生反应,据此分析解答。
【解析】A.根据题干中信息,有白色浑浊生成且全程无气体生成,得出反应的化学方程式:,A正确;
B.a点时溶液中存在电荷守恒,a点溶液显碱性,所以c(OH-)>c(H+),则可得到,B正确;
C.b点的混合溶液中,Ka2(H2CO3)= ,则=,代入题中给出的数据=,即的数量级为10-6,C正确;
D.点溶液中溶质有NaHCO3和CaCl2,水的电离被促进,b点溶液中溶质有NaCl 和H2CO3,水的电离被抑制,对比之下发现,的过程中,水的电离程度不断减小,D错误;
故选D。
3.(2024·广东江门·三模)亚磷酸常温下电离平衡常数,。常温下,向溶液中滴加盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位和溶液随盐酸体积变化曲线如下图所示。下列说法正确的是
A.滴定过程需要加入酚酞做指示剂
B.水的电离程度:
C.点对应的溶液中:
D.点溶液中存在
【答案】A
【分析】根据电离平衡常数Ka1,计算出Na2HPO3的水解常数,则的电离程度大于水解程度;
【解析】根据电离平衡常数Ka1,,计算出Na2HPO3的水解常数,则的电离程度大于水解程度;
A.因为是利用强酸滴定弱碱,根据酚酞变色的pH范围是8.0—10.0,可以选择酚酞作指示剂,故A正确;
B.a点的时候,溶液溶质是Na2HPO3,水解为主,故a点水解程度最大,b点为第一个计量点,反应为HCl+ Na2HPO3= NaCl+NaH2PO3,b点溶质为等物质的量的NaCl、Na2HPO3,根据可以电离出H+,水的电离会受到抑制。c点的反应为HCl+NaH2PO3= NaCl+H3PO3,溶液酸性为最强,所以水的抑制最大,故B错误;
C.b点对应的溶液中,溶质为等物质的量的NaCl、NaH2PO3,因为Cl-不水解,而会水解,则Cl->,同时根据分析可知,的电离程度大于水解程度,则>H3PO3,而Na2HPO3是二元弱酸,溶液中不存在离子,所以判断结果应该是:Cl->> >H3PO3,故C错误;
D.c点溶液中,存在等物质的量的NaCl和H3PO3,根据电荷守恒,c(Na+)=c(Cl-),H3PO3溶液中电荷守恒关系为c(H+)=c(OH-)+c()+2c(),故D错误;
故答案选A。
4.(2024·山东菏泽·模拟预测)常温下,向0.1ml/L溶液中滴加稀盐酸,所得混合溶液的与分布系数的变化关系如图1,与的变化关系如图2。
下列说法正确的是
A.N点和c点溶液中相同,为10-2.8ml/L
B.a点时,
C.水的电离程度:
D.d点时,
【答案】A
【解析】A.根据图中点M、P得到,,根据c点得到,则有,,,解得,即N点,c点对应的,故A项正确;
B.a点时,根据电荷守恒,有。根据元素质量守恒,有,两式联立,得,再根据a点对应和分布系数图,得,则有,故B项错误;
C.a、b两点pH相等,水的电离程度相等,因此水的电离程度:a=b>c>d>e,故C项错误;
D.d点时,,则有,故D项错误;
故本题选A。
5.(2024·黑龙江双鸭山·模拟预测)常温下,二元弱酸体系中[其中X表示或]随溶液变化如图所示(通过加入固体调节溶液且忽略溶液体积变化)。下列说法中错误的是
A.表示随溶液的变化
B.的溶液中存在
C.溶液中存在
D.水的电离程度:
【答案】D
【解析】A.根据、可知,当时,a点对应,b点对应,结合大于,则,,表示随溶液的变化,A正确;
B.由选项A分析可知,L2表示随溶液pH的变化,的溶液中,,,根据电荷守恒可得:,B正确;
C.,水解程度大于其电离程度,因此溶液中,C正确;
D.盐的水解促进水的电离,弱酸电离抑制水的电离。NaHA水解大于电离,Na2A只水解。a点为等浓度NaHA和H2A混合溶液,b点为等浓度的NaHA和Na2A混合溶液,则b点对水的电离促进作用大,即水的电离程度:,D错误;
故选D。
6.(2024·山东·模拟预测)某小组根据常温下溶液的分布系数(如图所示)开展以下实验:
实验1:向溶液中加入等体积溶液;
实验2:向溶液中加入足量溶液,有沉淀生成。
下列说法中正确的是
A.常温下,的
B.实验1所得的溶液中:
C.实验2中所得沉淀是黑色
D.向实验1所得溶液中滴加溶液,将促进水的电离
【答案】B
【分析】对图中曲线进行标记如图,pH较小时,主要以H2S存在,随pH增大,H2S逐渐减少,HS-逐渐增多,pH继续增大,HS-减少,S2-增多,故曲线a表示H2S,曲线b表示HS-,曲线c表示S2-,图中a、b曲线交点,c(H2S)=c(HS-)且pH=6.9,即c(H+)=10-6.9ml/L,H2S的Ka1==10-6.9,同理,由b、c曲线交点,Ka2=10-13.0;
【解析】A.图中a、b曲线交点,c(H2S)=c(HS-)且pH=6.9,即c(H+)=10-6.9ml/L,H2S的Ka1==10-6.9,A错误;
B.实验1即H2S和NaOH等量混合,相当于溶质为NaHS,由电荷守恒c(Na+)+c(H+)=c(OH−)+c(HS−)+2c(S2−),由于Kh2==10-7.1>Ka2=10-13.0;即HS−水解程度大于电离程度溶液显碱性,c(OH−)>c(H+),故c(Na+)>c(HS−)+2c(S2−),B正确;
C.铁离子有氧化性,H2S有还原性,故实验2中所得沉淀是淡黄色的S单质,C错误
D.实验1所得溶液相当于NaHS溶液,加入氢氧化钠溶液,刚开始氢氧化钠溶液和NaHS反应得Na2S,Na2S水解程度大于NaHS,促进水的电离,但是当NaHS全部反应完后,继续滴加氢氧化钠溶液相当于溶液中加碱,会抑制水的电离,所以是先促进后抑制,D错误;
本题选B。
7.(2024·安徽合肥·三模)常温下,用0.1NaOH溶液滴定20.00mL 0.1 溶液,得到pH与V(NaOH)、[或]关系如图所示。下列或叙述正确的是
A.M点对应的溶液中:
B.曲线n表示pH与的变化关系
C.当pH=7时,
D.的平衡常数
【答案】C
【解析】A.由图可知,为二元弱酸,在水中分两步电离,当纵坐标为0时,,由于,曲线m代表,曲线n代表,且、,由图可知,M点溶质主要溶质为NaHA,NaHA为酸式盐,且此时溶液为酸性(pH=4),故的电离程度大于其水解程度,,质子守恒式:,故A项错误;
B.根据上述分析可,曲线m表示pH与的变化关系,故B项错误;
C.根据上述分析,当pH=7时,,则,故,故C项正确;
D.的平衡常数,故D项错误;
故本题选C。
8.(2024·湖南衡阳·模拟预测)某温度下,与不同的体系反应可生成不同的沉淀。下面图1表示体系中各含碳粒子的物质的量分数与的关系。图2表示与不同的体系反应生成沉淀的情况,其中曲线I的离子浓度关系符合;曲线II的离子浓度关系符合[注:起始,不同下由图1得到]。
下列说法正确的是
A.溶液中,时,和一定相等
B.符合的范围:
C.,时,溶液中存在和两种沉淀
D.,时可发生反应:
【答案】D
【解析】A.溶液中发生水解反应,时,温度不一定是常温,Kw不一定为10-14,则c(OH-)不一定是10-3.75ml/L,和不一定相等,A错误;
B.由图1可知,当pH=6.37时,,同理Ka2=10-10.25,Ka1×Ka2=10-16.62。若,则满足下列两个关系:①>1,②。将①代入Ka2表达式,可得,即pH<10.25;将②代入Ka1×Ka2表达式,可得,即pH>8.31。因此,符合条件的pH范围是,B错误;
C.分析图2,,时,溶液中只存在沉淀,C错误;
D.分析图1和图2,pH=8时,溶液中主要含碳离子为,Mg2+浓度为0.1 ml/L时,只产生沉淀,因此可以发生,D正确;
故选D。
9.(2024·山西·模拟预测)常温下,向浓度均为的的混合溶液中通入气体,溶液中的与(代表三种酸根离子,表示三种弱酸)的分布系数随溶液的变化如图所示:
已知:三种弱酸的酸性强弱为。下列说法错误的是
A.的电离常数
B.反应的平衡常数
C.交点a处的
D.原混合溶液中:
【答案】C
【解析】 本题以多元弱酸的分布系数图像为情境,考查溶液、电离平衡常数计算等知识,意在考查分析与推测能力,变化观念与平衡思想的核心素养。
A.由图可知,的电离常数为的电离常数为的电离常数为,A项正确;
B.反应的,B项正确;
C.交点a处,由元素守恒可得,,所以,,C项错误;
D.原混合溶液中,根据电荷守恒可得:,根据元素守恒可得:,整理两个等式可得:,D项正确;
故选C。
10.(2024·福建泉州·模拟预测)湿法提银工艺中,浸出的需加入进行沉淀。时,平衡体系中含微粒的分布系数[如]随的变化曲线如图所示。
已知:。下列叙述错误的是
A.随着增大,的溶解度先减小后增大
B.时,的平衡常数
C.当时,溶液中
D.时,随着的不断加入,溶液中的比值逐渐减小
【答案】D
【解析】A.由图可知,溶液中增大时,氯化银的分布系数δ先增大后不断减小,说明氯化银的溶解度起始时随着增大而不断减小,当溶液中银离子和氯离子形成络离子时,随着增大,氯化银的溶解度增大,即随着增大,的溶解度先减小后增大,故A正确;
B.由方程式可知,反应的平衡常数,由图可知,,溶液中,则平衡常数=100.2,故B正确;
C.由图可知,当时,,故C正确;
D.根据题中所给信息有,,则有,K只受温度影响,比值不变,故D错误;
故答案选D。
11.(2024·湖南·模拟预测)常温下,用NaOH溶液分别滴定等物质的量浓度的HX(弱酸)、(可溶性盐)和(可溶性盐)三种溶液。[M表示、、]随溶液pH的变化如图所示。已知:。下列说法错误的是
A.曲线I代表随溶液pH的变化关系
B.的数量级是
C.固体能完全溶解在溶液中
D.滴定HX溶液至时,溶液中:
【答案】D
【分析】、是同种类型的难溶电解质,故曲线I、Ⅲ代表或随溶液pH的变化关系。对于,,同理,对于,,将即、分别代入,可得,,又,则,故曲线I代表随溶液pH的变化关系,曲线Ⅲ代表随溶液pH的变化关系,则曲线Ⅱ代表随溶液pH的变化关系。将I和Ⅲ曲线横轴上的点代入计算式,可得到,;
【解析】A.由上述分析可知,曲线I代表随溶液pH的变化关系,A正确;
B.根据曲线Ⅱ可知,时,,则,,数量级是,B正确;
C.若固体能完全溶解在溶液中,则HX溶液与发生反应,,,则,又,则,故固体能完全溶解在溶液中,C正确;
D.滴定HX溶液至时,根据可知,,则,由电荷守恒得,可知,故,D错误;
选D。
12.(2024·山东德州·三模)向饱和溶液(有足量固体)中滴加溶液,发生反应和、与的关系如图所示。其中代表或代表或。下列说法错误的是
A.表示随的变化关系
B.的
C.的平衡常数为
D.时,溶液中
【答案】AC
【分析】溴化银的饱和溶液中溴离子浓度和银离子浓度相等,向饱和溶液中滴加硫代硫酸钠溶液时,溶液中银离子浓度减小、溴离子浓度增大,则b点所在曲线表示银离子浓度与硫代硫酸根离子浓度变化的关系、d点所在曲线表示溴离子与硫代硫酸根离子浓度变化的关系;溴化银与硫代硫酸钠溶液开始反应时,溴化银主要转化为,溶液中小于,则直线L1表示随变化的关系、直线L2表示随的关系;由图可知,溶液中硫代硫酸根离子浓度为10—4.6ml/L时,溶液中溴离子和银离子浓度分别为10—3.85ml/L、10—8.35ml/L,则溴化银的溶度积常数,据此分析解题。
【解析】A.由分析可知,直线L1表示随变化的关系、直线L2表示随的关系,故A错误;
B.据分析可知AgBr的,故B正确;
C.由图可知,溶液中硫代硫酸根离子浓度为10—4.6ml/L时,溶液中溴离子和银离子浓度分别为10—3.85ml/L、10—8.35ml/L,为10—4.2,的浓度为:,的平衡常数为 ,故C错误;
D.由图可知,硫代硫酸根离子浓度为0.001 ml/L时,溶液中溴离子浓度最大,大于,则溶液中的浓度小于的浓度,所以溶液中离子浓度大小顺序为,故D正确;
故选AC。
13.(2024·四川成都·模拟预测)常温下,分别在溶液中滴加NaOH溶液,溶液中,X代表、、、与pH关系如图所示。已知:>。下列叙述正确的是
A.图中代表:与pH的关系,代表与pH的关系
B.同时产生两种沉淀时,
C.再向体系中加入硫化钠溶液,减少,将变小
D.的平衡常数
【答案】D
【分析】分别在溶液中滴加NaOH溶液,溶液中、、逐渐减小,逐渐增大,溶液中逐渐增大且起始时pH
【解析】A.图中分别代表、、、与pH的关系,故A错误;
B.,,则同时产生两种沉淀时,,故B错误;
C.再向体系中加入硫化钠溶液,减少,将不变,其只受温度的影响,故C错误;
D.,
反应的平衡常数
,故D正确。
答案选D。
14.(2024·安徽·三模)常温下,分别在、、溶液中滴加NaOH溶液,溶液pX=-lgX,X代表、、与pH的关系如图所示。
已知:。下列说法不正确的是
A.
B.的数量级为
C.
D.d点存在
【答案】C
【分析】Mn(OH)2、Zn(OH2的物质类型相似,二者的pX随pH的变化曲线应是平行线,则曲线ad代表与pH的关系,由图中a点可知可知pX=0时,溶液的pH=3.3,此时=c(H+)=1×10-3.3;已知:,纵坐标值越大表示阳离子浓度越小,可以判断出b所在曲线表示与pH的关系曲线,c所在的曲线表示与pH的关系曲线
【解析】A.由上述分析可知,,A正确;
B.b所在曲线表示,与pH的关系曲线,根据b点的坐标值,此时c(Zn2+)=1×10-6.15,c(OH-)=1×10-5,,数量级为10-17,B正确;
C.c所在曲线表示,与pH的关系曲线,根据c点的坐标值,此时c(Mn2+)=1×101.3,c(OH-)=1×10-7,,的平衡常数,C错误;
D.d点溶液呈中性,电荷守恒等式为:,根据可得,D正确。
故选C。
15.(2024·山西大同·模拟预测)某温度时,卤化银(AgX,X=Cl、Br、I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的依次减小。已知,,利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中和的相互关系。下列说法错误的是
A.坐标点p形成的溶液是AgCl的不饱和溶液
B.向含有、和的溶液中逐滴加入溶液,首先沉淀
C.该温度时,的平衡常数
D.m、n、p三点的相同
【答案】B
【分析】由题意可知,、越大,pAg、pX越小,由于AgCl、AgBr、AgI的依次减小,故A线表示AgCl的溶解平衡直线,B线表示AgBr的溶解平衡直线,C线表示AgI的溶解平衡直线。
【解析】A.p点位于AgCl的溶解平衡直线上方,其形成的溶液为AgCl的不饱和溶液,A正确;
B.若向含有等物质的量浓度的、和的溶液中逐滴加入溶液,首先沉淀,该题没有控制三种离子的物质的量浓度相同,B错误;
C.该反应的平衡常数,根据题图,t℃时,pAg=0时,pCl-=10,则,pAg=0时,pI-=16,则,故,C正确;
D.m、n、p三点的温度相同,相同,D正确;
故选B。
1.(2024·辽宁卷)下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③时,,。
下列说法错误的是( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+2H+2Ag++HCrO4-的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 ml·L-1
D.滴定Br-达终点时,溶液中
【答案】D
【解析】由于AgCl和AgBr中阴、阳离子个数比均为1:1,即两者图象平行,所以①代表Ag2CrO4,由于相同条件下,AgCl溶解度大于AgBr,即,所以②代表AgCl,则③代表AgBr,根据①上的点(2.0,7.7),可求得,根据②上的点(2.0,7.7),可求得,根据③上的点(6.1,6.1),可求得。A项,曲线②为AgCl沉淀溶解平衡曲线,A正确;B项,反应Ag2CrO4+2H+2Ag++HCrO4-的平衡常数,B正确;C项,当Cl-恰好滴定完全时,,即,因此,指示剂的浓度不宜超过10-2ml/L,C正确;D项,当Br-到达滴定终点时,,即,,D错误;故选D。
2.(2024·浙江卷)室温下,H2S水溶液中各含硫微粒物质的量分数随变化关系如下图[例如]。已知:。
下列说法正确的是( )
A.溶解度:FeS大于Fe(OH)2
B.以酚酞为指示剂(变色的范围8.2~10.0),用标准溶液可滴定H2S水溶液的浓度
C.忽略S2-的第二步水解,0.1ml/L的Na2S溶液中S2-水解率约为
D. 0.010ml/L的FeCl2溶液中加入等体积的Na2S溶液,反应初始生成的沉淀是FeS
【答案】C
【解析】在H2S溶液中存在电离平衡:H2SH++HS-、HS-H++S2-,随着pH的增大,H2S的物质的量分数逐渐减小,HS-的物质的量分数先增大后减小,S2-的物质的量分数逐渐增大,图中线①、②、③依次代表H2S、HS-、S2-的物质的量分数随pH的变化,由①和②交点的pH=7可知Ka1(H2S)=1×10-7,由②和③交点的pH=13.0可知Ka2(H2S)=1×10-13。A项,FeS的溶解平衡为FeS(s)Fe2+(aq)+S2-(aq),饱和FeS溶液物质的量浓度为=ml/L=×10-9ml/L,Fe(OH)2的溶解平衡为Fe(OH)2Fe2+(aq)+2OH-(aq),饱和Fe(OH)2溶液物质的量浓度为=ml/L=×10-6ml/L>×10-9ml/L,故溶解度:FeS小于Fe(OH)2,A项错误;B项,酚酞的变色范围为8.2~10,若以酚酞为指示剂,用NaOH标准溶液滴定H2S水溶液,由图可知当酚酞发生明显颜色变化时,反应没有完全,即不能用酚酞作指示剂判断滴定终点,B项错误;C项,Na2S溶液中存在水解平衡S2-+H2OHS-+OH-、HS-+H2OH2S+OH-(忽略第二步水解),第一步水解平衡常数Kh(S2-)=====0.1,设水解的S2-的浓度为x ml/L,则=0.1,解得x≈0.062,S2-的水解率约为×100%=62%,C项正确;D项,0.01ml/L FeCl2溶液中加入等体积0.2ml/L Na2S溶液,瞬间得到0.005ml/L FeCl2和0.1ml/L Na2S的混合液,结合C项,瞬时c(Fe2+)c(S2-)=0.005ml/L×(0.1ml/L-0.062ml/L)=1.9×10-4>Ksp(FeS),c(Fe2+)c2(OH-)=0.005ml/L×(0.062ml/L)2=1.922×10-5>Ksp[Fe(OH)2],故反应初始生成的沉淀是FeS和Fe(OH)2,D项错误;故选C。
3.(2024·湖北卷)CO2气氛下,Pb(ClO4)2溶液中含铅物种的分布如图。纵坐标(δ)为组分中铅占总铅的质量分数。已知c0(Pb2+)=2.0×10-5ml/L,、,。下列说法错误的是( )
A.pH=6.5时,溶液中c(CO32-)
C.pH=7时,c(Pb2+)+c[Pb(OH)+]<2c(CO32-)+c(HCO3-)+c(ClO4-)
D.pH=8时,溶液中加入少量NaHCO3(s),PbCO3会溶解
【答案】C
【解析】A项,由图可知,pH=6.5时δ(Pb2+)>50%,即c(Pb2+)>1×10-5ml/L,则c(CO32-)≤=ml/L=10-7.1ml/L
4.(2023·全国甲卷)下图为Fe (OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是( )
A.由点可求得Ksp[Fe (OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为
C.浓度均为0.01ml·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+) =0.2ml·L-1时二者不会同时沉淀
【答案】C
【解析】A项,由点a(2,2.5)可知,此时pH=2,pOH=12,则Ksp[Fe (OH)3] =c(Fe3+)·c3(OH-)=10-2.5×(10-12)3=10-38.5,故A错误;B项,由点(5,6)可知,此时pH=5,pOH=9,则Ksp[Al(OH)3] =c Al3+)·c3(OH-)=10-6×(10-9)3=10-33,pH=4时Al(OH)3的溶解度为=10-3 ml·L-1,故B错误;C项,由图可知,当铁离子完全沉淀时,铝离子尚未开始沉淀,可通过调节溶液pH的方法分步沉淀Al3+和Fe3+,故C正确;D项,由图可知,Al3+沉淀完全时,pH约为4.7,Cu2+刚要开始沉淀,此时c(Cu2+) =0.1ml·L-1,若c(Cu2+) =0.2ml·L-1> 0.1ml·L-1,则Al3+、Cu2+会同时沉淀,故D错误;故选C。
5.(2023·北京卷)利用平衡移动原理,分析一定温度下Mg2+在不同的Na2CO3体系中的可能产物。
已知:i.图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与的关系。
ii.2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ks[Mg(OH)2)];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(CO32-)=Ks(MgCO3) [注:起始c(Na2CO3)=0.1ml·L-1,不同下c(CO32-)由图1得到]。
下列说法不正确的是( )
A.由图1,pH=10.25,c(HCO3-)= c(CO32-)
B.由图2,初始状态pH=11、lg[c(Mg2+)]= -6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]= -2,平衡后溶液中存在c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1ml·L-1
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]= -1,发生反应:Mg2++2HCO3-= MgCO3↓+CO2↑+H2O
【答案】C
【解析】A项,水溶液中的离子平衡 从图1可以看出pH=10.25时,碳酸氢根离子与碳酸根离子浓度相同,A项正确;B项,从图2可以看出pH=11、lg[c(Mg2+)]= -6时,该点位于曲线Ⅰ和曲线Ⅱ的下方,不会产生碳酸镁沉淀或氢氧化镁沉淀,B项正确;C项,从图2可以看出pH=9、lg[c(Mg2+)]= -2时,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,根据物料守恒,溶液中c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1ml·L-1,C项错误;D项,pH=8时,溶液中主要含碳微粒是HCO3-,pH=8,lg[c(Mg2+)]= -1时,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,因此反应的离子方程式为Mg2++2HCO3-= MgCO3↓+CO2↑+H2O,D项正确;故选C。
6.(2022·湖北卷)下图是亚砷酸As(OH)3和酒石酸(H2T, lgKa1=-3.04, lgKa2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 ml ·L-1,总T为1.0×10-3 ml ·L-1)。下列说法错误的是( )
A.As(OH)3的lgKa1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高物种为As(OH)3
【答案】D
【解析】A.As(OH)3[As(OH)2O]-+H+,Ka1=eq \f(c\b\lc\{\rc\}(\a\vs4\al\c1([As(OH)2O]-))×c(H+),c[As(OH)3]),当pH=9.1时,ceq \b\lc\{\rc\}(\a\vs4\al\c1([As(OH)2O]-))=c[As(OH)3],Ka1=c(H+)=10-9.1,lgKa1为-9.1,A正确;B.[As(OH)2T]-[AsO(OH)T]2-+H+,Ka=eq \f(c\b\lc\{\rc\}(\a\vs4\al\c1([AsO(OH)T]2-))×c(H+),c\b\lc\{\rc\}(\a\vs4\al\c1([As(OH)2T]-))),当pH=4.6时,ceq \b\lc\{\rc\}(\a\vs4\al\c1([AsO(OH)T]2-))=ceq \b\lc\{\rc\}(\a\vs4\al\c1([As(OH)2T]-)),Ka=10-4.6,而由A选项计算得H3AsO3的Ka1=c(H+)=10-9.1,即Ka>Ka1,所以[As(OH)2T]-的酸性比As(OH)3的强,B正确;C.由图可知As(OH)3的浓度为左坐标,浓度的数量级为10-3 ml/L,[As(OH)2T]-的浓度为右坐标,浓度的数量级为10-6 ml/L,所以pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高,C正确;D.由题给条件可知,酒石酸(H2T lgKa1=-3.04 lgKa2=-4.37),As(OH)3的lgKa1为-9.1,即酒石酸的第一步电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
7.(2022·浙江卷)某同学在两个相同的特制容器中分别加入20 mL 0.4 ml·L-1 Na2CO3溶液和40 mL 0.2 ml·L-1 NaHCO3溶液,再分别用0.4 ml·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
下列说法正确的是( )
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HCOeq \\al(-,3)+H+===CO2↑+H2O
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(COeq \\al(2-,3))=c(OH-)-c(H+)
【答案】C
【解析】因为COeq \\al(2-,3)比HCOeq \\al(-,3)的水解程度大,且Na2CO3溶液浓度比NaHCO3溶液大,故Na2CO3溶液的起始pH较大,甲线表示向Na2CO3溶液中滴加盐酸,向Na2CO3溶液中滴加盐酸时,COeq \\al(2-,3)→HCOeq \\al(-,3)→H2CO3→CO2,开始加入盐酸时没有CO2产生,故丁线表示向Na2CO3溶液中滴加盐酸,A项错误;从图像可以看出,b点尚未放出CO2,此时反应的离子方程式是HCOeq \\al(-,3)+H+===H2CO3,B项错误;图像显示c点pH在8~10,则可以用酚酞作指示剂,d点pH在3~4,则可以用甲基橙作指示剂,C项正确;根据质子守恒,Na2CO3溶液中c(OH-)=c(H+)+c(HCOeq \\al(-,3))+2c(H2CO3),D项错误。
8.(2022·山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 ml·L-1、1.0 ml·L-1Na2CO3溶液,含SrSO4(s)的0.1 ml·L-1、1.0 ml·L-1Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/ml·L-1]随pH的变化关系如图所示。下列说法错误的是( )
A.反应SrSO4(s)+COeq \\al(2-,3)(aq)SrCO3(s)+SOeq \\al(2-,4)(aq)的平衡常数K=eq \f(Ksp(SrSO4),Ksp(SrCO3))
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 ml·L-1Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 ml·L-1的混合溶液,pH≥7.7时才发生沉淀转化
【答案】D
【解析】硫酸是强酸,溶液pH变化,溶液中硫酸根离子浓度几乎不变,则含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线①代表含硫酸锶固体的0.1 ml/L硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1.0 ml/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子浓度越小,锶离子浓度越大,pH相同时,1.0 ml/L碳酸钠溶液中碳酸根离子浓度大于0.1 ml/L碳酸钠溶液,则曲线③表示含碳酸锶固体的0.1 ml/L碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1.0 ml/L碳酸钠溶液的变化曲线。A.反应SrSO4(s)+COeq \\al(2-,3)(aq)SrCO3(s)+SOeq \\al(2-,4)(aq)的平衡常数K=eq \f(c(SOeq \\al(2-,4)),c(COeq \\al(2-,3)))=eq \f(c(SOeq \\al(2-,4))·c(Sr2+),c(COeq \\al(2-,3))·c(Sr2+))=eq \f(Ksp(SrSO4),Ksp(SrCO3)),故A正确;B.由分析可知,曲线①代表含硫酸锶固体的0.1 ml/L硫酸钠溶液的变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10-5.5×0.1=10-6.5,温度不变,溶度积不变,则溶液pH为7.7时,曲线②中c(SOeq \\al(2-,4))=1.0 ml/L,锶离子的浓度为eq \f(10-6.5,1.0) ml/L=10-6.5 ml/L,则a为-6.5;C.由分析可知,曲线④表示含碳酸锶固体的1.0 ml/L碳酸钠溶液的变化曲线,故C正确;D.由分析可知,硫酸是强酸,溶液pH变化,溶液中硫酸根离子浓度几乎不变,则含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,所以硫酸锶的生成与溶液pH无关,故D错误。
9.(2022·海南卷)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:M(OH)2(s)M2+(aq)+2OH-(aq)、M(OH)2(s)+2OH-(aq)M(OH)eq \\al(2-,4)(aq),25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH)eq \\al(2-,4)浓度的值。下列说法错误的是( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 ml·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH)eq \\al(2-,4)]=0.1 ml·L-1的溶液中加入等体积0.4 ml/L的HCl后,体系中元素M主要以M2+存在
【答案】BD
【解析】M(OH)2(s)M2+(aq)+2OH-(aq),M(OH)2(s)+2OH-(aq)M(OH)eq \\al(2-,4)(aq),随着pH增大,c(OH-)增大,则c(M2+)减小,c[M(OH)eq \\al(2-,4)]增大,即-lgc(M2+)增大,-lgc[M(OH)eq \\al(2-,4)]减小,因此曲线①代表-lgc(M2+)与pH的关系,曲线②代表-lgc[M(OH)eq \\al(2-,4)]与pH的关系,据此分析解答。A.由分析可知,曲线①代表-lgc(M2+)与pH的关系,A正确;B.由图像,pH=7.0时,-lgc(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,B错误;C.向c(M2+)=0.1 ml/L的溶液中加入NaOH溶液至pH=9.0,根据图像,pH=9.0时,c(M2+)、c[M(OH)eq \\al(2-,4)]均极小,则体系中元素M主要以M(OH)2(s)存在,C正确;D.c[M(OH)eq \\al(2-,4)]=0.1 ml/L的溶液中,由于溶解平衡是少量的,因此加入等体积的0.4 ml/L的HCl后,体系中元素M仍主要以M(OH)eq \\al(2-,4)存在,D错误。
考点内容
考点分布
电解质溶液微粒变化图像
2023湖南卷,3分;2022河北卷,3分;2022浙江卷,2分;2022福建卷,4分;
2022浙江卷,2分;2021浙江卷,2分;2021浙江卷,2分;2021湖南卷,3分;
沉淀溶解平衡图像
2024·辽宁卷,3分;2024·浙江卷,3分;2024·湖北卷,3分;2024·全国甲卷,6分;2023辽宁卷,3分;2023全国甲卷,6分;2023新课标卷,6分;2023山东卷,4分;2023北京卷,3分;2022福建卷,4分;2022湖南卷,3分;2022山东卷,4分;
2022海南卷,4分;
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
点
溶质
离子浓度大小比较
A
CH3COOH
c(H+)>c(CH3COO-)>c(OH-)
B(1∶1)
CH3COOH、H3COONa
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C(pH=7)
CH3COOH、CH3COONa
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D
CH3COONa
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
E(2∶1)
CH3COONa、NaOH
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
F(1∶1)
CH3COONa、NaOH
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
点
溶质
水的电离情况
pH—V图
A
CH3COOH
抑制
B
CH3COOH、CH3COONa
抑制
C
CH3COOH、CH3COONa
正常电离
D
CH3COONa
只促进
E
CH3COONa、NaOH
抑制
F
CH3COONa、NaOH
抑制
结论:水的电离程度大小顺序为: D>C>B>A>E>F
一元弱酸(以CH3COOH为例)
二元弱酸(以草酸H2C2O4为例)
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数
δ0为H2C2O4分布系数、δ1为HC2Oeq \\al(-,4)分布系数、δ2为C2Oeq \\al(2-,4)分布系数
1.随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布系数可以书写一定pH时所发生反应的离子方程式
2.同一pH条件下可以存在多种溶质微粒。根据在一定pH的微粒分布系数和酸的浓度,就可以计算各成分在该pH时的平衡浓度
以“BaSO4(s) Ba2+(aq)+SOeq \\al(2-,4)(aq)”为例
图像展示
点的变化
a→c
在曲线上变化,增大c(SOeq \\al(2-,4))
b→c
加入1×10-5 ml·L-1 Na2SO4溶液(加水不可以)
d→c
加入BaCl2固体(忽略溶液的体积变化)
c→a
在曲线上变化,增大c(Ba2+)
溶液蒸发时,离子浓度的变化
原溶液不饱和时,离子浓度都增大;原溶液饱和时,离子浓度都不变
溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同
以“BaSO4”为例
曲线可知信息
①曲线上各点的意义:每条曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液
T1曲线:a、b点都表示饱和溶液,c点表示过饱和溶液
T2曲线:a、b、c点都表示不饱和溶液
②计算Ksp:由a或b点可以计算出T1温度下的Ksp
③比较T1和T2大小:因BaSO4沉淀溶解平衡吸热,可知:T1
曲线可知信息
①曲线上各点的意义:每条曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液
ZnS曲线:a点表示饱和溶液,c点表示不饱和溶液
CuS曲线:b点表示饱和溶液,c点表示过饱和溶液
②计算Ksp:由曲线上面给定数据可以计算CuS、ZnS的Ksp
③比较Ksp大小:Ksp(ZnS)>Ksp(CuS)
图像
展示
关系
函数关系:随着COeq \\a3(2-,3)浓度增大,Ca2+浓度减小
曲线
可知
信息
①横坐标数值越大,COeq \\a3(2-,3)越小;纵坐标数值越小,c(M)越大
②直线上各点的意义:直线上的任何一点为饱和溶液;直线上方的点为不饱和溶液;直线下方的点为过饱和溶液,有沉淀生成
如:c点,相对于MgCO3来说,处于直线上方,为不饱和溶液;相对于CaCO3来说,处于直线下方,为过饱和溶液,此时有CaCO3沉淀生成
③计算Ksp:由曲线上面给定数据可以计算出相应的Ksp
④比较Ksp大小:Ksp(MgCO3)>Ksp(CaCO3)>Ksp(MnCO3)
滴定曲线
曲线可知信息
①曲线上各点的意义:曲线上任一点(a、b、c点)都表示饱和溶液
②计算Ksp:由b点恰好完全反应可知c(Cu2+)=10-17.7,进而求出Ksp=10-17.7×10-17.7=10-35.4
③比较a、b、c三点水的电离程度大小
相关试卷
这是一份考点07 物质的量浓度(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)(解析版),文件包含考点07物质的量浓度核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用原卷版docx、考点07物质的量浓度核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
这是一份考点03 离子共存 离子检验与推断(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用)(解析版),文件包含考点03离子共存离子检验与推断核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用原卷版docx、考点03离子共存离子检验与推断核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
这是一份微考点04 晶胞计算(核心考点精讲精练)-2025年高考化学一轮复习讲练专题(新高考通用),文件包含微考点04晶胞计算核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用原卷版docx、微考点04晶胞计算核心考点精讲精练-2025年高考化学一轮复习讲练专题新高考通用解析版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。












