


福建省福州十校2024-2025学年高三上学期期中考试化学试题
展开
这是一份福建省福州十校2024-2025学年高三上学期期中考试化学试题,文件包含福建省福州十校2024-2025学年高三上学期期中考试化学试题docx、2024-2025学年第一学期联考化学试题pdf、2024-2025学年第一学期联考化学试题参考答案docx等3份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
(满分:100 分;考试时间:75 分钟)
班级 姓名 座号
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Cu-64
一.选择题(本大题共10小题,每小题4分,共40分)
1.科技发展与化学密切相关。下列说法正确的是( )
A.福建舰舰体材料无磁镍铬钛合金钢硬度高于纯铁
B.钍核反应堆的主要原料是,与互为同位素
C.制造5G芯片材质之一氮化镓(GaN)为金属晶体
D.嫦娥5号带回的月壤中含有Al元素,Al属于s区元素
2.下列对事实解释正确的是( )
3.蛇烯醇(Serpentenynenynl)的结构如图所示,特别像一条蛇。下列关于蛇烯醇说法
错误的是( )
A.蛇烯醇可以进行催化氧化反应,得到醛类物质
B.1ml该物质与足量溴水反应,最多可消耗6mlBr2
C.蛇烯醇可以使酸性高锰酸钾溶液褪色
D.蛇烯醇中含有3个手性碳
4.下列有关化学方程式或离子方程式正确的是( )
A.AgCl沉淀溶于氨水:AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl- + 2H2O
B.向次氯酸钙溶液通入少量二氧化碳:
C.碘化亚铁溶液与等物质的量的氯气:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
D.食醋去除水垢中的CaCO3:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
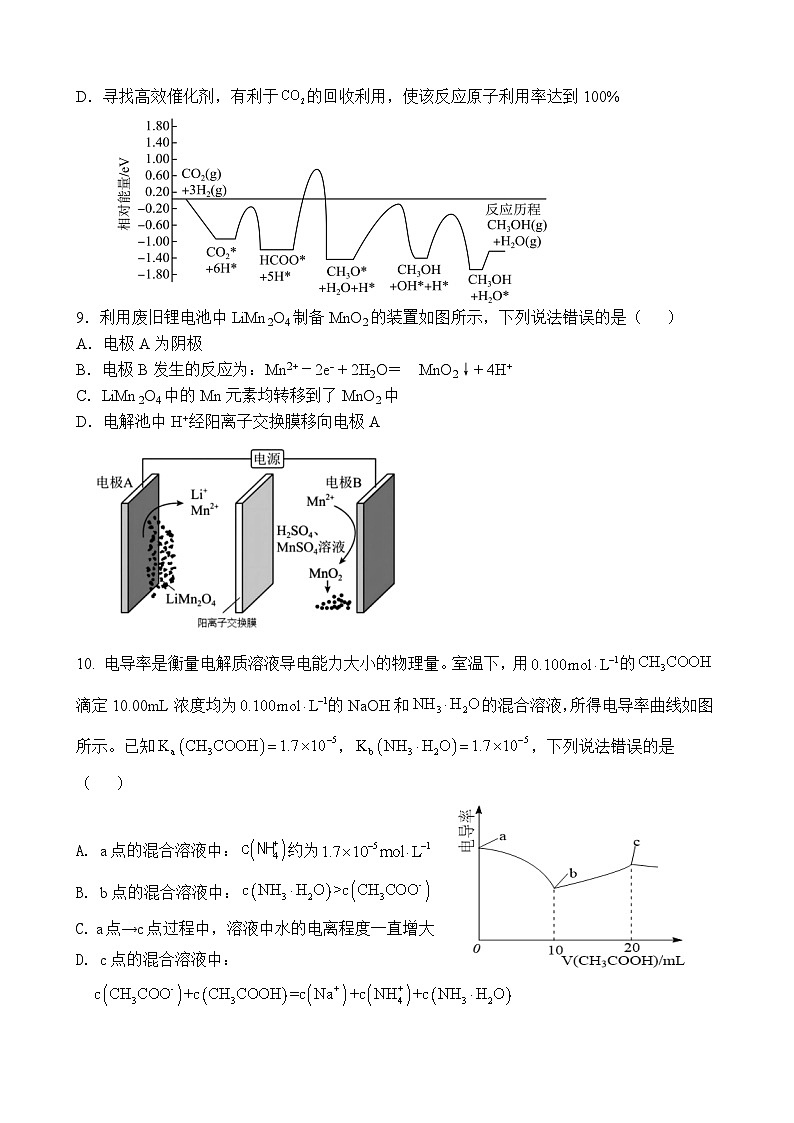
5.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z为原子序数依次增大的五种短
周期主族非金属元素,Z是地壳中含量最多的元素。下列说法正确的是( )
A.基态原子的第一电离能:W<X<Y<Z
B.Z基态原子未成对电子数:4个
C.1 ml该化合物中含有配位键的数目为2NA
D.W基态原子的电子的空间运动状态有5种
6.设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1 ml NH4Cl含有的共价键数目为5NA
B.标准状况下,22.4LSO3含有的原子数为4NA
C.1ml SiO2晶体中含有2NA个Si-O键
D.含1 ml NH4+中的电子数为10NA
7.用下列图示实验装置进行实验,能达到相应实验目的的是( )
A.用图①所示装置配制银氨溶液
B.用图②所示装置证明
C.用图③所示装置海水蒸馏制淡水
D.用图④所示装置蒸发结晶制明矾晶体
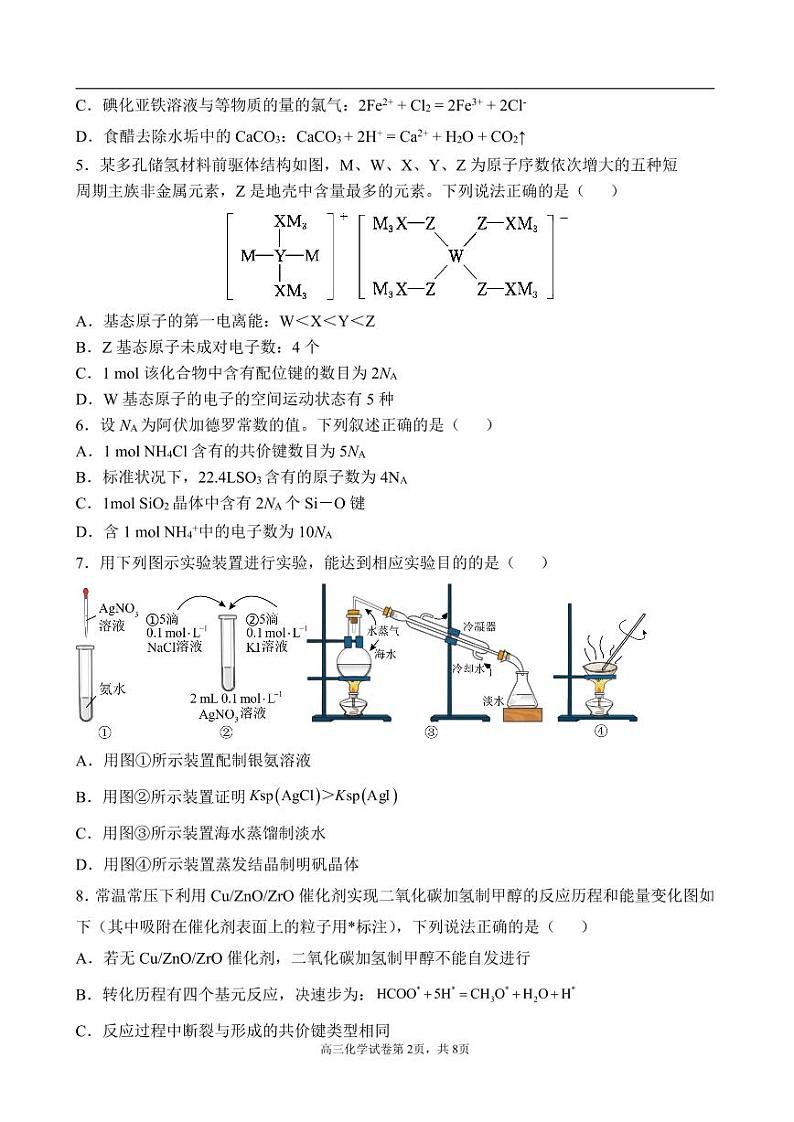
8.常温常压下利用Cu/ZnO/ZrO催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注),下列说法正确的是( )
A.若无Cu/ZnO/ZrO催化剂,二氧化碳加氢制甲醇不能自发进行
B.转化历程有四个基元反应,决速步为:
C.反应过程中断裂与形成的共价键类型相同
D.寻找高效催化剂,有利于的回收利用,使该反应原子利用率达到100%
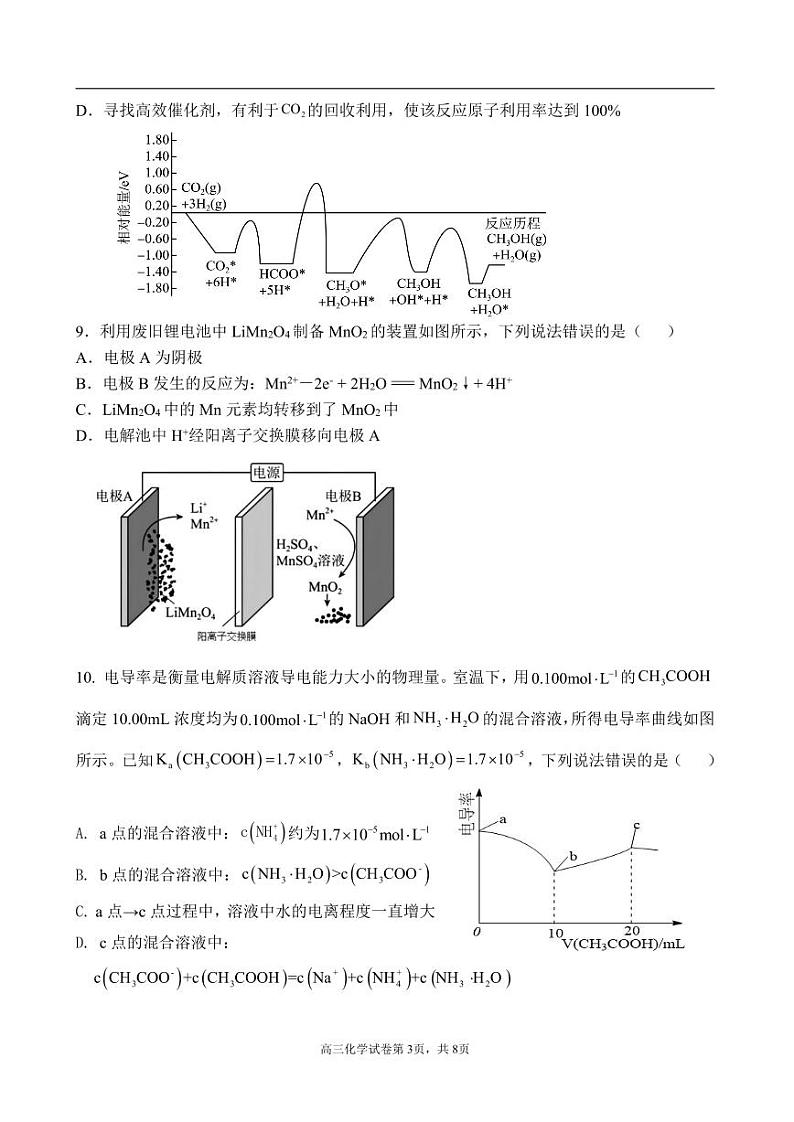
9.利用废旧锂电池中LiMn2O4制备MnO2的装置如图所示,下列说法错误的是( )
A.电极A为阴极
B.电极B发生的反应为:Mn2+-2e- + 2H2O=MnO2↓+ 4H+
C.LiMn2O4中的Mn元素均转移到了MnO2中
D.电解池中H+经阳离子交换膜移向电极A
10. 电导率是衡量电解质溶液导电能力大小的物理量。室温下,用的滴定10.00mL浓度均为的NaOH和的混合溶液,所得电导率曲线如图所示。已知,,下列说法错误的是( )
A. a点的混合溶液中:约为
B. b点的混合溶液中:
C. a点→c点过程中,溶液中水的电离程度一直增大
D. c点的混合溶液中:
二、非选择题(本题共4小题,共60分)
11. (15分)是重要漂白剂和消毒剂,主要用于水、砂糖、油脂的漂白杀菌。实验室制备装置如图1所示。
已知:i.NaClO2的溶解度曲线如图2所示;若溶液温度高于60℃,NaClO2发生分解。
ii.ClO2气体浓度超过10%时,易发生爆炸性分解。
(1)装置A中发生的主要反应的化学方程式:
。
(2)下列实验操作一定能提高吸收效率的有______。
A.装置C采用热水浴 B.加快滴加浓硫酸的速率
C.适当提高的浓度 D.通过多孔球泡向C的混合溶液中通
(3)试管C中获得的产品往往混有杂质,其原因是 。
(4)反应过程中,打开,并缓慢鼓入的目的是 , 。
(5)反应结束后,补充完整制取晶体的实验方案:取试管C中的溶液, ,
38℃趁热过滤,38℃~60℃热蒸馏水洗涤晶体,至取最后一次洗涤液滴加盐酸和溶液
无沉淀产生,低温干燥,得到晶体。
(6)产品中质量分数的测定:称取5.000g产品配成250mL溶液;取25.00mL所配溶液,加入足量KI溶液和稀硫酸,发生反应:(方程式未配平);向充分反应后的混合物中逐滴加入0.8400 溶液至恰好完全反应:(方程式均未配平),消耗溶液20.00 mL。
①该滴定实验中使用的指示剂为 ,滴定终点的现象是 。
②若加入KI溶液后在空气中放置时间过长,会导致测得的质量分数
(填“偏高”“偏低”或“无影响”)。
12.(19分)二氧化铈(CeO2)类似MnO2具有较强的氧化性,是一种应用非常广泛的稀土氧化物。
以氟碳铈矿(主要含CeFCO3、BaO等)为原料制备CeO2的一种工艺流程如图所示。
回答下列问题:
(1)“氧化焙烧”后,Ce元素转化为CeO2和CeF4。写出氧化焙烧的化学方程式:
。
(2)“酸浸”时,铈的浸出率与温度、c(H+)的关系如图所示,应选择的最适宜的条件为
(填标号)。不能用盐酸代替硫酸进行酸浸,理由是 。
a.65 ℃ 2.0 ml·L-1
b.75 ℃ 2.0 ml·L-1
c.85 ℃ 2.5 ml·L-1
d.100 ℃ 2.5 ml·L-1
(3)“系列操作”包含以下几个过程:
已知:Ce3+不能溶于有机物TBP,CeF3+能溶于有机物TBP,且存在反应:
CeF3+ + TBPCeTBP4+ + F-。“系列操作”在 (填仪器名称)中完成。
(4)“调pH”中,要使Ce3+沉淀完全(通常认为溶液中离子浓度小于1.0×10-5 ml·L-1为沉淀完全),应控制pH大于 (已知25 ℃时Ksp[Ce(OH)3]=1×10-20)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为 。
(6)检验乙醛中的醛基常用新制氢氧化铜悬浊液,反应方程式为:
回答下列问题:
①基态Cu+的价电子轨道表示式为____,基态铜原子的电子占据___种能量不同的原子轨道。
②乙酸钠晶体中存在的微粒间作用力有___________(填标号)。
A. 非极性键 B. 金属键 C. 范德华力 D. 离子键
③生成的Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(0.5,0.5,0.5),C为(1,1,1),则D原子的坐标参数为___________。若该晶胞参数为anm,则晶胞密度为
g/cm3(用NA、a表示)
13.(12分)氮是自然界重要元素之一,氮及其化合物的性质以及氮的循环利用对解决环境
和能源问题都具有重要意义。
已知:1 ml物质中的化学键断裂时所需能量如下表。
(1)恒温下,将1 ml空气(N2和O2的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为V L的恒容密闭容器中,假设体系中只存在如下两个反应:
i.N2(g) + O2(g)2NO(g) K1 ΔH1
ii.2NO(g) + O2(g)2NO2(g) K2 ΔH2=-114 kJ·ml-1
①ΔH1= kJ·ml-1。
②以下操作可以降低上述平衡体系中NO浓度的有 (填标号)。
a.升高温度 b.移除NO2 c.降低N2浓度
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。
其反应机理如图1(其中H2O和NaCl略去)。NaClO氧化NH3的化学反应程式为
。
图1
(3)改变eq \f(n(NaClO), n(NH3))对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)
的影响如图2所示,则除氨气过程中最佳的eq \f(n(NaClO), n(NH3))值约为 。
图2
(4)室温下,用水稀释0.1 ml⋅L-1氨水,溶液中随着水量的增加而减小的是________。
a.eq \f(c(NHeq \\al(+,4))·c(OH-),c(NH3·H2O)) b.eq \f(c(NH3·H2O), c(OH-))
c.c(H+) d.eq \f(c(OH-), c(H+))
(5)工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH2COONH4
ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化图3,下列说法正确的是 。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ 为放热反应,ⅱ 为吸热反应
c.CO(l) + 2NH3(l)=CO2(NH2)2(l) + H2O(l) ΔH=E1-E4
图3
14.(14分)法匹拉韦(有机物Ⅰ)是一种广谱抗病毒仿制药,其含有的环状结构与苯的共辄
结构类似。一种合成法匹拉韦的路线如图所示:
已知:①; ②;
③化合物F、G不易分离,萃取剂的极性过大则常得到黑色糊状物,过小则萃取率不高。
回答下列问题:
(1)化合物A中所有元素的电负性由大到小的顺序为 ,
化合物B中含氧官能团的名称为 。
写出A生成B的化学方程式: 。
(2)C的结构简式为 ,化合物D中碳原子的杂化方式为 ;
F到G的反应类型为 。
(3)D的同分异构体J满足下列条件:
①J与其一种水解产物均可以发生银镜反应;
②J的谱如右图所示;
③J含有两种含氧官能团,不存在两个氧原子相连或氧原子与溴原子相连的情况;
④J含有环状结构。
请写出J的结构简式: ________________ (一种即可)。
(4)根据已有知识并结合相关信息,将以A为原料制备的合成路线补充完整。
。
选项
事实
解释
A
常温下,Cl2为气体,Br2为液体
键能:Cl2 >Br2
B
中显正价
电负性:
C
原子半径:
最外层电子数:
D
稳定性:
中有氢键
物质
N2(g)
O2(g)
NO(g)
能量/ kJ·ml-1
945
498
631
相关试卷
这是一份福建省福州市八县(市)协作校2024-2025学年高三上学期期中联考化学试卷,文件包含24251期中联考高三化学试卷docx、24251期中联考高三化学评分标准docx等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
这是一份湖南省湘东十校2024-2025学年高三上学期10月联考 化学试题,共15页。
这是一份湖南省湘东十校2024-2025学年高三上学期10月联考 化学试题,文件包含湖南省湘东十校2025届高三10月联考化学试题docx、化学答案湘东十校10月联考pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。









