






2025年高考化学一轮复习课件(新高考版)大单元4 第12章 第56讲 溶液中的粒子平衡曲线分类突破
展开1.能正确识别图像,能从图像中找到曲线指代、趋势、关键点。2.利用溶液中的平衡关系,学会分析不同类型图像中各粒子浓度之间的关系。
类型一 中和反应进程中pH变化曲线
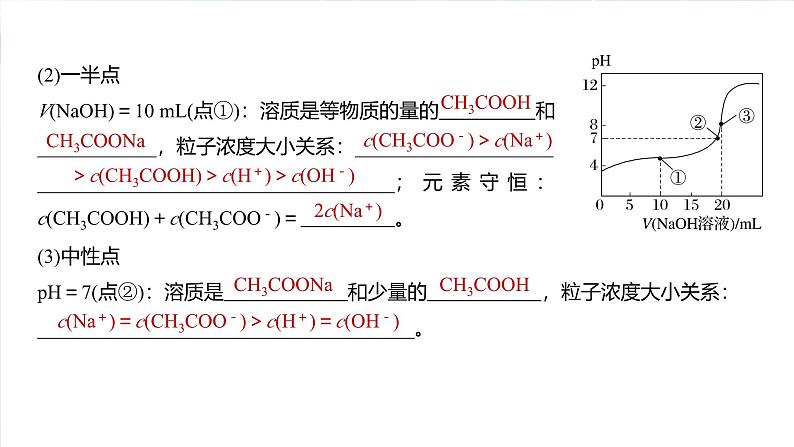
解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、反应一半点、中性点、恰好反应点和过量点,先判断出各点中的溶质及溶液的酸碱性。以室温时用0.1 ml·L-1NaOH溶液滴定20 mL 0.1 ml·L-1 CH3COOH溶液为例(如图),总结如何抓住滴定曲线的5个关键点。
(1)起点V(NaOH)=0(0点):溶质是 ,粒子浓度大小关系:_______________________________________________。
c(CH3COOH)>
c(H+)>c(CH3COO-)>c(OH-)
(2)一半点V(NaOH)=10 mL(点①):溶质是等物质的量的 和____________,粒子浓度大小关系:________________________________________________________;元素守恒:c(CH3COOH)+c(CH3COO-)= 。
c(CH3COO-)>c(Na+)
>c(CH3COOH)>c(H+)>c(OH-)
(3)中性点pH=7(点②):溶质是 和少量的 ,粒子浓度大小关系:______________________________________。
c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
(4)恰好反应点V(NaOH)=20 mL(点③):溶质是 ,粒子浓度大小关系: 。(5)过量1倍点V(NaOH)=40 mL:溶质是等物质的量的 和________,粒子浓度大小关系:______________________________________________。
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(OH-)>
c(CH3COO-)>c(H+)
1.(2021·湖南,9)常温下,用0.100 0 ml·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 ml·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+ c(Y-)+c(Z-)=c(H+)-c(OH-)
NaX为强碱弱酸盐,在溶液中水解使溶液呈碱性,则溶液中离子浓度的大小顺序为c(Na+)>c(X-)>c(OH-)>c(H+),故A正确;
弱酸的酸性越弱,电离常数越小,相应钠盐的水解程度越大,由题图分析可知,HX、HY、HZ三种一元弱酸的酸性依次减弱,则三种一元弱酸的电离常数的大小顺序为Ka(HX)>Ka (HY)>Ka(HZ),故B正确;当溶液pH为7时,酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小,则三种溶液中酸根离子的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故C错误;
向三种盐溶液中分别滴加20.00 mL盐酸,三种盐都完全反应,溶液中钠离子浓度等于氯离子浓度,将三种溶液混合后溶液中存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(Y-)+c(Z-)+c(Cl-)+c(OH-),由c(Na+)=c(Cl-)可得:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),故D正确。
2.(2021·海南,13改编)25 ℃时,向10.00 mL 0.100 0 ml·L-1的NaHCO3溶液中滴加0.100 0 ml·L-1的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法正确的是
c点溶质为碳酸氢钠、氯化钠、碳酸,溶液中的H+主要来自H2CO3的电离,故C错误;d点,碳酸氢钠和盐酸恰好反应,c(Na+)=c(Cl-)=0.050 0 ml·L-1,故D错误。
3.已知pKa=-lg Ka,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 ml·L-1NaOH溶液滴定20 mL 0.1 ml·L-1H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
滴定过程中发生反应:NaOH+H2SO3===NaHSO3+H2O、NaHSO3+NaOH===Na2SO3+H2O。a点溶液中的溶质为NaHSO3和H2SO3,根据元素守恒得出,c(H2SO3)+
1.认识分布系数δ(X)与pH曲线分布系数曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
(2)“用交点”——交点是某两种粒子浓度相等的点,可计算电离常数K:
思考 请根据H2C2O4的两级电离常数,推理论证上述③中结论。
1.(2020·海南,12)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是A.该酸-lg Ka ≈的水解平衡常数Kh=C.当该溶液的pH=7.0时,c(HA)
NH2CH2COOH中存在—COOH和—NH2,所以甘氨酸既有酸性又有碱性,故A正确;
M点存在电荷守恒:c(R-)+c(OH-)+c(Cl-)=2c(H3R2+)+c(H2R+)+c(H+)+c(Na+),此时c(H3R2+)=c(H2R+),因此c(R-)+c(OH-)+c(Cl-)=3c(H2R+)+c(H+)+c(Na+),故B错误;
P点溶质为NaCl、HR、NaR,此时溶液呈碱性,因此c(OH-)>c(H+),溶质浓度大于水解和电离所产生的微粒浓度,因此c(Na+)>c(Cl-)>c(OH-)>c(H+),故D正确。
类型三 对数图像中的粒子浓度关系
1.破解对数图像的数据
2.破解对数图像的步骤(1)识图像:观察横坐标、纵坐标的含义,看清每条曲线代表的粒子种类以及曲线的变化趋势,计算电离常数时应利用两种粒子浓度相等的点,(2)找联系:根据图像中的坐标含义和曲线的交点,分析所给电解质的电离平衡常数或pH与纵、横坐标之间的联系。(3)想原理:涉及电离平衡常数,写出平衡常数表达式,在识图像、想原理的基础上,将图像与原理结合起来思考。(4)用公式:运用对数计算公式分析。
1.丙酮酸(CH3COCOOH)是一元弱酸。298 K时,向20 mL 0.1 ml·L-1丙酮酸溶液中滴加pH=13的NaOH溶液,溶液中 与pH的关系曲线如图所示。下列说法错误的是A.298 K时,CH3COCOOH的电离常数的数量级为10-3B.E点溶液中,a=2C.G点对应的NaOH溶液的体积为20 mLD.E、F、G三点对应的溶液中水的电离程度:E
横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与 的变化关系,B正确;
1.常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL 0.10 ml·L-1盐酸和20.00 mL 0.10 ml·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的顺序可能为 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.这两次滴定都可以用甲基橙作为指示剂
根据酸的初始pH知,图1为滴定盐酸的曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成
强酸强碱盐,其溶液呈中性;醋酸中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以b点氢氧化钠溶液的体积小于20.00 mL,a>b,故B错误;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
氢氧化钠和盐酸恰好反应,溶液呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠,溶液呈碱性,只能选择酚酞,故D错误。
2.(2023·大连高三联考)用0.100 0 ml·L-1的盐酸标准溶液分别滴定20.00 mL浓度均为0.100 0 ml·L-1的氨水和NaOH溶液,滴定曲线如图。下列说法错误的是A.滴加10.00 mL盐酸时,氨水中存在c(NH3·H2O)+c(OH-) =c(Cl-)+c(H+)B.分别滴加20.00 mL盐酸时,NaOH溶液中水的电离程度大 于氨水C.若用甲基橙作指示剂,滴定终点时NaOH溶液消耗盐酸的 量略大于氨水D.滴加10.00 mL盐酸时,氨水中存在c( )>c(Cl-)>c(OH-)>c(H+)
分别滴加20.00 mL盐酸时,恰好反应生成氯化钠和氯化铵,铵根离子能够水解,所以NaOH溶液中水的电离程度小于氨水,故B错误;若用甲基橙作指示剂,滴定终点时pH为3.1~4.4,若不考虑铵根离子水解,两份溶液消耗盐酸的量相等,铵根离子水解呈酸性,所以NaOH溶液消耗盐酸的量略大于氨水,故C正确;
3.(2024·厦门模拟)次氯酸为一元弱酸,具有强氧化性,能杀菌、消毒。其溶液中HClO、ClO-所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列说法错误的是A.该温度下,次氯酸的电离平衡常数Ka=10-5B.次氯酸的电离方程式为HClO H++ClO-C.向pH=5的次氯酸溶液中滴加少量的甲基橙,溶液 最终变为黄色
次氯酸为一元弱酸,电离方程式为HClO H++ClO-,B正确;次氯酸具有强氧化性,能漂白酸碱指示剂,故滴加甲基橙溶液后溶液最终变为无色,C错误;
4.某温度下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 ml·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-) >c(H+)C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN) -c(CH3COOH)D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)= c(CH3COOH)+c(H+)
A项,点①溶液中存在电荷守恒:c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),点②溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),错误;
B项,点③溶液pH=7,则c(OH-)=c(H+),则点③溶液中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),错误;
C项,点①所示的溶液中存在元素守恒:c(HCN)+c(CN-)=2c(Na+),点②所示的溶液中存在元素守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确。
5.(2021·浙江6月选考,23)取两份10 mL 0.05 ml·L-1的NaHCO3溶液,一份滴加0.05 ml·L-1的盐酸,另一份滴加0.05 ml·L-1 NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图,下列说法不正确的是
c点溶液中c(Na+)+c(H+)=(0.05+10-11.3)ml·L-1,e点溶液体积增大1倍,此时溶液中c(Na+)+c(H+)=(0.025+10-4.3)ml·L-1,因此x>y,故D正确。
6.常温下,在20 mL 0.1 ml·L-1 Na2CO3溶液中逐滴加入40 mL 0.1 ml·L-1稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
7.常温下,向20.00 mL 0.1 ml·L-1 HA溶液中滴入0.1 ml·L-1 NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是A.常温下,Ka(HA)约为10-5B.M、P两点溶液对应的pH=7C.b=20.00D.M点后溶液中均存在c(Na+)>c(A-)
N点水电离出的H+浓度最大,说明HA与NaOH恰好完全反应生成NaA,则P点溶质为NaOH和NaA,溶液显碱性,即P点溶液pH不等于7,且b=20.00,B项错误、C项正确;
M点溶液的pH=7,根据溶液呈电中性可知,c(Na+)=c(A-),则M点后,溶液呈碱性,c(Na+)>c(A-),D项正确。
8.25 ℃时,用0.10 ml·L-1的氨水滴定10.00 mL 0.05 ml·L-1 H2A溶液,加入氨水的体积(V)与溶液中 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是A.A点溶液的pH等于1B.由图中数据可知,H2A为强酸C.B点水电离出的H+浓度为1.0×10-6 ml·L-1D.C点溶液中c(A2-)>c( )>c(OH-)>c(H+)
计算得c(H+)=10-6 ml·L-1,则水电离出的H+浓度为1.0×10-6 ml·L-1,故C正确;
9.(2023·河北衡水高三模拟)常温下,向10 mL 0.1 ml·L-1的草酸(H2C2O4)溶液中逐滴滴入等浓度的NaOH溶液至过量,用甲基橙(变色范围的pH为3.1~4.4)作指示剂,并用pH计测定滴定过程的溶液pH变化,其滴定曲线如图所示,则下列分析正确的是A.滴入10 mL标准NaOH溶液时,溶液颜色由红色 变为橙色B.图中①点所示溶液中:c(H2C2O4)+c(H+)= c(OH-)+c( )
甲基橙变色范围的pH为3.1~4.4,滴入10 mL标准NaOH溶液时,溶液pH为4.7,颜色由红色变为黄色,A错误;图中①点为第一滴定终点,得到的溶质为NaHC2O4,由质子守恒可知,所示溶液中:c(H2C2O4)+c(H+)=c(OH-)+c( ),B正确;
10.常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4。向10 mL c ml·L-1二甲胺溶液中滴加0.1 ml·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的是A.二甲胺溶液的浓度为0.2 ml·L-1B.在Y和Z点之间某点溶液pH=7C.Y点存在:D.常温下,(CH3)2NH2Cl水解常数Kh=6.25×10-11
二甲胺与盐酸恰好完全中和时放出热量最多,溶液温度最高,即Y点表示酸碱恰好完全反应。根据(CH3)2NH·H2O+HCl===(CH3)2NH2Cl+H2O,可得10×10-3 L×c ml·L-1=20×10-3 L×0.1 ml·L-1,c=0.2,A项正确;
二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,根据Kb推知,(CH3)2NH·H2O的电离大于(CH3)2NH2Cl的水解,其混合溶液呈碱性,故中性点应在X点与Y点之间,B项错误;
12.(2023·湖南,12)常温下,用浓度为0.020 0 ml·L-1的NaOH标准溶液滴定浓度均为0.020 0 ml·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η= ]的变化曲线如图所示。下列说法错误的是A.Ka(CH3COOH)约为10-4.76B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)C.点b:c(CH3COOH)
点b溶液中含有NaCl及等浓度的CH3COOH和CH3COONa,由于pH<7,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH)
13.298 K时,向20.0 mL 0.10 ml·L-1 H2A溶液中滴加0.10 ml·L-1 NaOH溶液,滴定曲线如图所示。下列说法正确的是A.该滴定过程应该选择石蕊溶液作指示剂B.W点到X点发生的主要反应的离子方程式为H2A+ 2OH-===A2-+2H2OC.Y点对应的溶液中c(Na+)+c(H+)=c(OH-)+2c(A2-)D.反应H2A+A2- 2HA-的平衡常数K=1.0×107.4
石蕊不能用作酸碱中和滴定的指示剂,根据图示滴定终点的pH,可知第二反应终点应用酚酞作指示剂,A项错误;X点对应的溶液中溶质主要是NaHA,W点到X点发生的主要反应的离子方程式为H2A+OH-===HA-+H2O,B项错误;
根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),因为Y点对应的溶液中c(HA-)=c(A2-),所以c(Na+)+c(H+)=c(OH-)+3c(A2-),C项错误;
14.(2020·江苏,16)吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为_________________________________________________________________________;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是________(填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是________(填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为_______________________________________________________________________。
ZnSO3+SO2+H2O===
通入SO2,在开始阶段溶液pH没有大的变化,说明SO2被吸收生成了微溶于水的盐,根据题给信息知,应该是生成了ZnSO3。溶液pH迅速降低,说明生成了酸性物质,应该是易溶的酸式盐Zn(HSO3)2。
2025年高考化学一轮复习课件(新高考版)大单元4 第11章 第50讲 化学反应速率与化学平衡图像分类突破: 这是一份2025年高考化学一轮复习课件(新高考版)大单元4 第11章 第50讲 化学反应速率与化学平衡图像分类突破,共60页。PPT课件主要包含了ACDF,及时移去产物,改进催化剂,提高反应物压强,恒温恒压线,在反应过程中断裂,和形成的化学键相同,Kp1·Kp2,课时精练,+118等内容,欢迎下载使用。
新高考化学一轮复习课件第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析(含解析): 这是一份新高考化学一轮复习课件第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析(含解析),共60页。PPT课件主要包含了滴定过程pH变化曲线,必备知识,关键能力,分布系数曲线,真题演练明确考向,课时精练等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第12章第56讲 溶液中的粒子平衡曲线分类突破(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第12章第56讲 溶液中的粒子平衡曲线分类突破(含解析),共60页。PPT课件主要包含了CH3COOH,CH3COONa,cNa+,NaOH,类型二分布系数曲线,读图解题要领,课时精练,NH3+H2O,ZnSO3等内容,欢迎下载使用。












