

安徽省县中联盟2024-2025学年高二上学期10月月考化学试题(无答案)
展开
这是一份安徽省县中联盟2024-2025学年高二上学期10月月考化学试题(无答案),共8页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量等内容,欢迎下载使用。
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版必修第二册、选择性必修1第一章~第二章第二节。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Cu 64
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.我国历史悠久,文物储量丰富,彰显大国文化。下列文物属于硅酸盐材料的是
2.科技发展推动了社会的前进和人类进步。下列说法错误的是
A.在催化剂作用下将汽车尾气中的转化为属于氮的固定
B.新一代电极材料石墨烯可提高电池的充放电速率
C.月壤中富集的与地球上的互为同位素
D.挂在墙上的油田——光伏太阳能电池成功将太阳能转变为电能
3.某温度下,在体积为2L容器中充入a、2a以及催化剂进行重整反应。10min时测得生成的是0.5a(反应未达到平衡)。下列说法错误的是
A.0~10min,的平均反应速率为
B.10min时,的转化率为25%
C.若起始时向容器中充入,则10min时生成的
D.一定温度范围内,温度升高,反应速率下降,原因可能是催化剂活性下降
4.《黄帝内经》中记载:“五谷为养,五果为助,五畜为益……”。下列说法正确的是
A.五谷中含有的淀粉和纤维素均属于多糖,二者互为同分异构体
B.瓜果和肉类的主要成分存在较大区别,故饮食上要均衡营养
C.古代用大米酿酒,利用了物质的溶解性差异,只发生物理变化
D.肉类中富含蛋白质、油脂等天然高分子,可维持人体生命活动
5.血红蛋白分子()在人体中存在如下过程:① ;② 。下列说法正确的是
A.高原地区气压低,该地区人体内的数量也较低
B.人体吸入易造成缺氧中毒,说明
C.中毒时,应立即切断源,使减小
D.中毒时,可将病人移至通风处,必要时进行吸氧
6.任何化学反应总伴随着能量变化,研究化学反应中的能量变化对于人类的生产、生活有着重要的意义。下列说法正确的是
图甲 图乙
A.图甲可表示铝热反应、石灰石分解等B.的燃烧热为
C.24g石墨完全燃烧放出的能量为787D.若用金刚石代替石墨,图乙中数值均不变
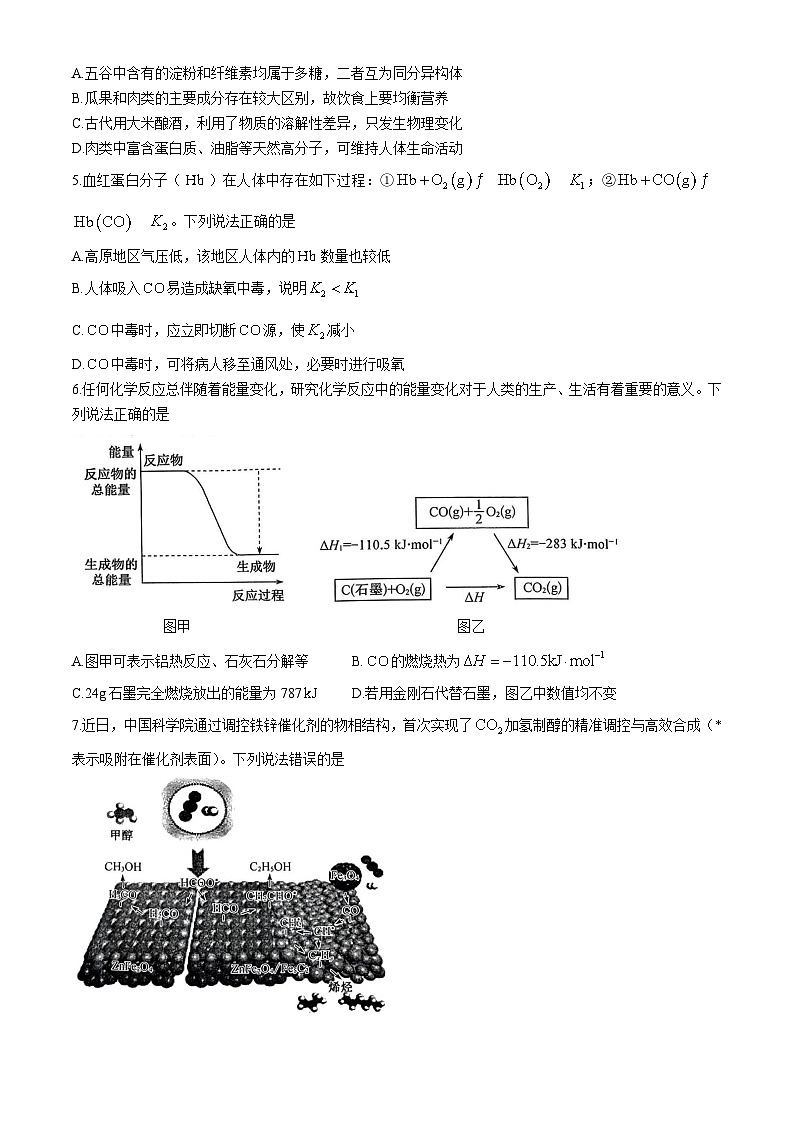
7.近日,中国科学院通过调控铁锌催化剂的物相结构,首次实现了加氢制醇的精准调控与高效合成(*表示吸附在催化剂表面)。下列说法错误的是
A.催化剂可以降低反应活化能,提高活化分子百分数
B.催化剂的催化具有选择性
C.催化剂能够提高反应物的平衡转化率
D.制乙醇的总反应可表示为
8.下列实验装置正确且能够达到实验目的的是
9.乙基芳樟醇可用作各种花香型日化香精,其结构简式如图所示。下列有关乙基芳樟醇说法错误的是
A.分子式为B.含有碳碳双键和羟基两种官能团
C.能发生取代、加聚和氧化反应D.与加成最多可得到2种产物
10.工业上制备水煤气的反应为 ,830℃时,。向2L恒容密闭容器中充入0.2和1.0,在830℃发生上述反应。下列说法错误的是
A.达平衡时放热
B.反应达到平衡时
C.若起始时四种气体各充入1,则
D.若起始时充入1.0、0.2,则两种情况下相等
11.某化学学习小组在学习硝酸的工业制法后,设计实验探究氨气的催化氧化,实验装置如图。
实验现象:一段时间后移开③处酒精灯,催化剂持续红热;④中观察到红棕色气体,一段时间后形成白烟。下列说法错误的是
A.①中固体药品可用高锰酸钾代替,试剂X可用碱石灰
B.④中冒白烟说明氨气和氧气的反应属于可逆反应
C.③中移开酒精灯,催化剂仍保持红热,说明是放热反应
D.④中同时伴随氧化还原反应和化合反应
12.对于反应,用平衡时各组分压强关系表示的平衡常数为。在一定条件下与的消耗速率与自身压强间存在关系:,。其中、是与反应温度有关的常数。相应的消耗速率跟压强的关系如图所示,下列说法错误的是
A.一定温度下反应达到平衡时,
B.图中B、D点能表示反应达到平衡状态
C.平衡后压缩体积加压,混合气体颜色加深
D.温度升高,减小,增大
13.已知:由最稳定的单质合成1某物质的反应焓变叫作该物质的摩尔生成焓(最稳定的单质的摩尔生成焓为0)。一些物质的摩尔生成焓()如下表所示。下列叙述正确的是
A.液态水的摩尔生成焓
B.
C.利用上表已知数据,可求得及液肼的燃烧热
D.升高温度,反应正向移动
14.能源研究院科学家研究采用高选择性催化剂将二氧化碳加氢制备甲醇。主反应:;副反应:。将1和3充入固定体积的密闭容器中在催化剂表面发生上述反应,测得平衡转化率以及的平衡产率[产率]随温度变化如图所示(时,对应纵坐标分别为0.3和0.25)。下列说法正确的是
A. a曲线表示甲醇的产率B.主反应为吸热反应
C.时副反应的平衡常数为D.加压、升温、及时移出甲醇均有利于甲醇生成
二、非选择题(本题共4小题,共58分)
15.(15分)化学反应的过程,既是物质的转化过程,也是化学能与热能等形式能量的转化过程。回答下列问题:
(1)工业上用氮气合成氨,能量变化如图。则断裂0.5和1.5中的化学键所吸收的能量与形成1中的化学键所释放的能量差值为_________,该反应的热化学方程式可表示为_________。
(2)下列反应中,反应热变化和合成氨相同的是_________(填序号)。
①碳的燃烧 ②铝热反应 ③盐酸和氢氧化钠溶液反应 ④与反应 ⑤二氧化碳和炙热的碳反应
(3)长征系列火箭以偏二甲肼作燃料,作氧化剂,若30g偏二甲肼(液态)与(液态)完全反应生成、和,放热1275,写出反应的热化学方程式:_________。该物质可作为火箭推进剂的可能原因是:①反应产生大量气体;②_________________。
(4)某兴趣小组同学设计利用如图所示装置测定500.50稀盐酸与500.55氨水反应的中和热。该装置缺少的仪器名称是_________,各步操作均正确,但是该同学测得的中和热数值始终小于57.3,原因是_________________。
(5)空气中的主要来源是汽车尾气,科学家提出安装催化转化器实现下列转化: 。若 ,的燃烧热为。则反应 _________(用、、表示)。
16.(14分)常温下,某实验小组进行如图所示实验(已知:为二元弱酸)探究影响化学反应速率的因素(溶液混合后的体积等于两者体积之和),测得试管a、b、c中溶液褪色分别耗时690s、677s、600s。回答下列问题:
(1)可以将氧化为,本身被还原成,写出试管a中反应的离子方程式:___________________________。试管a、b、c中产生气体的量__________(填“相同”或“不同”)。
(2)由试管a、b中溶液褪色时间可以得出结论:___________________________。
(3)实验过程中观察到试管c刚开始时反应缓慢,一段时间后突然加快,产生该现象的原因可能是___________________________。(反应过程中无明显热量变化)。试管c中反应的平均速率__________。
(4)有同学提出通过试管c、d褪色时间可以验证H对于反应速率的影响,你认为该同学的看法_________(填“合理”或“不合理”),理由是___________________________。(
(5)实验中高锰酸钾溶液褪色较慢,可以加热至60~70℃以加快反应速率,较适宜的加热方式是_________。
17.(14分)“价-类二维图”是研究元素化合物的一种很好的方法,碳、硫及其部分化合物的“价-类二维图”如图所示。回答下列问题:
(1)由6个原子构成的有机物b的分子式为__________,有机物a的化学名称是__________。
(2)下列可实现一步转化的关系有__________(填字母)。
A. c→fB. e→gC. a→dD. d→h
(3)工业上可选用铁制容器储运g的浓溶液,原因是______________________________;;写出c与g反应的化学方程式:______________________________。
(4)若将铜丝插入热的g浓溶液中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验。
①a点现象为______________________________。
②b点、c点溶液褪色,依次说明SO具有__________、__________。
③写出d点反应的离子方程式:______________________________。
18.(15分)工业上利用水煤气合成甲醇,反应原理为。
回答下列问题:
(1)一定温度下,在固定体积的密闭容器中发生上述反应,能说明反应达到平衡状态的是__________(填字母)。
A.的含量保持不变B.混合气体的密度不变
C.混合气体的平均相对分子质量不变D.
(2)一定温度下,反应 、 。可知该温度下,反应的________(用、表示)。
(3)在一个容积可变的密闭容器中充有1和2,在催化剂作用下发生反应:。测得的平衡转化率()与温度(℃)、压强()的关系如图所示。
①图中横坐标表示的物理量为__________,m、n、p、q四点表示的化学平衡常数由大到小的顺序为__________。
②按照图中条件,到达m点(该点容器容积为2L)需要的时间为5min,则0~5min内,用氢气表示的正反应速率__________。
③欲提高甲醇的平衡产率,可采取的措施有______________________________(任写两种)。
④测得q点容器内压强为p,则用分压(分压等于总压与该气体体积分数的乘积)表示该反应在q点对应条件下的平衡常数__________(用含p的代数式表示)。保持恒温恒压,若起始时向容器中充入1ml甲醇蒸汽,达到平衡时氢气的体积分数(与原平衡相比)将__________(填“增大”“减小”或“不变”)。
A.汉代铜牛形缸灯
B.商代陶罐
C.西汉将军金印
D.战国水晶杯
选项
A
B
C
D
实验装置
实验目的
测量浓硫酸的
测定化学反应速率
探究锌和铁的金属性
实验室制取、收集氨气
物质
摩尔生成焓
+10.8
+165.8
-242.0
-393.5
-110.5
91.3
相关试卷
这是一份山西省卓越联盟2024-2025学年高二上学期10月月考化学试题(无答案),共9页。试卷主要包含了本试卷分选择题和非选择题两部分,本卷命题范围,可能用到的相对原子质量,如图是教材插图,水煤气变换反应为等内容,欢迎下载使用。
这是一份安徽省县中联盟2024-2025学年高三上学期9月联考化学试题 PDF版含解析,文件包含2025届安徽省县中联盟高三9月联考化学试题pdf、参考答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份安徽省县中联盟2024-2025学年高三上学期9月开学联考化学试题(无答案),共8页。试卷主要包含了满分100分,考试时间75分钟,本卷命题范围,下列说法正确的是,下列化学反应表示错误的是,设为阿伏加德罗常数的值,实验室用如图所示装置制备硝酸等内容,欢迎下载使用。










