

所属成套资源:2025年高考化学一轮复习讲练测(新教材新高考)
第03讲 镁、铝及其重要化合物(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考)
展开
这是一份第03讲 镁、铝及其重要化合物(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考),文件包含第03讲镁铝及其重要化合物讲义教师版2025年高考化学一轮复习讲练测新教材新高考docx、第03讲镁铝及其重要化合物讲义学生版2025年高考化学一轮复习讲练测新教材新高考docx等2份试卷配套教学资源,其中试卷共47页, 欢迎下载使用。
\l "_Tc25396" 02 知识导图·思维引航 PAGEREF _Tc25396 \h 3
\l "_Tc16995" 03 考点突破·考法探究 PAGEREF _Tc16995 \h 4
\l "_Tc25028" 考点一 镁及其化合物 PAGEREF _Tc25028 \h 4
\l "_Tc32650" 知识点1 镁的性质 PAGEREF _Tc32650 \h 4
\l "_Tc23148" 知识点2 镁的氧化物MgO PAGEREF _Tc23148 \h 5
\l "_Tc30040" 知识点3 镁的氢氧化物Mg(OH)2 PAGEREF _Tc30040 \h 6
\l "_Tc2378" 知识点4 镁的其他化合物 PAGEREF _Tc2378 \h 6
\l "_Tc10498" 考向1 考查镁及其化合物的结构、性质及应用 PAGEREF _Tc10498 \h 6
\l "_Tc23076" 考向2 考查镁及其化合物制备的工艺流程 PAGEREF _Tc23076 \h 7
\l "_Tc27914" 考点二 铝及其化合物 PAGEREF _Tc27914 \h 8
\l "_Tc31717" 知识点1 铝的性质 PAGEREF _Tc31717 \h 8
\l "_Tc2398" 知识点2 氧化铝 PAGEREF _Tc2398 \h 10
\l "_Tc16579" 知识点3 氢氧化铝 PAGEREF _Tc16579 \h 11
\l "_Tc4439" 知识点4 常见的铝盐 PAGEREF _Tc4439 \h 11
\l "_Tc14536" 知识点5 数形结合与“铝三角” PAGEREF _Tc14536 \h 12
\l "_Tc16025" 考向1 考查铝及其化合物的结构、性质及其应用 PAGEREF _Tc16025 \h 15
\l "_Tc8613" 考向2 考查铝热反应及其应用 PAGEREF _Tc8613 \h 16
\l "_Tc8242" 考向3 考查铝及其化合物制备的工艺流程 PAGEREF _Tc8242 \h 16
\l "_Tc24040" 考向4 考查铝及其化合物与强酸、强碱反应有关计算 PAGEREF _Tc24040 \h 17
\l "_Tc10084" 04 \l "_Tc7416" 真题练习·命题洞见 PAGEREF _Tc10084 \h 19
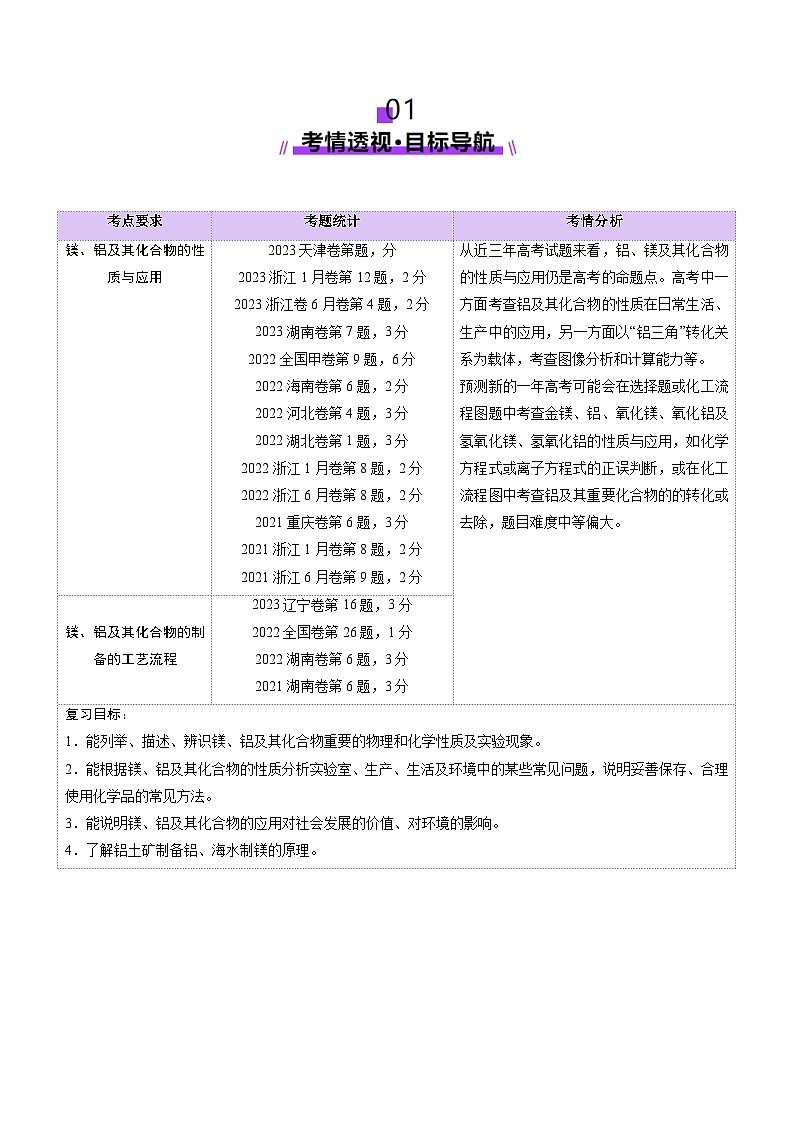
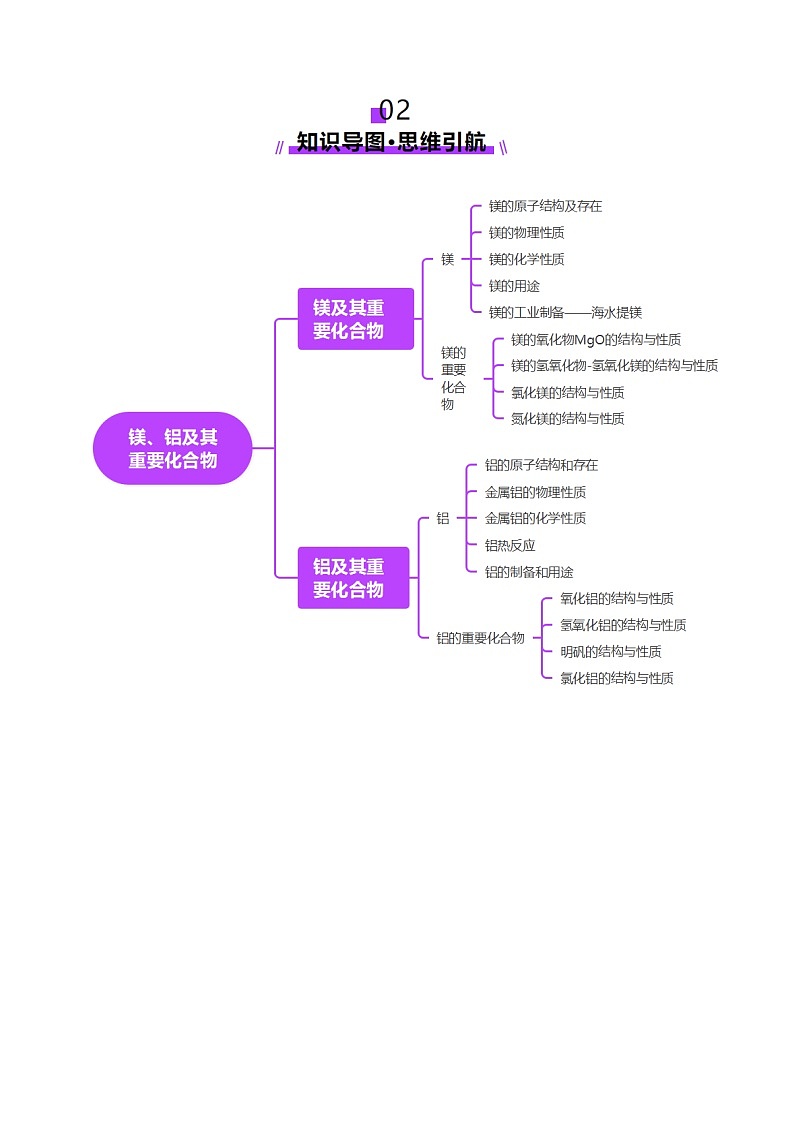
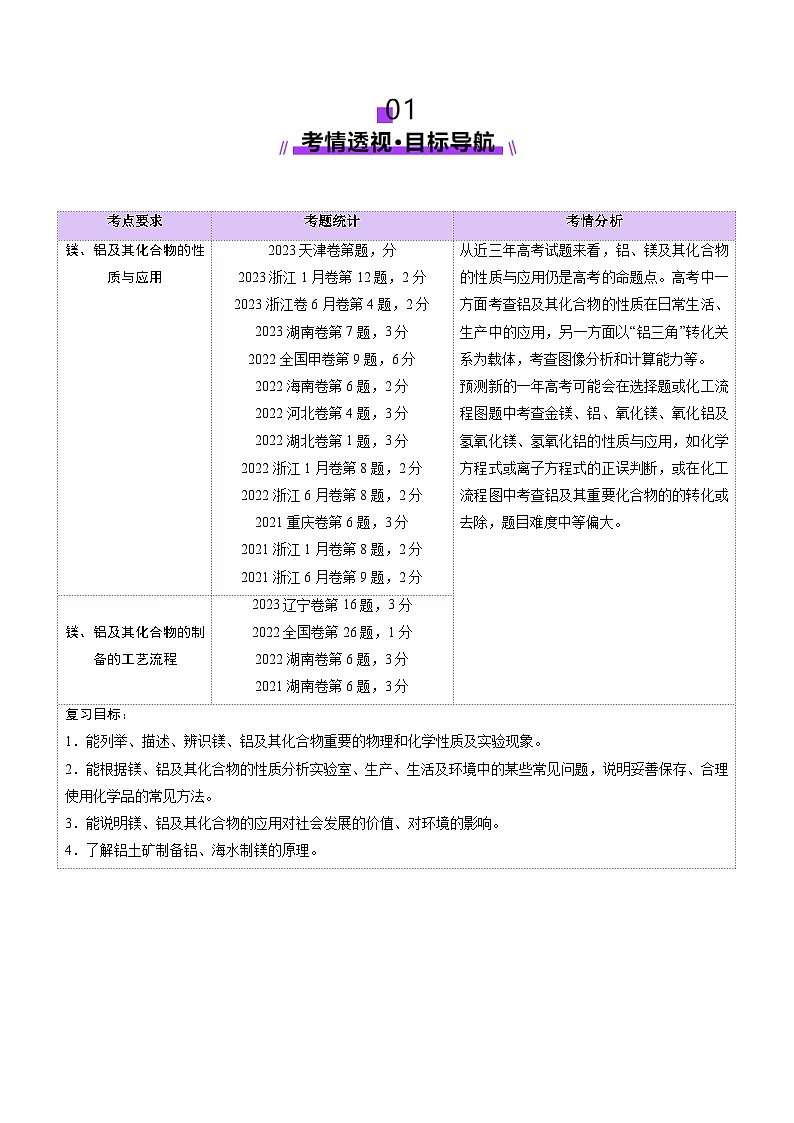
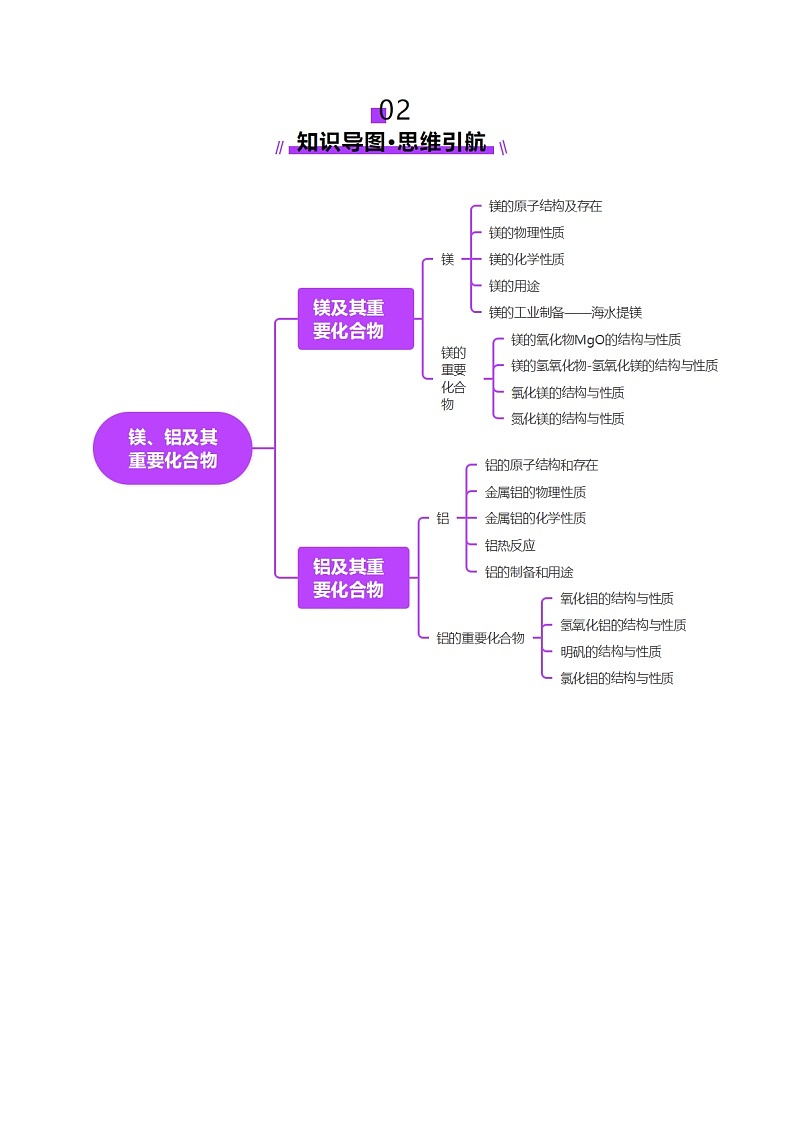
考点一 镁及其化合物
知识点1 镁的性质
1.镁的原子结构及存在
(1)镁的原子结构:镁元素在元素周期表中位于第______周期第______族,原子结构示意图为__________。镁是较活泼的金属,在金属活动性顺序中位于铝、锌、铁的前面。镁在化学反应中,能表现出较强的______性,即______电子的能力强,是常用的______剂。
(2)镁的存在:镁蕴藏量丰富,在宇宙中含量第______,在地壳中含量丰度2%。含镁矿物主要来自白云岩[CaMg(CO3)2]、菱镁矿(MgCO3)、水镁矿[Mg(OH)2]、光卤石(KCl·MgCl2·6H2O)和橄榄石[(Mg,Fe)2SiO4]等。海水、天然盐湖水也是含镁丰富的资源。
2.镁的物理性质
具有______色金属光泽的固体,密度、硬度均较______,熔点较______,有良好的导______、传______和______性。
3.镁的化学性质
①与非金属反应
A.镁条在O2中燃烧,发出耀眼的______,生成白色固体物质,反应的化学方程式为__________________;
B.镁条能与N2反应,化学方程式为3Mg+N2Mg3N2(镁在空气中燃烧得到______、______和______的混合物)。
【易错提醒】Mg3N2能与水剧烈反应生成Mg(OH)2沉淀,放出氨气,所以只能在干态下制取。
C.镁条能与Cl2反应,化学方程式为________________________
②与CO2反应:______________________________(镁着火不能用______灭火)
③与H2O反应:______________________________(镁与冷水反应很______,镁在沸水中反应较______。)
④与H+反应:______________________________
4.镁的用途
①______用于制造信号弹和焰火;
②______用于制造火箭、导弹和飞机的部件;
③______用于制耐高温材料;氢氧化镁用做阻燃剂;
④冶金工业上______用作还原剂和脱氧剂。
5.镁的工业制备——海水提镁
【易错提醒】①由MgCl2·6H2O到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
②因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
知识点2 镁的氧化物MgO
知识点3 镁的氢氧化物Mg(OH)2
【易错提醒】碳酸镁水解生成氢氧化镁,反应的化学方程式:______________________________,镁元素在水垢中的存在形式是______。
知识点4 镁的其他化合物
1.氯化镁:MgCl2可发生水解,由MgCl2·6H2O制备MgCl2时,要在____________中脱水,MgCl2·6H2OMgCl2+6H2O,无水MgCl2用于电解制备金属______。
2.氮化镁:在水中剧烈水解,其反应的化学方程式为________________________,与酸反应生成两种盐:________________________。
考向1 考查镁及其化合物的结构、性质及应用
例1(2024·湖北·模拟预测)是一种新型储氢合金,该合金在一定条件下完全吸氢的化学方程式为,得到的混合物在4.0ml⋅L-1HCl溶液中能完全释放出氢气。下列说法正确的是
A.该合金的熔点介于金属镁和金属铝的熔点之间
B.中,两种元素的化合价均为零价
C.在氮气保护下,将一定比例的Mg、Al单质熔炼可获得该合金
D.一定条件下,17ml和12mlAl与盐酸完全反应,释放氢气的总量为52ml
【易错提醒】Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。同时镁与氮气反应生成Mg3N2。
【变式训练1】(2024·上海松江·二模)科学家们创造出了最轻的镁同位素18Mg,18Mg与24Mg具有
A.不同电子数
B.不同物理性质
C.不同核电荷数
D.不同化学性质
【变式训练2】(2024·浙江舟山·三模)关于镁的性质,下列说法错误的是
A.金属镁着火,可以用CO2灭火
B.镁是一种具有银白色光泽的金属
C.镁可以与热水反应生成氢气
D.镁可以与盐酸剧烈反应生成氢气
考向2 考查镁及其化合物制备的工艺流程
例2(2024·山东潍坊·二模)以水泥厂的废料(主要成分为,含少量等杂质)为原料制备的工艺流程如下:
已知:下列说法正确的是
A.为提高酸浸速率,可使用浓硫酸
B.试剂X可以是
C.滤渣为
D.操作a所得滤液经处理后可循环利用
【变式训练1】(23-24高三上·北京·阶段考试)为模拟海水制备MgO的工业过程,用氯化钠、氯化镁、氯化钙、碳酸氢钠等试剂配成模拟海水,制得了MgO,实验过程如下:
已知:ⅰ.模拟海水中主要离子的浓度
ⅱ.溶液中某种离子的浓度小于,可认为该离子已完全沉淀;ⅲ.实验过程中,忽略溶液体积的变化;ⅳ.;;;。
下列说法正确的是
A.沉淀物X为
B.滤液M中已完全沉淀
C.滤液N中、均已完全沉淀
D.②中若改为加入4.2gNaOH固体,沉淀物Y为和的混合物
【变式训练2】(23-24高三上·浙江·期末)某兴趣小组在定量分析了镁渣[含有、、、、和]中Mg含量的基础上,按如流程制备六水合氯化镁()。
相关信息如下:
①700℃只发生和的分解反应。
②溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
下列说法错误的是
A.步骤Ⅱ,反应的方程式是:
B.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
C.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
D.溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性,可能是结晶时过度蒸发导致氯化镁水解,部分生成碱式氯化镁
考点二 铝及其化合物
知识点1 铝的性质
1.铝的原子结构和存在
(1)铝的原子结构:铝位于元素周期表第______周期______族,原子结构示意图为____________。
(2)铝的存在:自然界中的铝______以化合态的形式存在,地壳中铝含量位列金属第______位,以铝土矿的形式存在,主要成分是______,含少量Fe2O3和SiO2。
2.金属铝的物理性质
______色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较______,质地______。
3.金属铝的化学性质
①常温下,铝与氧气形成致密氧化膜,加热发生:________________________,铝片在空气中加热,铝片卷曲而不滴落,是因为氧化铝的熔点______铝。
②______________________________
③______下铝遇氧化性酸——浓硫酸、浓硝酸______,
与非氧化酸发生反应生成______:____________________________________
④______________________________或______________________________
⑤______________________________
4.铝热反应
5.铝的制备和用途
(1)制备原理:铝土矿eq \(――→,\s\up7(提纯))______eq \(――→,\s\up7(电解))Al,电解____________:________________________。
【特别提醒】工业上冶炼Al用电解熔融Al2O3而不用AlCl3的原因:AlCl3是共价化合物,熔融态不导电。
(2)铝的用途:______用作导线,______用于制造汽车、飞机、生活用品等,______还用作还原剂。
6.铝与酸或碱反应生成H2的量的关系
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应:
①产生H2的物质的量______。
②消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=______。
(2)足量的铝分别与等物质的量的HCl和NaOH反应:
①消耗Al的物质的量之比为______。
②生成H2的物质的量之比为______。
(3)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应:
若产生氢气的体积比为eq \f(1,3)<eq \f(VHClH2,VNaOHH2)<1,则必定
①铝与盐酸反应时,铝过量而______不足。
②铝与氢氧化钠溶液反应时,铝不足而______过量。
【易错警示】(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝与稀硝酸反应时生成的气体是NO而不是H2。
(3)铝不但能与酸(H+)反应,还能够与碱溶液反应,表现为特殊性。2Al+2OH-+2H2O===2AlOeq \\al(-,2)+3H2↑。其反应机理应为:铝先与强碱溶液中的水反应生成H2和Al(OH)3,然后Al(OH)3再与NaOH反应生成H2O和NaAlO2,反应中铝作还原剂,水作氧化剂,NaOH无电子得失。
(4)铝热反应是在高温状态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。铝不能与MgO反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(5)Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。同时镁与氮气反应生成Mg3N2。
知识点2 氧化铝
1.物理性质:白色固体,难溶于水,熔点很高。
2.化学性质——______氧化物
①与酸反应:Al2O3+6H+===2Al3++3H2O
②与碱反应:Al2O3+2OH-===2AlOeq \\al(-,2)+H2O
【易错警示】这里的酸碱是指______酸、______碱。
3.用途:①作______材料②冶炼______的原料
4.制备:Al(OH)3加热分解:______________________________
知识点3 氢氧化铝
1.物理性质:______色胶状______溶于水的固体,有较强的______性。
2.化学性质——______氢氧化物
Al(OH)3的电离方程式为
(______式电离)________________________Al(OH)3_____________________(______式电离)
①与酸反应:____________________________________
②与碱反应:____________________________________
③受热分解:____________________________________
【总结归纳】既能与酸反应又能与碱反应的物质:①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;②弱酸的酸式盐,如:NaHCO3、KHS、NaHSO3等;③氨基酸;④铝及铝的氧化物、氢氧化物。
3.用途①制______ ②______作用
4.制备Al(OH)3的三种方法
①向铝盐中加入氨水,离子方程式为______________________________。
②NaAlO2溶液中通入足量CO2,离子方程式为______________________________。
③可溶性铝盐和偏铝酸盐水溶液中混合:______________________________。
知识点4 常见的铝盐
1.明矾
1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的______盐。
2)明矾的化学式为KAl(SO4)2·12H2O,它是______色晶体,______溶于水,水溶液pH______7。
3)明矾净水的原理:明矾可以净水,其净水的原理是______________________________,Al(OH)3胶体吸附水中的杂质形成沉淀而净水,使水澄清。
【易错警示】(1)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(2)Al(OH)3具有两性,能溶于强酸(如盐酸)、强碱(如NaOH溶液),但不溶于弱酸(如H2CO3)、弱碱溶液(如氨水)。
(3)由Al(OH)3的两式电离以及与酸和碱反应的离子方程式可知:与酸反应时相当于三元碱,与碱反应时相当于一元酸。
(4)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
2.AlCl3的结构与性质
1)AlCl3熔点、沸点都很______,且会______,______溶于乙醚等有机溶剂,因为它是一种______型化合物。熔化的AlCl3不易导电,AlCl3晶体属于______晶体,故制备铝时______用AlCl3电解。
2) AlCl3的蒸汽或处于熔融状态时,都以AlCl3______分子形式存在。AlCl3二聚分子的形成原因是铝原子的缺电子结构。AlCl3二聚分子结构示意图如图,其中每个铝原子均为______杂化,各有1条空的轨道,氯原子处于以铝原子为中心的四面体的4个顶点位置。分子中有桥式氯原子存在,桥式氯原子在与其中一个铝原子成σ键的同时,与另一个铝原子的空轨道发生配位,形成σ配位键。
3)AlCl3能与Cl-生成AlCl4-:AlCl3(aq)+ Cl-(aq)=AlCl4-(aq)
4)与Al2Cl6类似,AlCl4-、Na3AlF6、Al(OH)4-中均存在配位键。
知识点5 数形结合与“铝三角”
1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系
(1)①Al3++3NH3·H2O===Al(OH)3↓+3NHeq \\al(+,4)②Al3++3[Al(OH)4]-===4Al(OH)3↓③Al3++3OH-===Al(OH)3↓
(2)Al(OH)3+3H+===Al3++3H2O
(3)Al3++4OH-===[Al(OH)4]-
(4)[Al(OH)4]-+4H+===Al3++4H2O
(5)①[Al(OH)4]-+CO2===Al(OH)3↓+HCOeq \\al(-,3)
②[Al(OH)4]-+H+===Al(OH)3↓+H2O
(6)Al(OH)3+OH-===[Al(OH)4]-
2.与Al(OH)3沉淀生成有关的图像分析
(1)可溶性铝盐溶液与NaOH溶液反应的图像(从上述转化关系中选择符合图像变化的离子方程式,下同)
(2)偏铝酸盐溶液与盐酸反应的图像
(3)突破Al(OH)3沉淀图像三个秘诀
①明晰横、纵坐标含义,然后通过曲线变化特点分析反应原理。
②掌握Al3+、Al(OH)3、AlOeq \\al(-,2)三者之间的转化比例:
③明晰Al3+溶液中加碱(OH-)的几种常见变形图像,如:
图A中,n(H+)∶n(Al3+)=。
图B中,若已知原溶液中含有Mg2+。则可推出:
n(Mg2+)∶n(Al3+)=。
图C中,若已知原溶液中含有H+和Mg2+,则可推导出:n(H+)∶n(Al3+)∶n(Mg2+)=。
3.铝三角的应用
(1)选择制备Al(OH)3的最佳途径
①由Al3+制备Al(OH)3,宜用Al3+与氨水反应:
Al3++3NH3·H2O===Al(OH)3↓+3NHeq \\al(+,4)
②由NaAlO2制备Al(OH)3宜用CO2与AlOeq \\al(-,2)反应:
2H2O+AlOeq \\al(-,2)+CO2===Al(OH)3↓+HCOeq \\al(-,3)
③从节约原料角度,由Al制备Al(OH)3,宜用eq \f(1,4)Al制备Al3+,eq \f(3,4)Al制备AlOeq \\al(-,2),然后将二者混合:
Al3++3AlOeq \\al(-,2)+6H2O===4Al(OH)3↓
(2)有关离子共存问题
①与Al3+不能大量共存的(阴)离子有:OH-、AlOeq \\al(-,2)、HS-、SiOeq \\al(2-,3)、COeq \\al(2-,3)、HCOeq \\al(-,3)、SOeq \\al(2-,3)等。
②与AlOeq \\al(-,2)不能大量共存的(阳)离子有:H+、Al3+、NHeq \\al(+,4)、Fe2+、Fe3+等。
③AlOeq \\al(-,2)与HCOeq \\al(-,3)因发生(相对)强酸制弱酸的反应而不能共存。
(3)分析离子反应顺序
①向含有Al3+、NHeq \\al(+,4)、H+的混合溶液中逐滴加入NaOH溶液,反应顺序是:
Ⅰ.________________________;Ⅱ.________________________(若先与NHeq \\al(+,4)反应,则生成的NH3·H2O又使Al3+沉淀且生成NHeq \\al(+,4));Ⅲ.________________________[若先溶解Al(OH)3,则产生的AlOeq \\al(-,2)又与NHeq \\al(+,4)反应生成沉淀];
Ⅳ.______________________________。
②向含有AlOeq \\al(-,2)、COeq \\al(2-,3)、OH-的混合溶液中逐滴加入盐酸,反应顺序是:
Ⅰ.______________________________;
Ⅱ.______________________________(AlOeq \\al(-,2)比COeq \\al(2-,3)先反应);
Ⅲ.______________________________;
Ⅳ.______________________________[HCOeq \\al(-,3)比Al(OH)3先反应];
Ⅴ.______________________________。
(4)有关Al(OH)3的计算
1)求产物Al(OH)3的量
①当n(OH-)≤3n(Al3+)时,n[Al(OH)3]=______;
②当3n(Al3+)
相关试卷
这是一份第03讲 氮及其重要化合物(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考),文件包含第03讲氮及其重要化合物讲义教师版2025年高考化学一轮复习讲练测新教材新高考docx、第03讲氮及其重要化合物讲义学生版2025年高考化学一轮复习讲练测新教材新高考docx等2份试卷配套教学资源,其中试卷共43页, 欢迎下载使用。
这是一份新高考化学一轮复习讲练测第08讲 铝、镁及其重要化合物(精练)(解析版),文件包含新高考化学一轮复习讲练测第08讲铝镁及其重要化合物精练原卷版docx、新高考化学一轮复习讲练测第08讲铝镁及其重要化合物精练解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
这是一份最新高考化学一轮复习【讲通练透】 第09讲 镁、铝及其重要化合物(练透),文件包含第09讲镁铝及其重要化合物练透教师版docx、第09讲镁铝及其重要化合物练透学生版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。








