

浙江版高考化学复习专题一0三盐类水解和沉淀溶解平衡练习含答案
展开
这是一份浙江版高考化学复习专题一0三盐类水解和沉淀溶解平衡练习含答案,共30页。试卷主要包含了下列过程与水解反应无关的是,NaClO溶液具有漂白能力,01 ml·L-1,实验测得10 mL 0,下图为某实验测得0等内容,欢迎下载使用。
考点过关练
考点1 盐类水解
1.(2023北京,3,3分)下列过程与水解反应无关的是( )
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
答案 B
2.(2022北京,1,3分)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是 ( )
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的pH>7
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
答案 B
3.(2023重庆,11,3分)(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是( )
A.M点KW等于N点KW
B.M点pH大于N点pH
C.N点降温过程中有2个平衡发生移动
D.P点c(H+)+c(NH4+)+c(NH3·H2O)=c(OH-)+2c(SO42-)
答案 B
4.(2022海南,13,4分)(双选)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
ml·L-1溶液中,c(ClO-)c(ClO-)=c(Na+)
答案 AD
5.(2021浙江1月选考,23,2分)实验测得10 mL 0.50 ml·L-1 NH4Cl溶液、10 mL 0.50 ml·L-1 CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5。下列说法不正确的是( )
A.图中实线表示pH随加水量的变化,虚线表示pH随温度的变化
B.将NH4Cl溶液加水稀释至浓度为0.50x ml·L-1,溶液pH变化值小于lgx
C.随温度升高,KW增大,CH3COONa溶液中c(OH-)减小,c(H+)增大,pH减小
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+)-c(CH3COO-)=c(Cl-)-c(NH4+)
答案 C
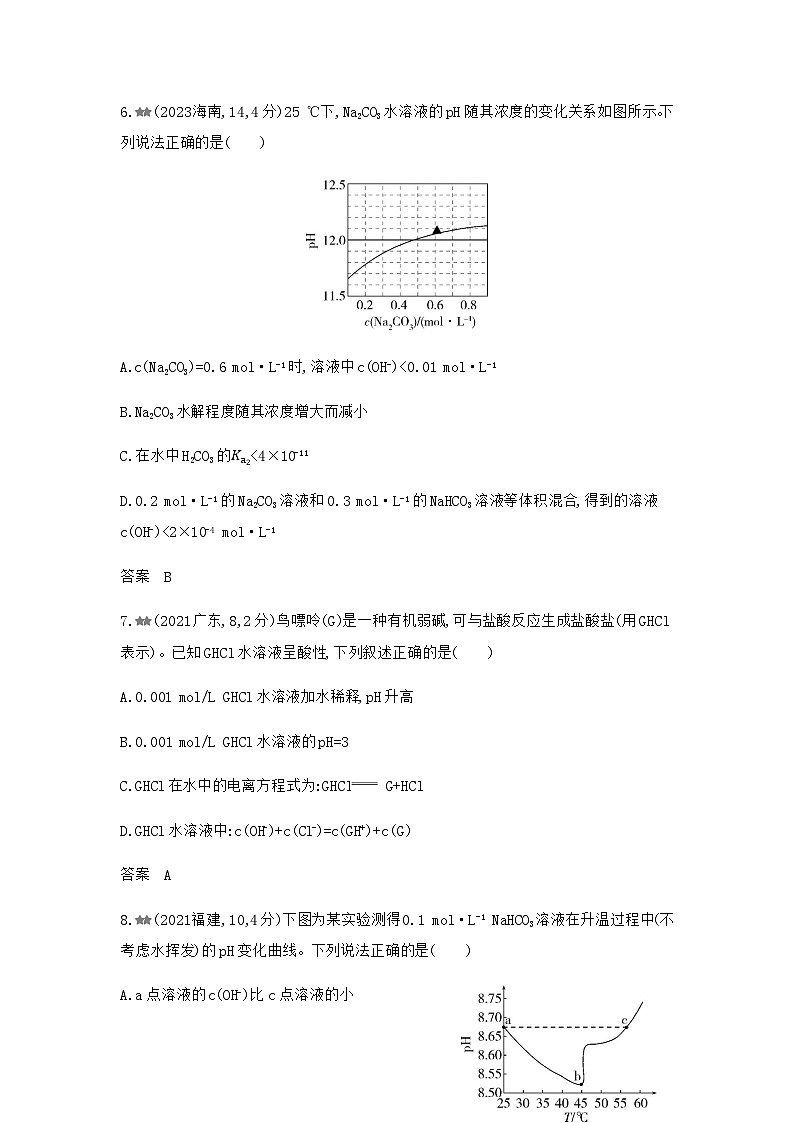
6.(2023海南,14,4分)25 ℃下,Na2CO3水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是( )
A.c(Na2CO3)=0.6 ml·L-1时,溶液中c(OH-)c(CO32-)
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
答案 C
2.(2022河北,9,3分)某水样中含一定浓度的CO32-、HCO3-和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 ml·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
A.该水样中c(CO32-)=0.01 ml·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c(HCO3-)基本保持不变
D.曲线上任意一点存在c(CO32-)+c(HCO3-)+c(H2CO3)=0.03 ml·L-1
答案 C
3.(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是( )
A.0.1 ml·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=Ksp(MgF2)c(F-)
C.0.1 ml·L-1 NaHCO3溶液中:c(CO32-)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
答案 C
4.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 ml·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(SO42-)
C.经过步骤②,溶液中c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
答案 D
5.(2021重庆,14,3分)下列叙述正确的是( )
A.向氨水中加入醋酸使溶液呈酸性,则c(NH4+)>c(CH3COO-)
B.向NH4Cl溶液中加入少量Al2(SO4)3固体,则水的电离程度减小
C.向Na2CO3溶液中滴加盐酸至c(Na+)=2c(Cl-),则c(HCO3-)>c(H2CO3)
D.向0.2 ml/L磷酸中加水至原体积的两倍,则c(H+)>0.1 ml/L
答案 C
6.(2022辽宁,15,3分)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。在25 ℃时,NH3+CH2COOH、NH3+CH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]与溶液pH关系如图。下列说法错误的是( )
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO-
C.NH3+CH2COO-+H2O NH3+CH2COOH+OH-的平衡常数K=10-11.65
D.c2(NH3+CH2COO-)③>②
B.向Na2CO3溶液中滴加少量氯水的离子方程式:CO32-+Cl2+H2OHCO3-+Cl-+HClO
C.AgCl在盐酸中的Ksp小于其在水中的Ksp
D.向浓度均为1×10-3 ml·L-1的KCl和K2CrO4的混合溶液中滴加1×10-3ml·L-1的AgNO3溶液,CrO42-先形成沉淀
答案 A
3.(2023北斗星盟联考,15)25 ℃时,Ksp(CaC2O4)=2.4×10-9,c(H2C2O4)、c(HC2O4-)、c(C2O42-)之和为0.1 ml/L的溶液中三种粒子所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列说法中不正确的是( )
A.H2C2O4的Ka1=10-1.3
B.常温下,向10 mL b点溶液中滴加半滴(0.02 mL)0.1 ml/L CaCl2溶液,会产生CaC2O4沉淀
C.20 mL 0.01 ml/L H2C2O4溶液与30 mL 0.01 ml/L NaOH溶液混合并充分搅拌后:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+)
D.常温下Ka(HA)=10-3.5,将足量H2C2O4加入少量NaA溶液中的离子方程式为H2C2O4+A-HA+HC2O4-
答案 C
4.(2023宁波二模,13)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5。下列说法不正确的是( )
A.浓度均为0.1 ml/L的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者>后者
B.用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-)
D.0.2 ml/L HCOONa溶液与0.1 ml/L NaOH溶液等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
答案 D
5.(2023金丽衢十二校一模,19)常温下,向某浓度H2A溶液中加入NaOH(s),保持溶液体积和温度不变,测得pH与-lgc(H2A)、-lgc(A2-)、-lgc(A2-)c(HA-)变化如图所示。下列说法不正确的是( )
A.曲线②代表-lgc(A2-)c(HA-)变化,曲线③代表-lgc(A2-)
B.由图中的数据计算得Ka1(H2A)=10-0.8
C.NaHA溶液中c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.b点时,满足c(Na+)>3c(A2-)
答案 D
考点2 沉淀溶解平衡
6.(2023十校联盟联考三,15)已知:室温下氢硫酸(H2S)的电离常数Ka1=1×10-7,Ka2=1.3×10-13,CuS和FeS的Ksp分别为6.3×10-36、6.5×10-18。下列说法不正确的是( )
A.反应FeS+H+ Fe2++HS-的平衡常数K的数值为5×10-5
B.可以用FeS除去污水中的Cu2+
C.从上述数据可得出CuS难溶于稀硫酸中
D. 0.1 ml·L-1的H2S溶液中加入等体积0.1 ml·L-1的NaOH溶液,则有c(Na+)>c(HS-)>c(H2S)>c(S2-)>c(OH-)>c(H+)
答案 D
7.(2024届金华一中10月月考,15)室温下,通过下列实验探究Na2CO3的性质。已知:25 ℃时,H2SO3的Ka1=1.4×10-2、Ka2=1.0×10-7,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。
实验1:配制50 mL 0.1 ml·L-1 Na2CO3溶液,测得溶液pH约为12;
实验2:取10 mL 0.1 ml·L-1 Na2CO3溶液,向其中加入少量CaSO4固体充分搅拌,一段时间后过滤。向滤渣中加入足量稀盐酸,固体完全溶解;
实验3:取10 mL 0.1 ml·L-1 Na2CO3溶液,向其中缓慢滴入等体积0.1 ml·L-1稀盐酸。
下列说法正确的是( )
A.实验1所得溶液中,c(Na+)Ksp(CaSO4)
C.实验3反应后溶液中存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.25 ℃时,反应CO32-+H2SO3 HCO3-+HSO3-的平衡常数K=2.5×108
答案 D
8.(2023 Z20名校联盟联考三,15)PbSO4、PbCl2都是重要的化工原料,已知:PbCl2难溶于冷水,易溶于热水,PbCl2(s)+2Cl-(aq) PbCl42-(aq) ΔH>0﹔Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.08×10-8。20 ℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。
下列说法正确的是( )
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)相等
C.PbCl2和盐酸的混合液中加入稀硫酸后得到PbSO4,当c(Cl-)=0.1 ml·L-1时,c(SO42-)为6.75×10-5 ml·L-1
D.当盐酸浓度小于1 ml·L-1时,随着盐酸浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
答案 D
9.(2024届名校协作体开学联考,15)已知25 ℃时,Ksp(CaC2O4)=4.0×10-8,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=1.5×10-4;Ksp(CaCO3)=3.4×10-9,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。下列有关说法正确的是( )
A.25 ℃时,同浓度的NaHC2O4溶液的pH比NaHCO3大
B.用0.5 ml/L的草酸钠溶液浸泡CaCO3,可实现CaCO3完全转化为CaC2O4
C.某温度下,向含CaC2O4固体的饱和CaC2O4溶液中加入少量草酸钠固体,则CaC2O4的溶解量将减小
D.过量CaCO3溶于水达到沉淀溶解平衡,其上层清液中含碳微粒主要是CO32-
答案 C
10.(2023嘉兴二模,15)牙齿表面被一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
下列说法正确的是( )
A.CH3COOH溶解Ca5(PO4)3OH的离子方程式为Ca5(PO4)3OH+10CH3COOH5Ca2++10CH3COO-+3H3PO4+H2O
B.牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀
C.当c(F-)c(OH-)>5.0×10-31时,Ca5(PO4)3OH可与F-反应转化为Ca5(PO4)3F
D.向牙膏中添加NaHCO3、NaF均可增强护齿效果,两者原理相同
答案 C
考法综合练
考法 溶液中微粒浓度关系判断
1.(2024届义乌五校10月联考,15)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2O(l)HClO(aq)+H+(aq)+Cl-(aq) K2=10-3.4
HClO(aq)H+(aq)+ClO-(aq) K3
其中Cl2(aq)、HClO(aq)和ClO-(aq)分别在三者中所占分数(α)随pH变化的关系如图所示。
下列表述不正确的是( )
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.在氯处理水体系中,存在c(HClO)+2c(ClO-)+c(OH-)=c(H+)
C.用氯处理饮用水,pH=6.5时杀菌效果比pH=7.5时更好
D.经计算,Cl2(g)+H2O(l)2H+(aq)+ClO-(aq)+Cl-(aq)的平衡常数K=10-12.1
答案 A
2.(2024届新阵地教育联盟联考二,15)碳酸是二元弱酸,0.1 ml·L-1的NaHCO3溶液pH约为8.3,向5 mL 0.1 ml·L-1的NaHCO3溶液中逐滴滴加0.1 ml·L-1BaCl2溶液。[已知:常温下碳酸的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11,Ksp(BaCO3)=2.6×10-9,溶液混合后体积变化忽略不计]下列有关说法不正确的是( )
A.0.1 ml·L-1的NaHCO3溶液中,c(CO32-)、c(HCO3-)比值为5.6×10-2.7
B.NaHCO3溶液中存在自耦电离:HCO3-+HCO3- CO32-+H2CO3,其平衡常数约为1.3×10-4
C.0.1 ml·L-1NaHCO3溶液中离子浓度大小关系为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D.上述实验过程中可能发生反应:Ba2++2HCO3-BaCO3↓+H2O+CO2↑
答案 C
3.(2023金华十校4月模拟,15)25 ℃,Ksp(CaC2O4)=4.0×10-8,H2C2O4的电离常数Ka1=5.0×10-2,Ka2=5.4×10-5。下列有关说法正确的是( )
A.25 ℃时,CaC2O4饱和溶液中,c(Ca2+)=2.0×10-4 ml·L-1
B.25 ℃时,0.1 ml CaC2O4固体可全部溶于1 L 0.2 ml·L-1 盐酸中
C.25 ℃时,将CaC2O4分别加到0.1 ml·L-1 CaCl2和0.01 ml·L-1CaCl2两种溶液中,前者的c(Ca2+)小于后者
D.25 ℃时,紫色石蕊试液滴加到含HC2O4-的溶液中,溶液可能变蓝色
答案 A
4.(2023绍兴二模,15)室温下,用过量0.5 ml·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。当溶液中剩余的离子浓度小于1×10-5 ml·L-1时,化学上通常认为生成沉淀的反应已经完全进行了。已知:Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
A.浸泡后CaSO4未完全转化为CaCO3
B.0.5 ml·L-1 Na2CO3溶液中存在:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
C.反应CaSO4+CO32- CaCO3+SO42-正向进行,需满足c(SO42-)c(CO32-)>53×104
D.过滤后所得清液中一定存在:c(Ca2+)=Ksp(CaCO3)c(CO32-)且c(Ca2+)c(Ag+)
答案 C
6.(2022山东,14,4分)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 ml·L-1、1.0 ml·L-1 Na2CO3溶液,含SrSO4(s)的0.1 ml·L-1、1.0 ml·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/ml·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
A.反应SrSO4(s)+CO32- SrCO3(s)+SO42-的平衡常数K=Ksp(SrSO4)Ksp(SrCO3)
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 ml·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 ml·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 D
7.(2023全国甲,13,6分)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(ml·L-1)];c(M)≤10-5 ml·L-1可认为M离子沉淀完全)。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为10-103 ml·L-1
C.浓度均为0.01 ml·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 ml·L-1时二者不会同时沉淀
答案 C
8.(2024届嘉兴9月教学测试,15)T ℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知:pCd2+=-lgc(Cd2+),pN=-lgc(CO32-)或-lgc(OH-)。下列说法正确的是 ( )
A.曲线Ⅱ表示Cd(OH)2的沉淀溶解平衡曲线
B.Z点对应的溶液中:c(H+)
相关试卷
这是一份新高考化学复习专题一0三盐类水解和沉淀溶解平衡练习含答案,共25页。试卷主要包含了下列过程与水解反应无关的是,25 ℃时,苯酚的Ka=1等内容,欢迎下载使用。
这是一份新高考化学复习专题一0三盐类水解和沉淀溶解平衡拓展练习含答案,共13页。试卷主要包含了常温下,用0,5×10-45,常温下,向10等内容,欢迎下载使用。
这是一份2024届人教版高考化学一轮复习专题十三盐类的水解和沉淀溶解平衡专题作业含答案,共31页。试卷主要包含了下列叙述不涉及盐类水解的是,已知物质的溶度积常数,1 ml/L,4×10-5,pH=-lg 6,8)2=10-19,GaCl3溶液中存在平衡等内容,欢迎下载使用。








