

知识清单03 氧化还原反应(含答案) 2025年高考化学一轮复习知识清单
展开
这是一份知识清单03 氧化还原反应(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单03氧化还原反应教师版2025年高考化学一轮复习知识清单docx、知识清单03氧化还原反应学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共39页, 欢迎下载使用。
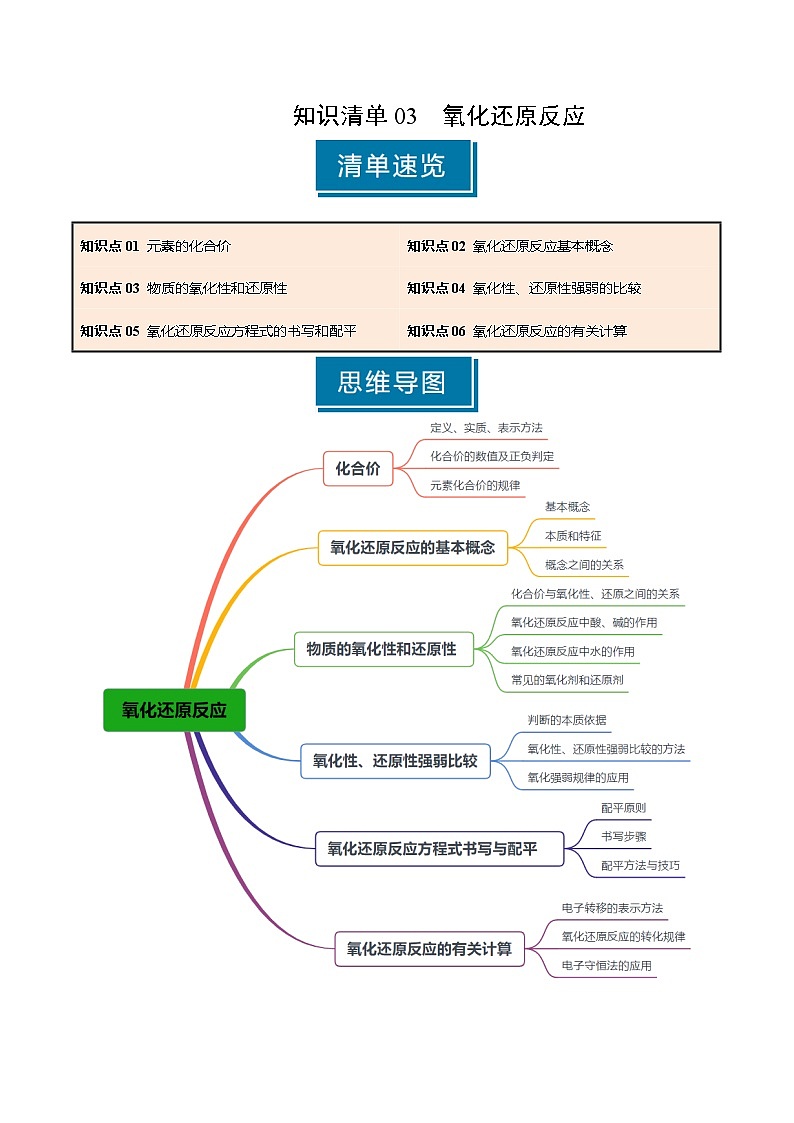
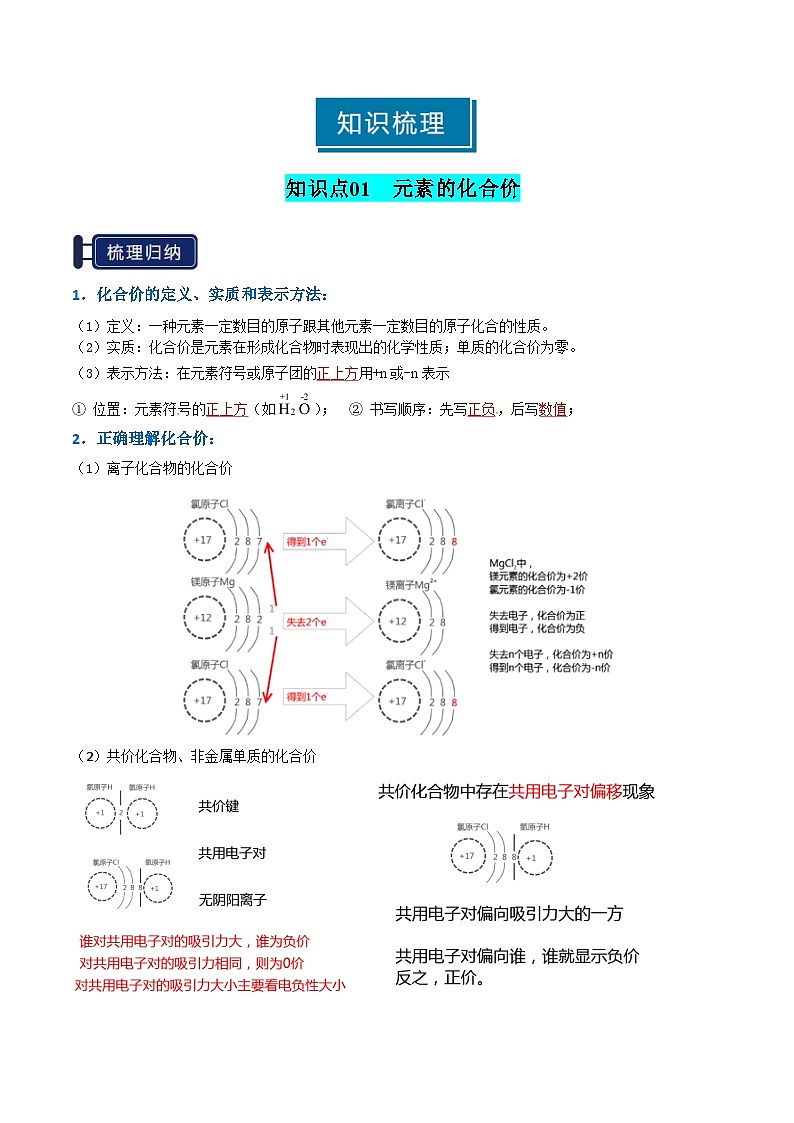
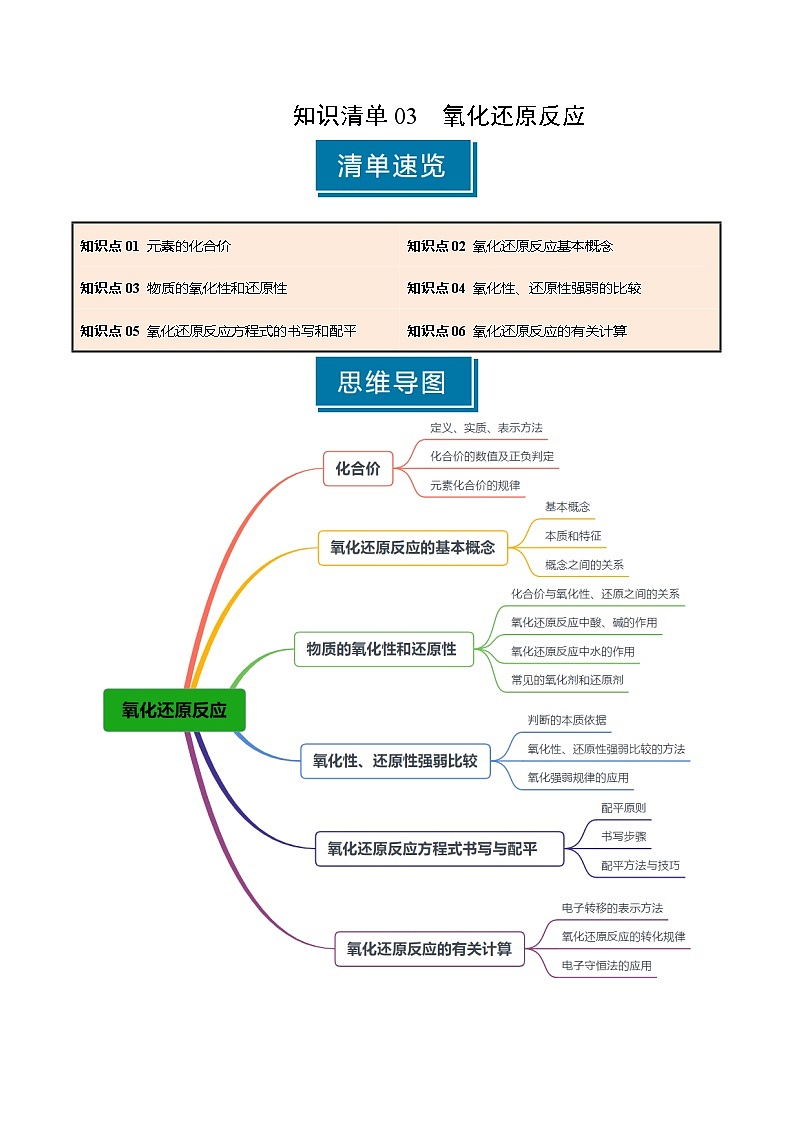
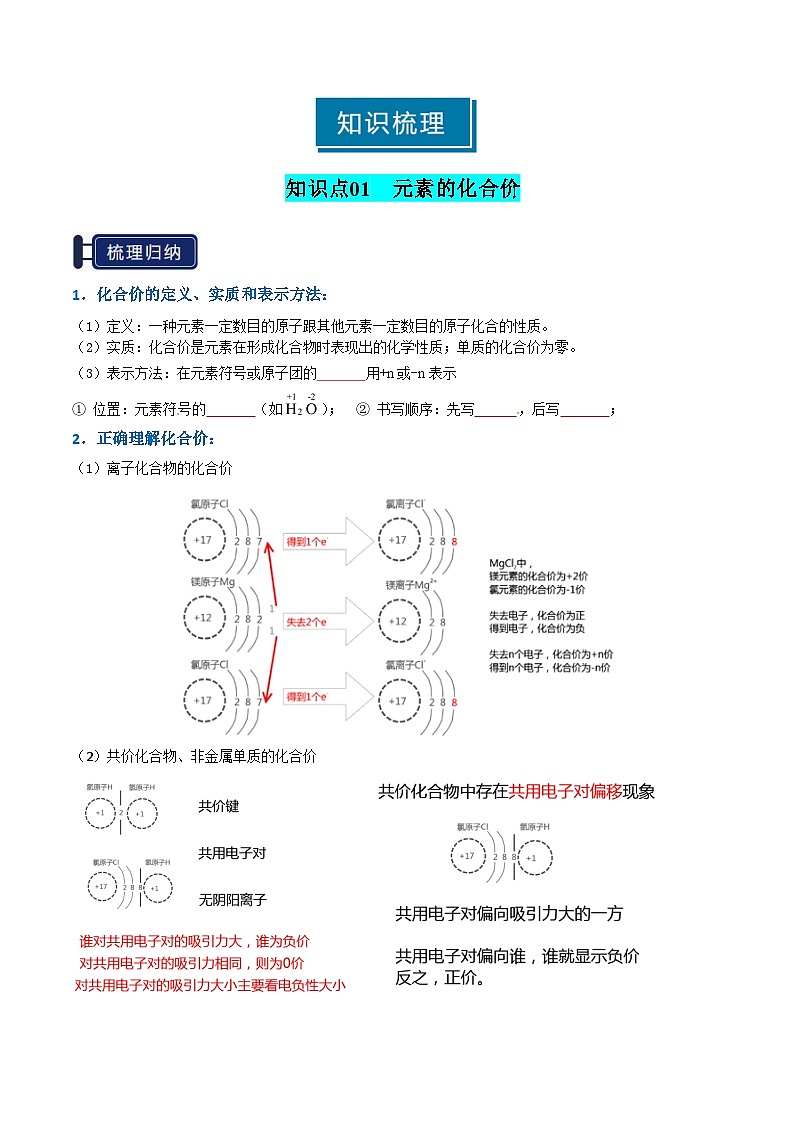
知识点01 元素的化合价
1.化合价的定义、实质和表示方法:
(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。
(2)实质:化合价是元素在形成化合物时表现出的化学性质;单质的化合价为零。
(3)表示方法:在元素符号或原子团的正上方用+n或-n表示
① 位置:元素符号的正上方(如); ② 书写顺序:先写正负,后写数值;
2.正确理解化合价:
(1)离子化合物的化合价
(2)共价化合物、非金属单质的化合价
3.化合价的数值及正负判定
4.元素化合价的规律
(1)化合价原则:
①化合物中,正负化合价的代数和=0
②离子中,正负化合价的代数和=电荷
③在化合物里,氢通常显+1价,氧通常显-2价;
④金属元素通常显正价,非金属元素通常显负价,但在非金属氧化物里,氧显负价,另一非金属元素显正价;
⑤单质中元素的化合价规定为零;
⑥许多元素具有可变化合价,如:硫、碳等;
⑦“根”的化合价一定不为零。
(2)常用等量关系
①主族元素最高正价=主族序数=原子的最外层电子数
②主族元素的最高正价+|最低负价|=8或2
③最高正化合价与其最低负化合价代数和
a.等于0的短周期元素:H、C、Si b.等于2的短周期元素:N、P
c.等于4的短周期元素:S d.等于6的短周期元素:Cl
(3)化合价的范围:+1≤最高价≤+7,-4≤最低价≤-1
5.化合价的特殊点
(1)F元素没有正化合价,金属元素没有负化合价
(2)O元素有正化合价,但是没有其所在族的最高正化合价
(3)硼元素只有+3价
(4)氢元素的化合价
①金属氢化物中,氢显-1价,如NaH、NaAlH4、
②非金属氢化物中,氢一般显+1价,如NH3、CH4、B2H6
(5)氧元素的化合价
①普通的含氧微粒中,氧显-2价
②含O22―或―O―O―的微粒中,氧显-1价
③在S2O82―()中,过氧键中的两个O显-1价,其余的O显-2价。
④在CrO5中,两个过氧键中的4个O显-1价,其余的O显-2价。
6.简单阴离子或气态氢化物中,非金属元素显最低负价
易错点:某些微粒中元素的化合价
(1)近几年高考中一些特殊物质中元素化合价判断
(2)有机物中元素的化合价
①H、N、O元素:H:+1,O:-2,N:-3
②碳元素:根据正负化合价的代数和为0计算
(3)取代基中元素的化合价
①-OH中氧元素的化合价为―1价
②-CH3中碳元素的化合价为―3价
③-CHO中碳元素的化合价为+1价
④-COOH中碳元素的化合价为+3价
⑤-NH2中氮元素的化合价为―2价
⑥-NO2中氮元素的化合价为+4价
(3)非金属元素形成的微粒:非金属性强的元素一般显最低负价
①CN-原子团显-1价,其中C显+2价,N显-3价
②HNCO中,氢显+1价,C显+4价,N显-3价,O显-2价
③HFO中,H显+1价,F显-1价,O显0价
④BrI中I元素显+1价,SiC中C元素显-4价
(4)含CO、NH3、H2O等分子的物质:
①Fe(CO)5中Fe显0价
②Cu(NH3)4SO4中Cu显+2价
(5)某些含铁、铜的硫化物
(6)无法判断价态的物质
1.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2Oeq \(――→,\s\up7(通电))X+H2 ③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( A )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、GD.G、Q、Y、Z、X
【解析】 由①得出Q中价态高于G,因为G中价态介于Q和-1价的Cl之间,-1价为氯元素的最低价;将该结论引用到③,Y介于Q与G之间,故有Q价态高于Y,Y价态高于G;分析②:H2O中的H化合价降低,则Q中的氯元素转变为X中的氯元素,化合价必升高,则得出X价态高于Q;最后分析④:Z介于Q、X之间,则X价态高于Z,Z价态高于Q。
2.已知X、Y、Z、W、Q均为含氮化合物,它们在一定条件下有如下转换关系(未配平):
①X―→W+O2
②Z+Y+NaOH―→H2O+W
③Y+SO2―→Z+SO3
④Q+Y―→Z+H2O
⑤X+Cu+H2SO4(浓)―→Cu2++Y+SOeq \\al(2-,4)
则这五种含氮化合物中氮元素的化合价由高到低的顺序为( C )
A.X>Y>Z>W>Q B.X>Z>Y>Q>W
C.X>Y>W>Z>QD.W>X>Z>Q>Y
【解析】 ①X―→W+O2中,X中氧元素失电子化合价升高,则氮元素得电子化合价降低,所以氮元素化合价X>W;③Y+SO2―→Z+SO3中,硫元素化合价升高,则Y中氮元素化合价Y>Z;②Z+Y+NaOH―→H2O+W为归中反应,则氮元素化合价W处于Z和Y中间,结合反应③可知,氮元素化合价Y>W>Z;④Q+Y―→Z+H2O为归中反应,Z处于Q和Y之间,根据③知,Y>Z,所以Z>Q;⑤X+Cu+H2SO4(浓)―→Cu2++Y+SOeq \\al(2-,4),铜元素化合价升高,则X化合价降低生成Y,所以氮元素化合价,X>Y;所以这五种含氮化合物中氮元素的化合价由高到低的顺序为X>Y>W>Z>Q。
知识点02 氧化还原反应的概念
1.氧化还原反应
2.氧化还原反应基本概念
3.氧化还原反应概念之间的关系
1.在氧化还原反应中,非金属单质不一定是氧化剂( √ )
2.某元素从游离态变为化合态,则该元素一定被还原( × )
3.有单质参加或生成的化学反应不一定是氧化还原反应( √ )
4.氧化还原反应中的反应物不是氧化剂就是还原剂( × )
5.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( × )
一、单质与氧化还原反应的关系
(1)有单质参加或生成的反应不一定是氧化还原反应,如3O2=2O3。
(2)没有单质参加的化合反应也可能是是氧化还原反应,如H2O2+SO2=H2SO4。
二、对氧化还原反应概念的理解
(1)氧化反应和还原反应存在于在同一个反应中,它们同时发生、同时存在,是相互对立统一的。
(2)氧化剂和还原剂可以是不同的物质,也可以是同种物质
①2KMnO4K2MnO4+MnO2+O2↑,氧化剂是KMnO4,还原剂是KMnO4
②2F2+2H2OO2+4HF,氧化剂是F2,还原剂是H2O
(3)氧化产物和还原产物可以是不同的物质,也可以是同种物质
①3S+6NaOHNa2SO3+2Na2S+3H2O,氧化产物是Na2SO3,还原产物是Na2S
②NO+NO2+2NaOH2NaNO2+H2O,氧化产物是NaNO2,还原产物是NaNO2
(4)被氧化的元素和被还原的元素可以是不同的元素,也可以是同种元素
①4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,被氧化的元素是Cl,被还原的元素是Mn
②2H2S+SO22H2O+3S,被氧化的元素是S,被还原的元素是S
(5)可能有多种元素同时被氧化或被还原
①3Cu2S+22HNO36Cu(NO3)2+10NO↑+3H2SO4+8H2O,被氧化的元素是Cu和S,被还原的元素是N
②2KNO3+S+3CK2S+N2↑+3CO2↑,被氧化的元素是C,被还原的元素是N和S
(6)方程式中的系数与实际参加反应的氧化剂或还原剂的量不一定一致
①C+2H2SO4CO2↑+2SO2↑+2H2O,n(氧化剂)∶n(还原剂)=2∶1
②Cu+2H2SO4CuSO4+SO2↑+2H2O,n(氧化剂)∶n(还原剂)=1∶1
知识点03 物质的氧化性和还原性
1.化合价和氧化性、还原性的关系
(1) 最高价态——只有 氧化性 ,如Fe3+、H2SO4、KMnO4等;
最低价态——只有 还原性 ,如金属单质、Cl-、S2-等;
中间价态——既有 氧化性 又有 还原性 ,如Fe2+、S、Cl2等。
(2)常见元素的最高价态和最低价态
2.氧化还原反应中酸或碱的作用
(1)氧化性:所含元素的化合价降低
(2)还原性:所含元素的化合价升高
(3)酸或碱性:所含元素的化合价不变,有相应的盐生成
(4)具体反应分析
①Zn+2HClZnCl2+H2↑,盐酸表现酸性和氧化性
②CuO+2HClCuCl2+H2O,盐酸表现酸性
③MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,盐酸表现酸性和还原性
④2HClH2↑+Cl2↑,盐酸表现氧化性和还原性
⑤3Cl2+8NH3N2+6NH4Cl,NH3表现碱性和还原性
⑥Cu2O+6HNO3(浓)2Cu(NO3)2+2NO2↑+3H2O,硝酸表现酸性和氧化性
⑦C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,浓硫酸只表现为氧化性。
3.氧化还原反应中水的作用
(1)氧化性:有H2产生
(2)还原性:有O2产生
(3)氧化性和还原性:同时有H2和O2产生
(4)具体反应分析
①2F2+2H2O4HF+O2,水表现还原性
②3Fe+4H2OFe3O4+4H2,水表现氧化性
③2Na+2H2O2NaOH+H2↑,水表现氧化性
④2H2OO2↑+2H2↑,水表现还原性和氧化性
⑤2Na2O2+2H2O4NaOH+O2↑,水既不表现氧化性又不表现还原性
⑥Cl2+H2OHCl+HClO,水既不表现氧化性又不表现还原性
⑦3NO2+H2O2HNO3+NO,水既不表现氧化性又不表现还原性
4.常见的氧化剂和还原剂
(1)常见的氧化剂及产物预测
(2)常见的还原剂及产物预测
易错点1:微粒具有性质判断的“易错点”
(1)金属单质处于最低价,只有还原性
(2)非金属单质处于中间价态,既有氧化性又有还原性,F2除外
(3)金属阳离子是高价,一定具有氧化性;但是亚铁离子具有氧化性,又有还原性。
(4)从理论上讲任何一种化合物既有氧化性又有还原性
易错点2:氧化性还原性的判断
(1)某元素由化合态变为游离态时,该元素一定被还原
某元素由化合态变为游离态时,该元素可能被还原,也可能被氧化。因为元素处于化合态时,其化合价可能为正,也可能为负。若元素由负价变为0价,则其被氧化,若元素由正价变为0价,则其被还原。
(2)在氧化还原反应中,非金属单质一定只作氧化剂
在氧化还原反应中,非金属单质不一定只作氧化剂,大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主。如在反应Cl2+H2O=HCl+HClO中,Cl2既表现氧化性又表现还原性。
(3)在氧化还原反应中,若有一种元素被氧化,则一定有另一种元素被还原
在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,有许多反应是一种元素既被氧化又被还原。如在反应2Na2O2+2H2O===4NaOH+O2↑中,Na2O2中氧元素的化合价既升高又降低。
易错点3:有关氧化性、还原性的易错点
1.具有氧化性的物质不一定是氧化剂,具有还原性的物质不一定是还原剂,应视具体反应而定。
2.对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe;价态越低,氧化性越弱,如S2-H2O2>I2。
知识点05 氧化还原反应方程式的书写和配平
1.配平原则
2.化合价升降法配平步骤
3.信息型氧化还原方程式书写流程
4.氧化还原反应方程式的配平方法
(1)正向配平法:氧化剂、还原剂中某元素化合价全部变化,一般从反应物着手配平。
(2)逆向配平法:自身氧化还原反应(包括分解、歧化)一般从生成物着手配平。
(3)缺项配平法:化学方程式所缺物质往往是酸、碱或水;如果是离子方程式,所缺物质往往是H+、OH-或水。可以根据质量守恒先写出所缺物质,再根据化合价升降守恒配平。如果无法确定所缺项,可先依据化合价的升降守恒将现有的某些物质配平,然后再根据质量守恒确定所缺物质的化学式及其化学计量数(系数)。
(4)缺项型氧化还原反应方程式的补项原则和组合方式
补项原则
组合方式
举例说明
例:高锰酸根与亚硫酸根的反应:
①酸性条件:2MnOeq \\al(-,4)+5SOeq \\al(2-,3)+6H+===2Mn2++5SOeq \\al(2-,4)+3H2O
②中性条件:2MnOeq \\al(-,4)+3SOeq \\al(2-,3)+H2O===2MnO2↓+3SOeq \\al(2-,4)+2OH-
③碱性条件:2MnOeq \\al(-,4)+SOeq \\al(2-,3)+2OH-===2MnOeq \\al(2-,4)+SOeq \\al(2-,4)+H2O
易错点:常见氧化还原反应类型及其配平技巧
1.完全氧化还原型
技巧:可从反应物或者生成物进行配平
关键:符合一般的配平步骤
实例:1eq \(C,\s\up6(0))+2H2eq \(S,\s\up6(+6))O4(浓)eq \(――→,\s\up7(△))eq \(C,\s\up6(+4))O2↑+eq \(S,\s\up6(+4))O2↑+H2O
↑4×1↓2×2
或eq \(C,\s\up6(0))+H2eq \(S,\s\up6(+6)) O4(浓)eq \(――→,\s\up7(△))eq \(1C,\s\up6(+4))O2↑+eq \(2S,\s\up6(+4))O2↑+H2O
↑4×1↓2×2
C+2H2SO4(浓)eq \(=====,\s\up7(△))CO2↑+2SO2↑+2H2O
2.歧化反应
技巧:从生成物进行配平
关键:确定氧化产物和还原产物的化学计量数
实例:eq \(N,\s\up6(+4))O2+H2O―→2Heq \(N,\s\up6(+5)) O3+1eq \(N,\s\up6(+2))O
↑1×2↓2×1
3NO2+H2O===2HNO3+NO
3.部分氧化还原型
技巧:从生成物进行配平
关键:确定氧化产物和还原产物的化学计量数
实例:eq \(M,\s\up6(+4))nO2+Heq \(C,\s\up6(-1))l(浓)eq \(――→,\s\up7(△))1eq \(M,\s\up6(+2))nCl2+1eq \(C,\s\up6(0))l2+H2O
↓2×1 ↑1×2×1
MnO2+4HCl(浓)eq \(=====,\s\up7(△))MnCl2+Cl2↑+2H2O
4.归中反应
技巧:从反应物进行配平
关键:确定氧化剂和还原剂的化学计量数
实例:1eq \(S,\s\up6(+4)) O2+2H2eq \(S,\s\up6(-2)) ―→H2O+eq \(S,\s\up6(0))
↓4×1 ↑2×2
SO2+2H2S===2H2O+3S↓
1.请配平下列氧化还原反应方程式:
(1)eq \x(1)eq \a\vs4\al(NaBO2+)eq \x(2)eq \a\vs4\al(SiO2+)eq \x(4)eq \a\vs4\al(Na+)eq \x(2)eq \a\vs4\al(H2)===eq \x(1)eq \a\vs4\al(NaBH4+)eq \x(2)eq \a\vs4\al(Na2SiO3)
(2)eq \x(11)P4+eq \x(60)CuSO4+eq \x(96)H2O===eq \x(20)Cu3P+eq \x(24)eq \a\vs4\al(H3PO4+)eq \x(60)eq \a\vs4\al(H2SO4)
(3)eq \x(1)eq \a\vs4\al(MnOOH2+)eq \x(2)eq \a\vs4\al(I-+)eq \x(4)eq \a\vs4\al(H+)===eq \x(1)eq \a\vs4\al(Mn2++)eq \x(1)eq \a\vs4\al(I2+)eq \x(3)eq \a\vs4\al(H2O)
(4) 5 Mn2++ 2 ClOeq \\al(-,3)+ 4 H2O=== 5 MnO2↓+ 1 Cl2↑+ 8 eq \x(H+)
(5) 3 ClO-+ 2 Fe(OH)3+ 4 eq \x(OH-)=== 3 Cl-+ 2 FeOeq \\al(2-,4)+ 5 H2O
【解析】根据元素化合价升降法和相应的配平技巧进行配平:
(1)eq \(N,\s\up6(0))a→eq \(N,\s\up6(+1))a2SiO3,生成1份Na2SiO3升高1×2价,eq \(H,\s\up6(0))2→NaBeq \(H,\s\up6(-1))4,生成1份NaBH4降低1×4价,根据化合价升降总数相等,在Na2SiO3前添加系数2,在NaBH4前添加系数1,再根据原子守恒配平其他物质的系数。
(2)由于Cu3P中存在多个变价元素,符合整体归一法配平,因此把Cu3P当作一个整体来分析,eq \(P,\s\up6(0))4+eq \(Cu,\s\up6(+2))SO4→eq \(Cu,\s\up6(+1))3eq \(P,\s\up6(-3)),生成1份Cu3P降低1×3+3=6价,eq \(P,\s\up6(0))4→H3eq \(P,\s\up6(+5))O4,升高5价,根据化合价升降总数相等,在H3PO4前添加系数6,在Cu3P前添加系数5,再根据原子守恒配平其他物质的系数。可知P4的系数为eq \f(11,4),再将所有的系数乘以4即可。
(3)eq \(Mn,\s\up6(+4))O(OH)2→eq \(Mn,\s\up6(+2))2+,降低2价,eq \(I-,\s\up6(-1))→eq \(I2,\s\up6(0)),升高1价,根据化合价升降总数相等,在I-前添加系数2,在I2前添加系数1,在MnO(OH)2和Mn2+前添加系数1,再根据电荷守恒和原子守恒配平H+和H2O的系数为4和3。
(4)eq \(Mn,\s\up6(+2))2+→eq \(Mn,\s\up6(+4))O2,升高2价,eq \(Cl,\s\up6(+5))Oeq \\al(-,3)→eq \(C,\s\up6(0))l2,降低5价,根据化合价升降总数相等,在Mn2+前添加系数5,在ClOeq \\al(-,3)前添加系数2,对比左右两边电荷可知,右边缺少8H+,再根据原子守恒配平H2O的系数为4。
(5)eq \(Fe,\s\up6(+3)) (OH)3→eq \(Fe,\s\up6(+6))Oeq \\al(2-,4),升高3价,eq \(Cl,\s\up6(+1))O-→eq \(Cl,\s\up6(-1))-,降低2价,根据化合价升降总数相等,在Fe(OH)3前添加系数2,在ClO-前添加系数3,对比左右两边电荷可知,左边缺少4OH-,再根据原子守恒配平H2O的系数为5。
知识点06 氧化还原反应的有关计算
1.氧化还原反应中电子转移的表示方法
(1)双线桥法:标变价→画箭头→标得失→定数目
①模型
②示例:C与浓硫酸反应
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”
①模型
②示例:Cu与浓硝酸反应
2.转移电子数的计算
(1)N(e-)=氧化剂得到电子的数目=还原剂失去电子的数目
(2)反应中转移电子的物质的量与各物质的化学计量数成正比
(3)计算公式
①n(e-)=n(氧化剂)×N(变价原子数)×ΔN(化合价变化数)
②n(e-)=n(还原剂)×N(变价原子数)×ΔN(化合价变化数)
3.氧化还原反应中转化规律
(1)5NH4NO32HNO3+4N2↑+9H2O
(2)2KClO3+6HCl(浓)KCl+3Cl2↑+3H2O
(3)H2S+H2SO4(浓)S↓+SO2↑+2H2O
4.电子守恒规律
(1)规律:氧化还原反应中得电子总数与失电子总数相等,表现为元素化合价降低总数与升高总数相等。
(2)应用:运用电子守恒进行氧化还原反应的相关计算。
5.“电子守恒法”计算的一般思维模板
1.现有24 mL浓度为0.05 ml·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 ml·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为________。
【答案】 +3
【解析】 题目中指出被还原的元素是Cr,则得电子的物质是K2Cr2O7,失电子的物质是Na2SO3,其中S元素的化合价从+4→+6,Cr元素的化合价将从+6→+n。根据氧化还原反应中得失电子守恒规律,有0.05 ml·L-1×0.024 L×(6-4)=0.02 ml·L-1×0.020 L×2×(6-n),解得n=3。
2.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 ml·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是________mL。
【答案】 60
【解析】 由题意可知,HNO3eq \(,\s\up7(Cu),\s\d5(O2、H2O))eq \b\lc\{\rc\ (\a\vs4\al\c1(NO2,N2O4,NO)),则Cu失去的电子数与O2得到的电子数相等。即n(Cu)=2n(O2)=2×eq \f(1.68 L,22.4 L·ml-1)=0.15 ml。根据质量守恒及NaOH和Cu(NO3)2的反应可得关系式:n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3 ml,则V(NaOH)=eq \f(0.3 ml,5 ml·L-1)=0.06 L=60 mL。
知识点01 元素的化合价
知识点02 氧化还原反应基本概念
知识点03 物质的氧化性和还原性
知识点04 氧化性、还原性强弱的比较
知识点05 氧化还原反应方程式的书写和配平
知识点06 氧化还原反应的有关计算
CuFeS2:Cu+2 Fe+2
HCN:C+2 N-3
CuH:Cu+1 H-1
Si3N4:Si+4 N-3
H3PO2:P+1
K2FeO4:Fe+6
LiNH2:N-3
AlN:N-3
Na2S2O3:S+2
CuCl:Cu+1
Li2NH:N-3
VOeq \\al(+,2):V+5
C2Oeq \\al(2-,4):C+3
FeOeq \\al(n-,4):Fe+(8-n)
有机物
CH3OH
HCHO
CO(NH2)2
HCOOH
碳价态
-2
0
+4
+2
物质
FeS2
CuFeS2
价态
S
Fe
Cu
Fe
S
-1
+2
+2
+2
-2
物质
AlFe2
Fe3P
Fe3C
价态
Al
Fe
Fe
P
Fe
C
0
0
0
0
0
0
氧化还原反应
特征
反应前后元素的化合价是否发生了变化
氧化还原反应
反应前后元素的化合价变化
非氧化还原反应
反应前后元素的化合价不变
本质
反应过程中有电子的转移,包括电子的得失或偏移
和四种基本反应类型的关系
置换反应一定是氧化还原反应
复分解反应一定不是氧化还原反应
有单质参加的化合反应是氧化还原反应;
有单质生成的分解反应是氧化还原反应
含“氧”概念
含“还”概念
氧化剂
氧化
反应
氧化
产物
被氧化
氧化性
还原剂
还原
反应
还原
产物
被还原
还原性
得到电子,化合价降低的反应物
化合价升高的反应
化合价升高得到的生成物
化合价升高的过程
化合价降低过程表现的性质
失去电子,化合价升高的反应物
化合价降低的反应
化合价降低得到的生成物
化合价降低的过程
化合价升高过程表现的性质
元素
Cl
S
N
C
H
最高价
+7
+6
+5
+4
+1
最低价
-1
-2
-3
-4
-1
氧化剂
还原产物
KMnO4
Mn2+(酸性);MnO2(中性);MnO42-(碱性)
K2Cr2O7(酸性)
Cr3+
浓硝酸
NO2
稀硝酸
NO
X2(卤素单质)
X-
H2O2
OH-(碱性);H2O(酸性)
Na2O2
NaOH(或Na2CO3等)
NaClO(或ClO-)
Cl-、Cl2
NaClO3
Cl2、ClO2等
PbO2
Pb2+
还原剂
氧化产物
Fe2+
Fe3+(酸性);Fe(OH)3(碱性)
SO2(或H2SO3、SO32-)
SO42-
S2-(或H2S)
S、SO2(或SO32-)、SO42-
H2C2O4
CO2(酸性);CO32-(碱性)
H2O2
O2
I-(或HI)
I2、IO3-
CO
CO2(酸性);CO32-(碱性)
金属单质(Zn、Fe、Cu等)
Zn2+、Fe2+(与强氧化剂反应生成Fe3+)
Cu2+(与弱氧化剂反应生成Cu+)
加入
溶液
①适量铋
酸钠溶液
②过量的
双氧水
③适量KI淀
粉溶液
实验
现象
溶液呈
紫红色
紫红色消失,
产生气泡
溶液变
成蓝色
介质
多一个氧原子
少一个氧原子
酸性
+2H+结合1个O→H2O
+H2O提供1个O→2H+
中性
+H2O结合1个O→2OH-
+H2O提供1个O→2H+
碱性
+H2O结合1个O→2OH-
+2OH-提供1个O→H2O
反应物
生成物
使用条件
组合一
H+
H2O
酸性溶液
组合二
H2O
H+
酸性或中性溶液
组合三
OH-
H2O
碱性溶液
组合四
H2O
OH-
碱性或中性溶液
相关学案
这是一份知识清单21 电离平衡(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单21电离平衡教师版2025年高考化学一轮复习知识清单docx、知识清单21电离平衡学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共17页, 欢迎下载使用。
这是一份知识清单04 物质的量(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单04物质的量教师版2025年高考化学一轮复习知识清单docx、知识清单04物质的量学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。
这是一份新高考化学一轮复习知识清单04 氧化还原反应,共16页。学案主要包含了典例01,典例02,典例03,典例04,典例05,典例06,典例07,典例08等内容,欢迎下载使用。









