




浙江版高考化学复习阶段检测练元素化合物物质结构与性质课件
展开1. (2024届名校协作体开学联考,3)下列说法正确的是 ( )A.基态Cr3+最外层电子排布式:3s23p63d3B.乙醇的分子式:C2H5OHC.OF2分子的空间结构:直线形D.NCl3的电子式:
2. (2023重庆,3,3分)下列叙述正确的是 ( )A.Mg分别与空气和氧气反应,生成的产物相同B.SO2分别与H2O和H2S反应,反应的类型相同C.Na2O2分别与H2O和CO2反应,生成的气体相同D.浓H2SO4分别与Cu和C反应,生成的酸性气体相同
3. (2022江苏,3,3分)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是 ( )A.半径大小:r(Al3+)
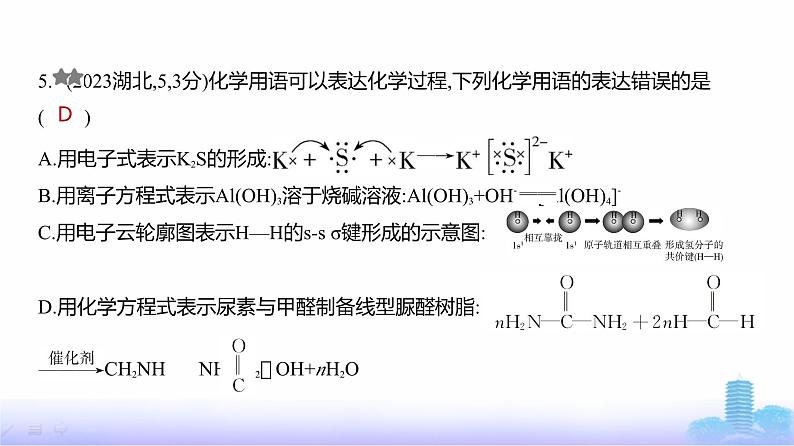
5. (2023湖北,5,3分)化学用语可以表达化学过程,下列化学用语的表达错误的是 ( )A.用电子式表示K2S的形成: B.用离子方程式表示Al(OH)3溶于烧碱溶液:Al(OH)3+OH- [Al(OH)4]-C.用电子云轮廓图表示H—H的s-s σ键形成的示意图:
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂: H?OCH2NH NHCH2?OH+nH2O
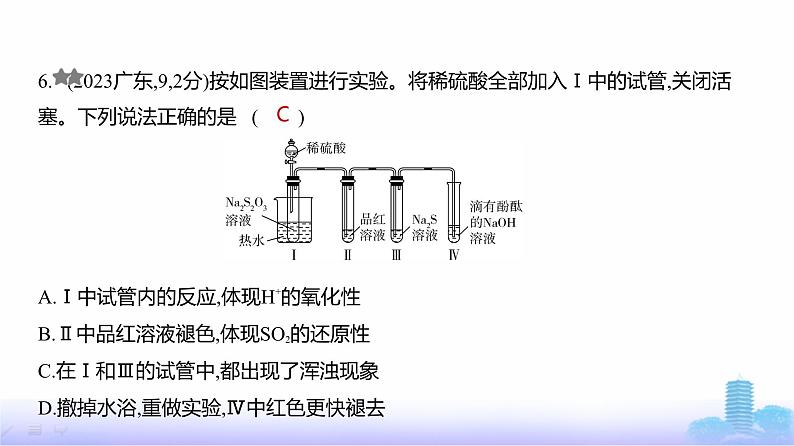
6. (2023广东,9,2分)按如图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是 ( )A.Ⅰ中试管内的反应,体现H+的氧化性B.Ⅱ中品红溶液褪色,体现SO2的还原性C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
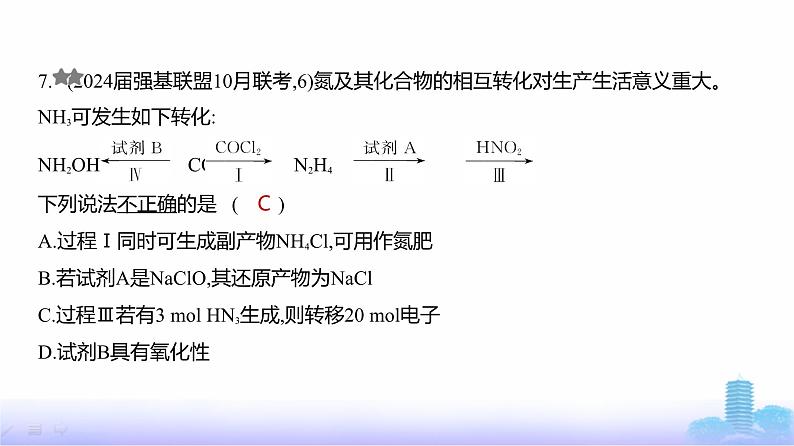
7. (2024届强基联盟10月联考,6)氮及其化合物的相互转化对生产生活意义重大。NH3可发生如下转化:NH2OH NH3 CO(NH2)2 N2H4 HN3下列说法不正确的是 ( )A.过程Ⅰ同时可生成副产物NH4Cl,可用作氮肥B.若试剂A是NaClO,其还原产物为NaClC.过程Ⅲ若有3 ml HN3生成,则转移20 ml电子D.试剂B具有氧化性
8. (2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:下列说法正确的是 ( )A.NCl3和SiCl4均为极性分子B.NCl3和NH3中的N均为sp2杂化C.NCl3和SiCl4的水解反应机理相同D.NHCl2和NH3均能与H2O形成氢键
9. (2023山东,13,4分)(双选)一种制备Cu2O的工艺路线如图所示,反应Ⅱ所得溶液pH在3~4之间,反应Ⅲ需及时补加NaOH以保持反应在pH=5条件下进行。常温下,H2SO3的 电离平衡常数 =1.3×10-2, =6.3×10-8。下列说法正确的是 ( )
A.反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应B.低温真空蒸发主要目的是防止NaHSO3被氧化C.溶液Y可循环用于反应Ⅱ所在操作 单元中吸收气体ⅠD.若Cu2O产量不变,参与反应Ⅲ的X与CuSO4物质的量之比 增大时,需补加NaOH的量减少
10. (2024届杭州一模,11)已知A、B、C、D是周期表中前三周期元素,且原子序数依次增大,其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子, D原子s能级与p能级电子数相等,下列说法正确的是( )A.原子半径:A>B>C>DB.第一电离能:A
12. (2021全国乙,26,14分)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收 钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
回答下列问题:(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的 硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式 。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依 次析出的金属离子是 。(3)“母液①”中Mg2+浓度为 ml·L-1。(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是 。“酸溶渣”的成分是 、 。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方 程式是 。(6)将“母液①”和“母液②”混合,吸收尾气,经处理得 ,循环利用。
答案 (1)Al2O3+4(NH4)2SO4 2NH4Al(SO4)2+3H2O↑+6NH3↑ (2)Fe3+、Al3+、Mg2+(3)1.0×10-6 (4)硫酸 SiO2 CaSO4(5)TiO2++(x+1)H2O TiO2·xH2O↓+2H+(6)(NH4)2SO4
13. (2024届名校协作体开学联考,17)钙钛矿材料具有可设计性,其吸光能力远高于晶体硅材料。钙钛矿常由H、N、O、Ca、Ti、卤素等元素组成。请回答下列问题:(1)基态Ti原子的价电子排布图为 。与Ti位于同一周期且含有相同未成对 电子数的主族元素为 。(2)下列说法正确的是 (填字母)。A.CH3N 中C原子与N原子的杂化类型不同B.N、O元素的第二电离能大小顺序为O>NC.CaTiO3的组成元素的电负性大小顺序是O>Ti>CaD.SiCl4的相对分子质量大于SiO2,所以SiCl4的沸点高于SiO2
(3)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。从原 子半径和共价键成键的角度分析,C、O原子间易形成C O键,而Si、O原子间不易形成Si O键的原因: 。(4)钙钛矿并不是专指一种含钙和钛的化合物,而是一类具有相似结构的晶体材料的总 称,其中A是较大的阳离子,B是较小的阳离子,X是阴离子。图示晶胞表示立方钙钛矿, 其通式可表示为 (用A、B、X表示)。一种光电材料的组成为Pb2+、I-和有 机碱离子CH3N (该材料的结构与立方钙钛矿相同)。若晶胞参数为a nm,则晶体密度为 g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
浙江版高考化学复习阶段检测练化学反应原理课件: 这是一份浙江版高考化学复习阶段检测练化学反应原理课件,共21页。
2025版高考化学一轮复习真题精练第五章物质结构与性质元素周期律第13练以选择题形式考查物质结构与性质课件: 这是一份2025版高考化学一轮复习真题精练第五章物质结构与性质元素周期律第13练以选择题形式考查物质结构与性质课件,共37页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第五章物质结构与性质元素周期律第14练以非选择题形式考查物质结构与性质课件: 这是一份2025版高考化学一轮复习真题精练第五章物质结构与性质元素周期律第14练以非选择题形式考查物质结构与性质课件,共17页。PPT课件主要包含了新考法等内容,欢迎下载使用。












