


所属成套资源:新高考化学一轮复习考点巩固练习 (2份,原卷版+解析版)
新高考化学一轮复习考点巩固练习08 新情景中氧化还原反应方程式的配平与书写(解析版)
展开
这是一份新高考化学一轮复习考点巩固练习08 新情景中氧化还原反应方程式的配平与书写(解析版),文件包含新高考化学一轮复习考点巩固练习08新情景中氧化还原反应方程式的配平与书写原卷版doc、新高考化学一轮复习考点巩固练习08新情景中氧化还原反应方程式的配平与书写解析版doc等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
氧化还原反应方程式的书写一般在填空题中出现较多,常结合化工生产流程及实验探究中考查,越来越注重结合新信息书写陌生的化学方程式(离子方程式)。要求考生要有效地接受、吸收、整合题目的信息,推断物质,利用守恒规律加以书写,充分体现出学科核心素养:电子得失——变化观念与守恒思想;方程式配平——模型认知;而氧化性(还原性)体现宏观辨识与微观探析。具体解题可用以下方法:
“四步法”突破新情景下氧化还原方程式的书写
第一步:根据题干信息或流程图,判断氧化剂、还原剂、氧化产物、还原产物。
第二步:按“氧化剂+还原剂——氧化产物+还原产物”写出方程式,根据得失电子守恒对方程式进行配平。
第三步:根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
第四步:根据质量守恒配平反应方程式。
【典例精析】
KMnO4能与热的硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方程式为
分析第一步:依题意,锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物。
第二步:按“氧化剂+还原剂——氧化产物+还原产物”把离子方程式初步写成:,由MnO4- AUTOTEXT => \* MERGEFORMAT Mn2+,锰元素降了5价,由C2O42- AUTOTEXT => \* MERGEFORMAT CO2,碳元素升了1价,失 2e-
1mlC2O42-共失去2mle-,故在C2O42-前配5,在氧化产物CO2前配10,在MnO4-前配2,在还原产物Mn2+前配2,即。
第三步:反应在硫酸中进行,故在左边补充H+,右边补充H2O,2MnO4-+5C2O42-+H+ AUTOTEXT => \* MERGEFORMAT 2Mn2++10CO2↑+H2O
第四步:依据电荷守恒及H、O原子守恒配平如下:
2MnO4-+5C2O42-+16H+ △
2Mn2++10CO2↑+8H2O
一、工艺流程中的氧化还原方程式的书写
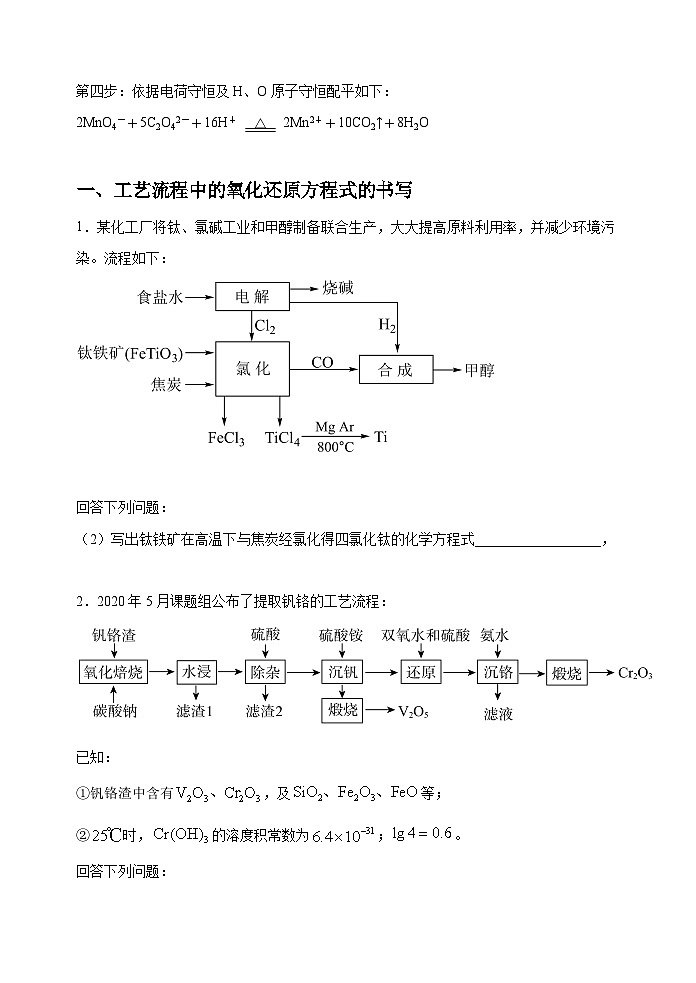
1.某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染。流程如下:
回答下列问题:
(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式__________________,
【答案】(2) 2FeTiO3+7 Cl2+6C2FeCl3+2TiCl4+6CO
【解析】
(2)钛铁矿在高温下与焦炭经氯化得四氯化钛,根据元素守恒及流程图可知,同时有氯化铁、CO生成,化学方程式为2FeTiO3+7Cl2+6C2FeCl3+2TiCl4+6CO;
2.2020年5月课题组公布了提取钒铬的工艺流程:
已知:
①钒铬渣中含有,及等;
②时,的溶度积常数为;。
回答下列问题:
(4)写出“煅烧”时反应的化学方程式______(已知“沉钒”时析出正五价钒的含氧酸铵盐)。
(5)“还原”溶液中的时发生反应的离子方程式为______,
【答案】
(4) (5)
【解析】
(4)由分析可知,正五价钒的含氧酸铵盐为,“煅烧”时反应的化学方程式为,故答案为:;
(5)由分析可知,“还原”溶液中的时发生反应的离子方程式为;
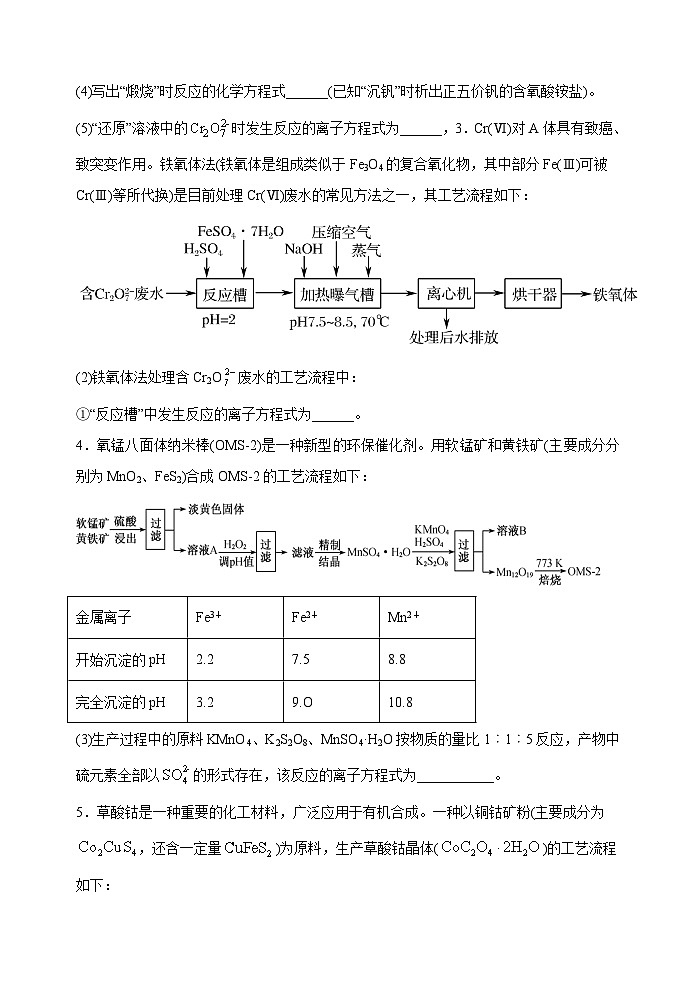
3.Cr(Ⅵ)对A体具有致癌、致突变作用。铁氧体法(铁氧体是组成类似于Fe3O4的复合氧化物,其中部分Fe(Ⅲ)可被Cr(Ⅲ)等所代换)是目前处理Cr(Ⅵ)废水的常见方法之一,其工艺流程如下:
(2)铁氧体法处理含Cr2O废水的工艺流程中:
①“反应槽”中发生反应的离子方程式为______。
【答案】Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】
(2)①反应槽中,Cr2O在酸性条件下氧化Fe2+,生成Fe3+和Cr3+,根据Fe和Cr得失电子守恒,用H+平衡电荷,则离子方程式为Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O。
4.氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为MnO2、FeS2)合成OMS-2的工艺流程如下:
(3)生产过程中的原料KMnO4、K2S2O8、MnSO4·H2O按物质的量比1︰1︰5反应,产物中硫元素全部以的形式存在,该反应的离子方程式为___________。
【答案】
【解析】
(3)生产过程中的原料KMnO4、K2S2O8、MnSO4▪H2O按物质的量比1:1:5反应,产物中硫元素全部以的形式存在,Mn全部转化为Mn12O19,根据质量守恒和电荷守恒,可写出反应的化学方程式为2 +2+10Mn2++11H2O=Mn12O19↓+4 +22H+。
5.草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿粉(主要成分为,还含一定量)为原料,生产草酸钴晶体()的工艺流程如下:
已知:①“浸出”液含有的离子主要有、、、、;
②草酸钴晶体难溶于水。
回答下列问题:
(3)“氧化”过程中发生的主要反应的离子方程式为____________________。
【答案】
【解析】
(3)由流程梳理可知,“氧化”过程中,过氧化氢与亚铁离子发生氧化还原反应生成,反应的离子方程式为;“
6.三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
(5)NiC2O4·2H2O高温煅烧制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体,发生反应的化学方程式为___________。
【答案】2NiC2O4·2H2O Ni2O3+3CO↑+CO2↑+4H2O
【解析】
(5)NiC2O4·2H2O高温煅烧生成三氧化二镍、CO、CO2、水蒸气,根据得失电子守恒,发生反应的化学方程式为2NiC2O4·2H2O Ni2O3+3CO↑+CO2↑+4H2O;
7.三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备的工艺流程如图所示。
已知:铜钴矿石主要含有、、,其中还含有一定量的、和等。请回答下列问题:
(4)向“沉铜”后的滤液中加入溶液,写出滤液中的金属离子与反应的离子方程式_______。
(6)在空气中高温煅烧得到的化学方程式是_______。
【答案】(4)
(6)
【解析】
(4) “沉铜”后的滤液中含有Fe2+,向其中加入NaClO3溶液,NaClO3会将Fe2+氧化为Fe3+,则根据电子守恒、电荷守恒及原子守恒,可知滤液中的Fe2+与NaClO3反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(6) 由题中可知CC2O4•2H2O在空气中高温煅烧得到C2O3,CC2O4中C的化合价为+2价,生成C2O3(C的化合价为+3价),化合价升高,说明空气中的O2作为氧化剂参与了反应,而C2O42-具有一定还原性也被O2氧化成CO2,故产物分别为C2O3和CO2,根据元素守恒,可推测出产物中还有H2O生成。在根据电子守恒和原子守恒法,最终可得知反应方程式为4CC2O4·2H2O+3O22C2O3+8CO2+8H2O;
【归纳总结】
工艺流程中的氧化还原方程式的书写方法
(1)细读题干寻找提纯对象,结合工艺流程示意图分析被提纯元素的存在形式及杂质的去除情况。
(2)确定未知反应的反应物和生成物,根据题意分析溶液环境,配平氧化还原方程式。
二、实验探究中的氧化还原方程式的书写
1. (2018年全国Ⅰ卷)醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
【答案】(2)①Zn+2Cr3+=Zn2++2Cr2+
【解析】
(2)①c中溶液由绿色逐渐变为亮蓝色,说明Cr3+被锌还原为Cr2+,反应的离子方程式为Zn+2Cr3+=Zn2++2Cr2+;过量锌将CrCl3全部还原成CrCl2;
2.(2018年江苏卷)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH−ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;
【答案】(1)3Cl2+6OH−5Cl−+ClO3−+3H2O
【解析】
(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O,反应的化学方程式为3Cl2+6NaOH5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH-5Cl-+ClO3-+3H2O。
3.和是高中阶段最常见的两种氧化剂,经查阅资料氧化能力强于,能将氧化。为了验证该结论,某学生设计了如下图所示的实验装置进行实验(夹持装置略去),该学生利用高锰酸钾与浓盐酸反应制取氯气。请回答下列问题:
(1)圆底烧瓶A中发生反应的化学方程式是_______________。
【答案】(1)
【解析】
(1)A是制取氯气的装置,其中高锰酸钾被还原为。
4.(2)氨气与二氧化氮的反应
将上述收集到的充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(两端用夹子夹好)。在一定温度下按图示装置进行实验。
【答案】(2)①红棕色气体慢慢变浅
②
③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减少,Y管中压强小于外界大气压
【解析】
(2)由题干内容“工业上在一定温度和催化剂条件下用将还原生成,结合实验条件可知反应为,为红棕色气体,发生反应后变成无色气体,因此现象为红棕色气体逐渐变浅。反应后气体分子数减少,Y管中的压强小于外界大气压,因此产生倒吸现象。
5.(2019年北京卷)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a ml·L−1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b ml·L−1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(2)Ⅱ中发生反应的离子方程式是_______________________________。
(2)+5Br-+6H+=3Br2 +3H2O
氯苯()是重要的化工原料,某同学通过查阅资料后设计了如图所示的装置制备粗氯苯。(夹持装置及加热装置已省略)
(1)若试剂Ⅰ为紫黑色固体,写出装置A中发生反应的离子方程式:___________________。
【答案】(1)
6..某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
3.装置F中发生反应的化学方程式是__________
5.装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__________
【答案】3.
5.3Cl2+8NH3=N2+6NH4Cl
【解析】
3.F装置中发生
5.C中的反应物是NH3与Cl2,产生的白烟是固体NH4Cl,另一生成物是空气的主要成分N2,反应方程式为3Cl2+8NH3=N2+6NH4Cl
【归纳总结】
(1)细读题干寻找实验目的,通读题目中从实验步骤中了解操作步骤,结合装置分析实验过程,与实验目的相对应。
(2)根据题意确定反应物和生成物,结合溶液环境配平方程式,注意质量守恒、电子守恒、电荷守恒。
【实战演练】
1.()是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓或浓反应生成以回收。在回收过程中涉及如下化学反应:
①;
②。
下列有关叙述不正确的是
A.反应①中是还原产物,是氧化产物
B.、(浓)、的氧化性由强到弱的顺序是(浓)
C.反应②中浓既体现其酸性又体现强氧化性
D.反应①中每有生成,转移电子数目为
【答案】C
【解析】
A.反应①中氧化剂是,还原剂是,则是还原产物,是氧化产物,A正确。
B.同一个氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,反应①中氧化剂是,氧化产物是,反应②中氧化剂是浓硫酸,氧化产物是,所以氧化性:(浓),B正确。
C.反应②中浓只体现其强氧化性,而不体现酸性,C错误。
D.反应①中每生成转移电子,则每有生成,转移电子,即转移电子数目为,D正确。
故选:C。
2.用Cu2S、FeS处理酸性废水中的Cr2O,发生的反应如下:
反应①:Cu2S+Cr2O+H+→Cu2++SO+Cr3++H2O(未配平)
反应②:FeS+Cr2O+H+→Fe3++SO+Cr3++H2O(未配平)
下列判断错误的是
A.反应①中还原剂与氧化剂的物质的量之比为3:5
B.用相同物质的量的Cu2S和FeS处理Cr2O时,Cu2S消耗更多Cr2O
C.处理等物质的量的Cr2O时,反应①和②中消耗H+的物质的量相等
D.用FeS处理废水不仅可以除去Cr2O,还可吸附悬浮杂质
【答案】C
【分析】
根据得失电子守恒、电荷守恒、元素守恒配平两个方程式如下:反应①:3Cu2S+5+46H+=6Cu2++3+10Cr3++23H2O;反应②:6FeS+9+78H+=6Fe3++6+18Cr3++39H2O。
【解析】
A. 由分析知,还原剂所含元素化合价升高,失电子,氧化剂所含元素化合价降低,得电子,则Cu2S为还原剂,为氧化剂,则反应①中还原剂与氧化剂的物质的量之比为3:5,A正确;
B. 1mlCu2S参与反应失去10ml电子,1mlFeS参与反应失去9ml电子,根据得失电子守恒可知,用相同物质的量的Cu2S和FeS处理时,Cu2S消耗更多,B正确;
C. 由分析知,处理等物质的量的时,反应①②中消耗H+的物质的量不等,C错误;
D. 用FeS处理废水不仅可以除去Cr2O,且该反应还可以生成Fe3+,Fe3+能水解生成氢氧化铁胶体,其具有吸附性,可吸附悬浮杂质,D正确;
故选C。
3.硫酸根自由基()是具有较高氧化还原电位的自由基,可以氧化很多物质。通常利用分解过硫酸盐的方式产生硫酸根自由基。碱性条件下,过硫酸钠(硫元素为+6价)活化Fe得到和(和为具有强氧化性的自由基),去除水体中As(V)的机理模型如图所示。下列有关说法中正确的是
A.中氧元素显-2价
B.与As(V)共沉淀时发生了氧化还原反应
C.和Fe发生的反应为
D.强碱性条件下,溶液中的自由基主要为
【答案】D
【解析】
A.中含过氧键,氧元素价态有-1价,选项A错误;
B.与As(V)共沉淀时,没有元素发生化合价变化,选项B错误;
C.和Fe发生反应生成和,反应为,和发生反应生成和,反应为,选项C错误;
D.根据图示可知,强碱性条件下,,故强碱性条件下,溶液中的自由基主要是,选项D正确。
答案选D。
4.实验室模拟工业回收碘水中的碘,其操作流程如下:
下列判断正确的是
A.在中的溶解度小于在中的
B.②、③中涉及的分离操作分别为分液和过滤
C.②中与足量完全反应转移了
D.②中反应消耗的和③中反应消耗的的物质的量之比为
【答案】B
【分析】
根据已知,②中发生的反应是,③中发生的反应是;
【解析】
A.卤素在四氯化碳中溶解度大于水中溶解度,A错误;
B.②是将四氯化碳与水溶液分离,二者互不相容,且为液态混合物,故是分液;③是将固体与液体分离,故为过滤,B正确;
C.由方程式可以看出,每与足量完全反应转移了,故与足量完全反应转移了,C错误;
D.设②中消耗6ml氢氧化钠,则③中硫酸的物质的量为3ml(含有6ml氢离子),二者之比是2:1,D错误;
答案选B。
5.五氟化锑()是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为,含有少量CuO、PbO、 等杂质)为原料制备的工艺流程如图。
已知:I.CuS、PbS的分别为、;
Ⅱ.微溶于水、难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
(1)浸出时少量转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为,该反应的离子方程式为___________,
(3)“除砷”时,转化为,该反应的离子方程式为___________
(5)与反应,首次实现了用化学方法制取,同时生成和,化学反应方程式为___________,
【答案】
【解析】
(1)浸出时少量转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为,该反应的离子方程式为,
(3)“除砷”时,转化为,As3+被还原为As单质,则该反应的离子方程式为。
(5)与反应制取,同时生成和,根据得失电子守恒、元素守恒配平该化学反应方程式为,
6.用含铬不锈钢废渣(含、、、等)制取(铬绿)的工艺流程如图所示:
回答下列问题:
(2) 、KOH、反应生成的化学方程式为___________。
(5)“还原”时发生反应的离子方程式为___________。
【答案】
【解析】
(2)失去,、得到,依据得失电子数相等,配平得;
(5)得到,失去,依据得失电子数相等,配平得;
7.自然界中锰是含量较高的元素,分布在海洋深处与地壳中,它有多种化合价,如KMnO4(Ⅶ)、K2MnO4(Ⅵ)、MnO2(Ⅳ)等具有氧化性,MnSO4(Ⅱ)等具有还原性。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式___。
【答案】2MnO+2H2O2MnO+2OH-+H2↑
【解析】
(1)根据题意,电解锰酸钾溶液制备高锰酸钾,则阳极锰酸根失电子转化为高锰酸根,阴极水电离的氢离子得电子转化为氢气,反应的离子方程式为2MnO+2H2O2MnO+2OH-+H2↑;
8.活性自由基HO可有效除去废水中的苯酚等有机污染物。
(1)H2O2在Fe3O4催化剂表面产生HO除去废水中的苯酚的原理如图-1所示。
①酸性条件下,该催化过程中产生HO的反应的离子方程式为___________。
(2)掺杂了Cr3+的Fe3O4催化剂催化氧化原理如图-2所示。在Fe3O4催化剂中掺杂少量Cr3+,可提高催化效率,但浓度太高,反而会降低催化效率,其原因是___________。
(3)光催化氧化技术也可生成HO降解有机污染物。其原理如图-3.光照时,价带失去电子产生有强氧化性的空穴。价带上生成HO的电极反应式为___________。
【答案】H+ + H2O2 + Fe2+ = H2O +Fe3+ + HO• H2O − e− = H+ + HO•
【解析】
(1)①据图可知酸性环境中Fe2+被氧化为Fe3+,同时得到HO•,根据电子守恒和元素守恒可得离子方程式为H+ + H2O2 + Fe2+ = H2O +Fe3+ + HO•;
(3)据图可知水分子在价带上失电子发生氧化反应,电极反应为H2O − e− = H+ + HO•;光照时,电子从价带跃迁至导带,O2在导带获得电子生成H2O2或O•,最终转化为HO•。
金属离子
Fe3+
Fe2+
Mn2+
开始沉淀的pH
2.2
7.5
8.8
完全沉淀的pH
3.2
9.O
10.8
操作步骤
实验现象
解释原因
打开,推动注射器活塞,使X中的气体缓慢充入Y管中
①Y管中 。
②反应的化学方程式为
。
将注射器活塞退回原处并同定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝 聚
打开
③ 。
④ 。
相关试卷
这是一份2025年高考化学一轮复习讲练测第05讲氧化还原反应方程式的配平、书写及计算(练习)(含解析答案,共26页。试卷主要包含了氧化还原反应方程式的书写与配平等内容,欢迎下载使用。
这是一份2025年高考化学一轮复习讲练测第05讲氧化还原反应方程式的配平、书写及计算(练习)(含解析答案,共26页。试卷主要包含了氧化还原反应方程式的书写与配平等内容,欢迎下载使用。
这是一份新情景条件下氧化还原反应方程式的书写-高考化学专题,文件包含微专题新情景条件下氧化还原反应方程式的书写解析版1pdf、微专题新情景条件下氧化还原反应方程式的书写学生版pdf等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。









