
新高考化学一轮复习考点过关练考向11 硫及其化合物(含解析)
展开【2022江苏卷】实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
A.用装置甲制取气体B.用装置乙制取水溶液
C.用装置丙吸收尾气中的D.用干燥pH试纸检验水溶液的酸性
【答案】C
【详解】
A.60%硫酸和NaHSO3(s)可发生反应:H2SO4+2NaHSO3=Na2SO4+2SO2↑+2H2O,因此装置甲可以制取气体,A正确;
B.气体通入液体时“长进短处”,装置乙可以制取水溶液,B正确;
C.SO2不会与饱和NaHSO3溶液发生反应,因此装置丙不能吸收尾气中的,C错误;
D.水溶液显酸性,可用干燥的pH试纸检验其酸性,D正确;
答案选C。
知识点一 硫及其氧化物
1.硫单质
(1)硫元素存在形态
①游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
②化合态:主要以硫化物和硫酸盐的形式存在,有关化学式如下:
(2)物理性质
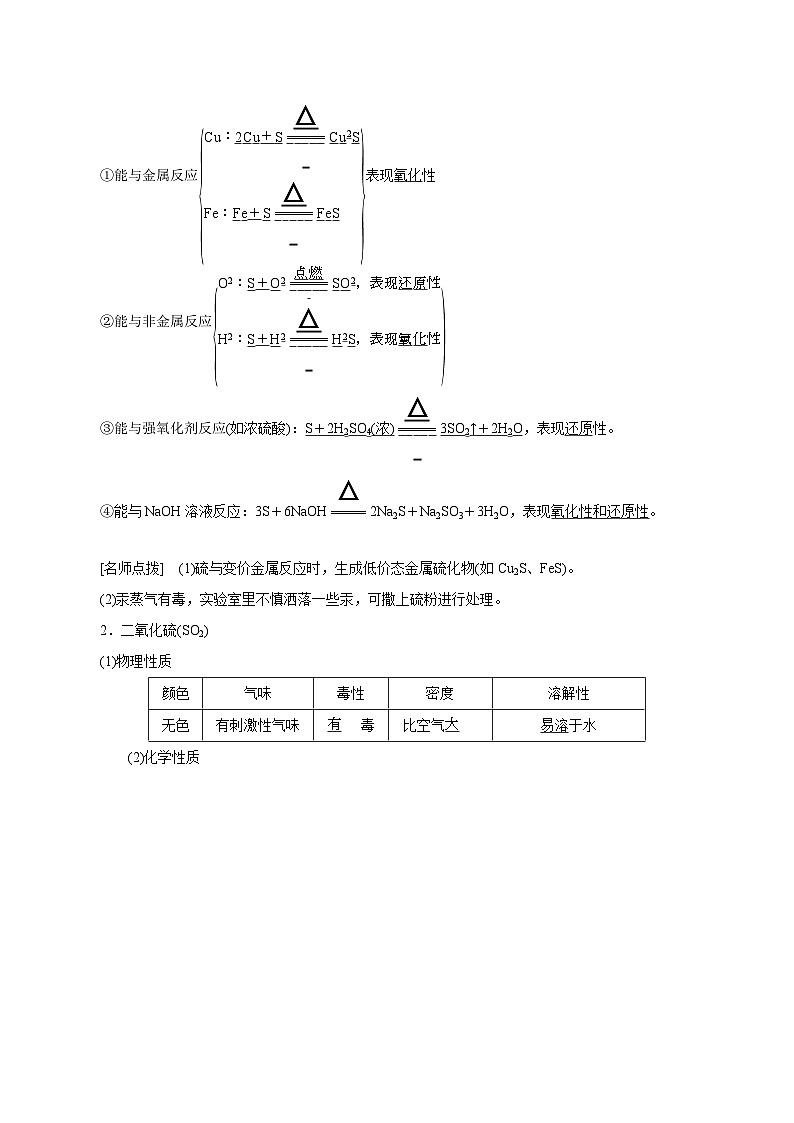
(3)化学性质
①能与金属反应 eq \b\lc\{\rc\}(\a\vs4\al\c1(Cu:2Cu+S\(=====,\s\up7(△))Cu2S,Fe:Fe+S\(=====,\s\up7(△))FeS)) 表现氧化性
②能与非金属反应 eq \b\lc\{(\a\vs4\al\c1(O2:S+O2\(=====,\s\up7(点燃))SO2,表现还原性,H2:S+H2\(=====,\s\up7(△))H2S,表现氧化性))
③能与强氧化剂反应(如浓硫酸):S+2H2SO4(浓) eq \(=====,\s\up7(△)) 3SO2↑+2H2O,表现还原性。
④能与NaOH溶液反应:3S+6NaOH eq \(=====,\s\up7(△)) 2Na2S+Na2SO3+3H2O,表现氧化性和还原性。
[名师点拨] (1)硫与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
2.二氧化硫(SO2)
(1)物理性质
(2)化学性质
[名师点拨] 三类漂白剂的区别
(3)实验室制备与探究流程
[名师点拨] 用70%左右的浓硫酸而不用98.3%的浓硫酸或稀硫酸的原因:若用98.3%的浓硫酸,因其含水少,硫酸主要以分子形式存在,H+浓度很小,难以反应。若用稀硫酸,则含水量多,因SO2易溶于水,不利于SO2的逸出。
3.硫的氧化物的污染与治理
(1)硫的氧化物的来源、危害及治理
(2)硫酸型酸雨的形成过程:
知识点二 硫酸 硫酸根离子的检验
1.硫酸的物理性质
(1)纯硫酸是一种无色油状液体,沸点高,难挥发。
(2)溶解性:浓H2SO4与水以任意比互溶,溶解时可放出大量的热。
(3)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。
2.稀H2SO4具有酸的通性
硫酸是强电解质,在水溶液中的电离方程式为 eq \a\vs4\al(H2SO4===2H++SO eq \\al(\s\up1(2-),\s\d1(4)) ) ,能与指示剂、金属、碱性氧化物、碱、盐等物质发生反应。
3.浓H2SO4的特性
[名师点拨] (1)H2SO4是高沸点、难挥发性的强酸,利用这一性质可以制取HCl和HF:H2SO4(浓)+NaCl eq \(=====,\s\up7(△)) NaHSO4+HCl↑,CaF2+H2SO4===CaSO4+2HF↑。
(2)由“量变”引起的“质变”:金属(如Cu、Zn等)与浓H2SO4反应时,开始阶段产生SO2气体,随着反应的进行,H2SO4的浓度变小,最后变为稀H2SO4,Cu与稀H2SO4不反应,Zn与稀H2SO4反应生成H2而不是SO2。
4.硫酸的工业制备
(1)工艺流程
[名师点拨] 工业上用98%的硫酸吸收SO3,可以避免用水吸收SO3产生的酸雾腐蚀设备,并且可以提高吸收率。
(2)反应原理
①燃烧硫铁矿(FeS2)或硫制备SO2:
4FeS2+11O2 eq \(=====,\s\up7(高温)) 2Fe2O3+8SO2或S+O2 eq \(=====,\s\up7(△)) SO2。
②SO2转化为SO3:2SO2+O2 eq \(,\s\up11(催化剂),\s\d4(△)) 2SO3。
③SO3被吸收生成H2SO4:SO3+H2O===H2SO4。
5.SO eq \\al(\s\up11(2-),\s\d4(4)) 的检验
(1)检验方法
检验SO eq \\al(\s\up11(2-),\s\d4(4)) 的正确操作方法:被检液加足量盐酸酸化,取清液滴加BaCl2溶液有无白色沉淀产生(判断有无SO eq \\al(\s\up11(2-),\s\d4(4)) )
(2)检验误区
6.重要的硫酸盐
知识点三 硫及其化合物的相互转化及应用
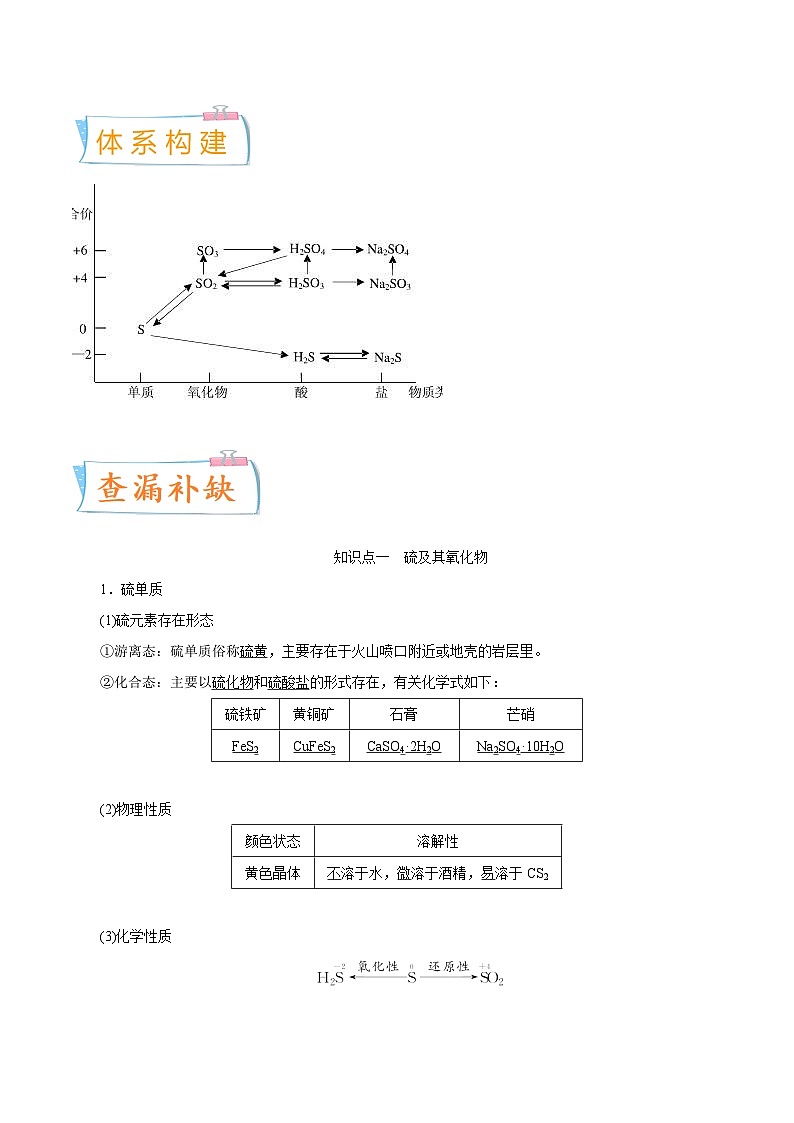
1.理清硫元素的化合价与氧化性、还原性之间的关系
2.掌握硫及其化合物之间的转化规律
(1)相同价态硫的转化是通过与酸、碱反应实现的
如:
②、③、④反应的化学方程式分别为
②H2SO3+2NaOH===Na2SO3+2H2O;
③Na2SO3+H2SO4===Na2SO4+H2O+SO2↑;
④SO2+Na2SO3+H2O===2NaHSO3。
(2)不同价态硫的转化是通过氧化还原反应实现的
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示
如:H2S eq \(,\s\up11(①O2(不足)),\s\d4(④H2、△)) S eq \(,\s\up11(②O2),\s\d4(⑤H2S)) SO2 eq \(――――――→,\s\up11(③O2),\s\d4(催化剂、△)) SO3
③、④、⑤反应的化学方程式分别为
③2SO2+O2 eq \(,\s\up11(催化剂),\s\d4(△)) 2SO3;
④S+H2 eq \(=====,\s\up7(△)) H2S;
⑤SO2+2H2S===3S↓+2H2O。
[名师点拨] (1)同种元素相邻价态的微粒间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)当硫元素的高价态微粒与低价态微粒反应时,一般生成中间价态,如2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
1.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)的说法正确的是( )
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨和温室气体
2.下列能够确定溶液中一定含有SO eq \\al(\s\up11(2-),\s\d4(4)) 的事实是( )
A.取少量试液,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成
B.取少量试液,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失
C.取少量试液,加入硝酸钡溶液,有白色沉淀生成
D.取少量试液,加入盐酸无明显现象产生,再加入氯化钡溶液,有白色沉淀生成
3.天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
A.该脱硫过程需要不断添加Fe2(SO4)3溶液
B.脱硫过程O2间接氧化H2S
C.亚铁是血红蛋白的重要组成成分,FeSO4可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,说明我国古代已利用天然气煮盐
4.已知2FeSO4 eq \(=====,\s\up7(高温)) Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是( )
A.用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B.用装置乙可检验分解产生的SO2,现象是石蕊溶液先变红后褪色
C.用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D.用装置丁可吸收尾气,避免污染环境
5.下列实验操作、现象与结论均正确的是( )
1.(江西省九江市2022届第二次高考模拟统一考试)实验室制取下列气体方法可行的是
2.(浙江省绍兴市2022届高三选考科目适应性考试)下列推理合理的是
A.NaCl固体与浓H2SO4 加热可制HCl, 则NaI固体与浓H2SO4 加热制HI
B.Na2O2 与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2
C.实验室可利用AlCl3与足量氨水反应来制备Al(OH)3,则也可利用CuCl2与足量氨水反应生成Cu(OH)2
D.Fe与S反应生成FeS,则Cu与S反应生成Cu2S
3.(重庆市天星桥中学2021-2022学年高三下学期学业质量调研)实验室中为研究不同物质之间的反应进行如下实验。下列说法正确的是
A.丙为还原产物,丁为氧化产物
B.上述有4个氧化还原反应
C.每生成标准状况下气体丙,消耗
D.若完全反应,转移个电子(为阿伏加德罗常数的值)
4.下图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
A.向溶液B中滴加KSCN溶液,溶液可能变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
5.已知2FeSO4eq \(=====,\s\up7(高温))Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是( )
A.用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B.用装置乙可检验分解产生的SO2,现象是石蕊溶液先变红后褪色
C.用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D.用装置丁可吸收尾气,避免污染环境
1.(2022·全国乙卷)某白色粉末样品,可能含有、、和。取少量样品进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加溶液有沉淀生成。
该样品中确定存在的是
A.B.
C.D.
2.(2022·广东卷)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是
A.与浓硫酸反应,只体现的酸性
B.a处变红,说明是酸性氧化物
C.b或c处褪色,均说明具有漂白性
D.试管底部出现白色固体,说明反应中无生成
3.【2018浙江高考真题】下列反应中能产生二氧化硫的是
A.氧化铜和稀硫酸反应 B.亚硫酸钠和氧气反应
C.三氧化硫和水反应 D.铜和热的浓硫酸反应
4.【2020天津高考真题】检验下列物所选用的试剂正确的是
5.【2020浙江高考真题】100%硫酸吸收可生成焦硫酸(分子式为或)。下列说法不正确的是( )
A.焦硫酸具有强氧化性
B.水溶液呈中性
C.可与碱性氧化物反应生成新盐
D.100%硫酸吸收生成焦硫酸的变化是化学变化
1.【答案】A
【解析】由题图可知,硫酸盐和亚硫酸盐等在含硫杆菌及好氧/厌氧菌作用下缓慢转化为植物中的R1SR2,促进了硫的循环,故A说法正确;硫循环中硫的化合物存在含硫有机物,故B说法错误;硫循环中硫元素既存在被氧化的过程,也存在被还原的过程,如含硫杆菌及好氧/厌氧菌将硫酸盐还原为R1SR2,故C说法错误;烧煤时加石灰石,分解产生的CaO可以吸收SO2,但分解的同时会产生温室气体CO2,故D说法错误。
2.【答案】D
【解析】SO eq \\al(\s\up11(2-),\s\d4(4)) 的检验,先用稀盐酸酸化,直到没有现象为止,排除Ag+、CO eq \\al(\s\up11(2-),\s\d4(3)) 等的干扰,再加入氯化钡溶液,看是否生成白色沉淀。直接加入稀盐酸酸化的氯化钡溶液,不能排除Ag+的干扰,A错误;先加氯化钡不能排除Ag+的干扰,B错误;加入硝酸钡,不能排除碳酸根、亚硫酸根等的干扰,C错误;加入盐酸无明显现象,排除Ag+等的干扰,再加入氯化钡有白色沉淀,说明有SO eq \\al(\s\up11(2-),\s\d4(4)) ,D正确。
3.【答案】A
【解析】T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3可视为催化剂,该脱硫过程不需要不断添加Fe2(SO4)3溶液,A错误;脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S,B正确;亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,需补充一定量的亚铁离子,C正确;天然气的主要成分为甲烷,甲烷燃烧放出热量,井火为天然气燃烧出现的火焰,故说明我国古代已利用天然气煮盐,D正确。
4.【答案】A
【解析】A项,点燃酒精喷灯前应先向装置内通一段时间N2,排除装置中的空气,避免空气中氧气的干扰,正确;B项,装置乙不能检验分解产生的SO2,产物中有SO3会对SO2的检验造成干扰,并且SO2只能使石蕊溶液变红,错误;C项,SO3易溶于水,当混合气体经过乙时,SO3会被吸收,所以要想检验SO3,应该把乙和丙的位置互换,错误;D项,装置丁中应该用饱和Na2SO3溶液,错误。
5.【答案】C
【解析】向酸性KMnO4溶液中通入SO2,紫红色褪去,体现SO2的还原性,故A错误;酸性:H2S
【详解】
A.硝酸具有强氧化性,与铁反应生成一氧化氮,无法生成氢气,故A错误;
B.亚硫酸钠固体与70%硫酸反应有利于较快的制备二氧化氯,且有利于二氧化硫逸出,故B正确;
C.硫化铜不能与稀硫酸反应,无法制备硫化氢气体,故C错误;
D.碳酸钙与稀硫酸反应生成的硫酸钙附着在碳酸钙表面阻碍反应的继续进行,不能制得二氧化碳气体,故D错误;
故选B。
2.【答案】D
【详解】
A.浓硫酸具有强氧化性,能够将NaI氧化为I2,不能用NaI固体与浓H2SO4加热制HI,故A错误;
B. Na2O2与SO2反应生成Na2SO4,故B错误;
C.Cu(OH)2溶于过量氨水,因此不能利用CuCl2与足量氨水反应生成Cu(OH)2,故C错误;
D.硫的氧化性较弱,只能将金属氧化到较低价态,因此Fe与S反应生成FeS,Cu与S反应生成Cu2S,故D正确;
答案选D。
3.【答案】D
【分析】
该过程发生下列四个反应:、、、;
【详解】
A.高锰酸钾与双氧水反应生成氧气,H2O2中-1价的O原子失去电子发生氧化反应生成氧气,氧气为氧化产物,故A错误;
B.根据分析可知四个反应中不是氧化还原反应,故B错误;
C.,由反应可知,故C错误;
D.有反应可知,若完全反应,转移,即转移个电子,故D正确;
故答案为D
4.【答案】 A
【解析】SO2与Fe3+发生氧化还原反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不变红色;若二氧化硫不足,则溶液中有Fe3+,加入KSCN溶液,溶液变红色,A正确;离子方程式中电荷不守恒,B错误;溶液A转化为溶液B后溶液酸性增强,C错误;FeO与H+反应生成Fe2+,故溶液C不能转化为溶液A,D错误。
5.【答案】 A
【解析】A项,点燃酒精喷灯前应先向装置内通一段时间N2,排除装置中的空气,避免空气中氧气的干扰,正确;B项,装置乙不能检验分解产生的SO2,产物中的SO3会对SO2的检验造成干扰,并且SO2只能使石蕊溶液变红,错误;C项,SO3易溶于水,当混合气体经过乙时,SO3会被吸收,所以要想检验SO3,应该把乙和丙的位置互换,错误;D项,装置丁中应该用饱和Na2SO3溶液,错误。
1.【答案】A
【解析】由题意可知,①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能共存,②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应S2O+2H+=S↓+H2O+SO2↑,离心分离,③取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象覆盖掉,综上分析,该样品中确定存在的是:Na2SO4、Na2S2O3,
答案选A。
2.【答案】B
【解析】A.铜和浓硫酸反应过程中,生成CuSO4体现出浓硫酸的酸性,生成SO2体现出浓硫酸的强氧化性,故A错误;
B.a处的紫色石蕊溶液变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,故B正确;
C.b处品红溶液褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾溶液褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现出还原性,故C错误;
D.实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水CuSO4,而非蓝色的CuSO4·5H2O,其原因是浓硫酸体现出吸水性,将反应生成的H2O吸收,故D错误;
综上所述,正确的是B项。
3.【答案】D
【解析】A.生成物为硫酸铜和水,不产生二氧化硫,故不选A;B.亚硫酸钠和氧气反应生成硫酸钠,该反应不产生二氧化硫,故不选B;C.三氧化硫和水反应生成硫酸,反应中无法产生二氧化硫,故不选C;D.Cu与浓硫酸反应生成二氧化硫、水和硫酸铜,故选D。综上所述,本题正确选项为D。
4.【答案】C
【解析】A.淀粉溶液可以检验碘单质,不能检验碘元素,错误;B.能使澄清石灰水变浑浊的气体可以是二氧化硫或二氧化碳,应该用品红检验二氧化硫气体,错误;C.铜离子遇到氨水会先产生氢氧化铜蓝色沉淀,继续加氨水会生成四氨合铜离子,检验铜离子可以用氨水,正确;D.铵根离子遇氢氧化钠溶液(加热)生成氨气,氨气能使湿润的红色石蕊试纸变蓝,不能使用湿润的蓝色石蕊试纸检验氨气,错误;答案选C。
5.【答案】B
【解析】A.浓硫酸中+6价的硫元素具有强氧化性,可知焦硫酸具有强氧化性,正确;B.溶于水生成硫酸氢钠,溶液呈酸性,错误;C.可与碱性氧化物反应生成新盐,例如,正确;D.焦硫酸和三氧化硫、硫酸是不同物质,所以该变化为化学变化,正确;故答案为B。
硫铁矿
黄铜矿
石膏
芒硝
FeS2
CuFeS2
CaSO4·2H2O
Na2SO4·10H2O
颜色状态
溶解性
黄色晶体
不溶于水,微溶于酒精,易溶于CS2
颜色
气味
毒性
密度
溶解性
无色
有刺激性气味
eq \a\vs4\al(有) 毒
比空气 eq \a\vs4\al(大)
易溶于水
类型
原理
举例
特点
备注
氧化型
将有机色质内部“生色团”破坏掉
HClO、NaClO、Ca(ClO)2、
Na2O2、H2O2、O3等
不可逆、
持久
无选
择性
加合型
与有机色质内部“生色团”“化合”成无色物质
SO2
可逆、
不持久
有选
择性
吸附型
将有色物质吸附而褪色
活性炭
物理
变化
吸附
色素
误区1
只加可溶性钡盐、而不先加盐酸酸化
导致将CO eq \\al(\s\up11(2-),\s\d4(3)) 、SO eq \\al(\s\up11(2-),\s\d4(3)) 等干扰离子判断成SO eq \\al(\s\up11(2-),\s\d4(4)) 。因上述离子会产生BaCO3、BaSO3白色沉淀
误区2
误将Ag+判断成SO eq \\al(\s\up11(2-),\s\d4(4))
如向待测液中滴加BaCl2溶液,再加稀盐酸有白色沉淀便断定含SO eq \\al(\s\up11(2-),\s\d4(4)) 。其错误是未注意溶液中不含SO eq \\al(\s\up11(2-),\s\d4(4)) ,而含Ag+时也会产生同样的现象:Ag++Cl-===AgCl↓(白色)
误区3
误将SO eq \\al(\s\up11(2-),\s\d4(3))
判断成SO eq \\al(\s\up11(2-),\s\d4(4))
如先用稀硝酸酸化,再加入BaCl2溶液或向待测液中滴加用稀盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO eq \\al(\s\up11(2-),\s\d4(4)) 。该错误是未注意NO eq \\al(\s\up11(-),\s\d4(3)) 在酸性环境中具有强氧化性,将SO eq \\al(\s\up11(2-),\s\d4(3)) 氧化成SO eq \\al(\s\up11(2-),\s\d4(4)) 而产生干扰
化学式
俗名
颜色
主要性质
用途
2CaSO4·H2O
熟石膏
白色
2CaSO4·H2O+3H2O===2(CaSO4·2H2O)
塑像、模型、粉笔、医疗绷带等
CaSO4·2H2O
生石膏
白色
2(CaSO4·2H2O) eq \(=====,\s\up7(△)) 3H2O+2CaSO4·H2O
水泥添加剂
FeSO4·7H2O
绿矾
浅绿色
暴露在空气中被氧化为三价铁盐
用于配制蓝黑墨水,补血剂
CuSO4·5H2O
胆矾、蓝矾
蓝色
CuSO4·5H2O eq \(=====,\s\up7(△)) 5H2O+CuSO4(白)
配制波尔多液,镀铜液
Na2SO4·10H2O
芒硝
白色
—
造纸,制缓泻剂、合成洗涤剂
KAl(SO4)2·12H2O
明矾
白色
—
净水剂
编号
实验操作
实验现象
实验结论
A
向酸性KMnO4溶液中通入SO2
紫红色褪去
SO2具有漂白性
B
向CuSO4溶液中通入H2S
出现黑色沉淀
酸性:H2S>
H2SO4
C
向碘水溶液中加入CCl4,振荡
上层褪色,下层变紫
碘在CCl4中的溶解度大于它在水中的溶解度
D
向装有蔗糖的烧杯中加入浓 H2SO4
出现“黑面包”现象
浓H2SO4具有吸水性
选项
气体
方法
A
氢气
向铁粉中滴加稀硝酸
B
二氧化硫
向亚硫酸钠固体中滴加70%硫酸
C
硫化氢
向硫化铜中滴加稀硫酸
D
二氧化碳
向块状碳酸钙固体中滴加稀硫酸
待检验物质
所用试剂
A
海水中的碘元素
淀粉溶液
B
SO2气体
澄清石灰水
C
溶液中的Cu2+
氨水
D
溶液中的
NaOH溶液,湿润的蓝色石蕊试纸
新高考化学一轮复习考点过关练考向12 氮及其化合物(含解析): 这是一份新高考化学一轮复习考点过关练考向12 氮及其化合物(含解析),共18页。
新高考化学一轮复习考点过关练考向10 氯及其化合物(含解析): 这是一份新高考化学一轮复习考点过关练考向10 氯及其化合物(含解析),共17页。
新高考化学一轮复习考点过关练考向09 金属及其化合物的简单制备流程(含解析): 这是一份新高考化学一轮复习考点过关练考向09 金属及其化合物的简单制备流程(含解析),共17页。












