

还剩11页未读,
继续阅读
所属成套资源:新高考化学一轮复习考点过关练 (含解析)
成套系列资料,整套一键下载
新高考化学一轮复习考点过关练考向06 钠及其化合物(含解析)
展开这是一份新高考化学一轮复习考点过关练考向06 钠及其化合物(含解析),共14页。
【2022浙江1月】下列实验对应的离子方程式不正确的是
A.将碳酸氢钙溶液与过量的澄清石灰水混合: +Ca2++OH-=CaCO3↓+H2O
B.将少量NO2通入NaOH溶液:2NO2+2OH-= + +H2O
C.将少量SO2通入NaClO溶液:SO2+H2O+2ClO-= +2HClO
D.向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O= +2H2O
【答案】C
【详解】A. 将碳酸氢钙溶液与过量的澄清石灰水混合,反应生成碳酸钙和水,反应的离子方程式为: +Ca2++OH-=CaCO3↓+H2O,选项A正确;B. 将少量NO2通入NaOH溶液,反应生成硝酸钠、亚硝酸钠和水,反应的离子方程式为:2NO2+2OH-= + +H2O,选项B正确;C. 将少量SO2通入NaClO溶液,反应生成硫酸钠和盐酸,反应的离子方程式为:SO2+H2O+2ClO-= +HClO+H++Cl-,选项C不正确;D. 向氨水中滴入少量硝酸银溶液,反应生成氢氧化二氨合银,反应的离子方程式为:Ag++2NH3·H2O= +2H2O,选项D正确;答案选C。
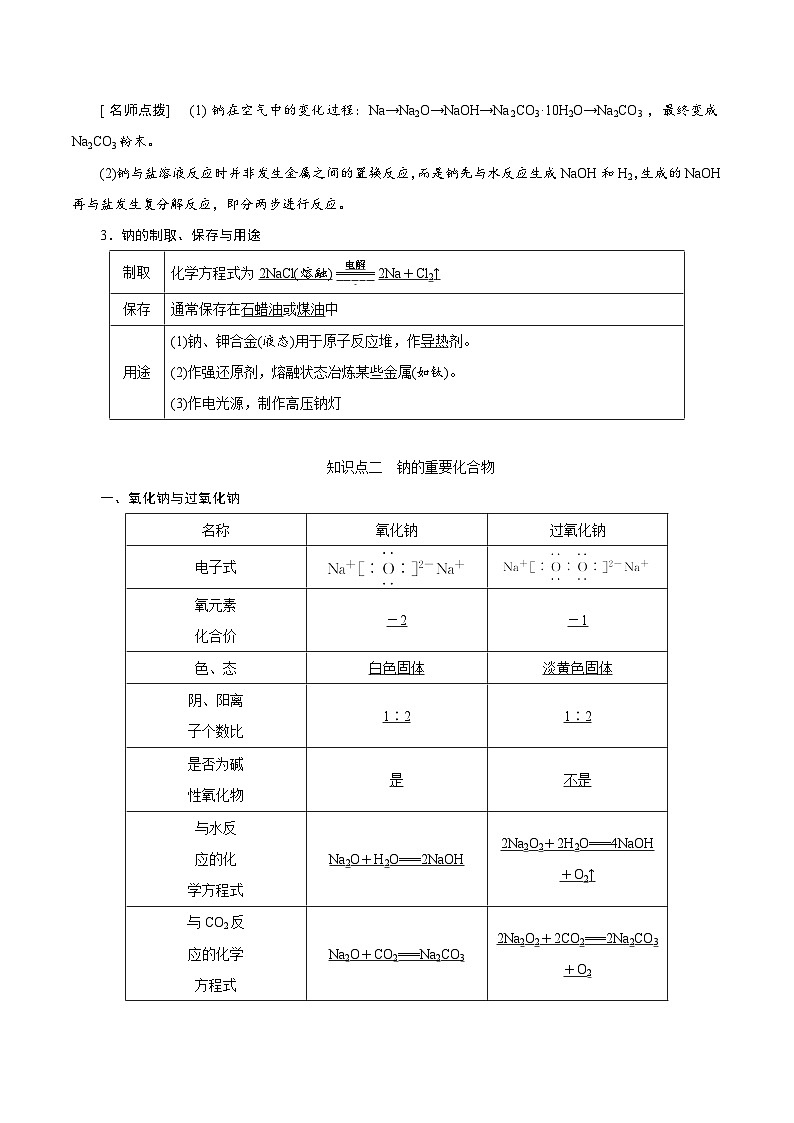
知识点一 钠的性质及应用
1.钠的物理性质
(1)颜色:银白色,具有金属光泽。
(2)密度:ρ(H2O)>ρ(Na)>ρ(煤油)
(3)熔点:低于100 ℃。
(4)硬度:质地柔软,可以用小刀切割。
(5)传导性:可导电导热。
2.从钠的原子结构认识钠的化学性质——强还原性
Na eq \a\vs4\al() eq \(―――――――――→,\s\up7(O2、Cl2、H2O、H+等),\s\d5(失去1e-)) Na+ eq \a\vs4\al()
(1)与非金属单质(如O2、Cl2)反应
与O2反应 eq \b\lc\{(\a\vs4\al\c1(常温下,化学方程式为4Na+O2===2Na2O,,加热时,化学方程式为2Na+O2\(=====,\s\up7(△))Na2O2。))
(2)与水反应
①化学方程式:2Na+2H2O===2NaOH+H2↑。
②与滴加酚酞的水反应的现象与解释
(3)与酸(如盐酸)反应
离子方程式:2Na+2H+===2Na++H2↑,钠与酸的反应比钠与水的反应更剧烈。
(4)与盐(如CuSO4)溶液的反应
离子方程式:2Na+2H2O===2Na++2OH-+H2↑,
Cu2++2OH-===_Cu(OH)2↓_。
总反应的离子方程式:2Na+Cu2++2H2O===Cu(OH)2↓+H2↑+2Na+。
(5)与乙醇反应:2Na+2C2H5OH―→2C2H5ONa+H2↑。
[名师点拨] (1)钠在空气中的变化过程:Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,最终变成Na2CO3粉末。
(2)钠与盐溶液反应时并非发生金属之间的置换反应,而是钠先与水反应生成NaOH和H2,生成的NaOH再与盐发生复分解反应,即分两步进行反应。
3.钠的制取、保存与用途
知识点二 钠的重要化合物
一、氧化钠与过氧化钠
[名师点拨] (1)氧化钠、过氧化钠都属于氧化物,氧化钠是碱性氧化物,而过氧化钠不是。
(2)Na2O2具有强氧化性,但Na2O2与水、CO2反应时,水中的氢与CO2中的碳都处于最高价态,不能被氧化,故反应为Na2O2自身的氧化还原反应。
二、碳酸钠和碳酸氢钠
1.碳酸钠和碳酸氢钠的重要性质
2.碳酸钠和碳酸氢钠的转化关系
Na2CO3 eq \(,\s\up7(①CO2+H2O;②适量H+),\s\d5(①固体,加热;②适量OH-)) NaHCO3。
3.碳酸钠和碳酸氢钠的鉴别与除杂
(1)Na2CO3、NaHCO3的鉴别方法
(2)Na2CO3、NaHCO3的除杂
知识点三 碱金属 焰色反应
1.碱金属的一般性与特殊性
(1)一般性
(2)特殊性
①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
2.焰色反应
(1)概念:很多金属或它们的化合物在灼烧时火焰呈现特殊颜色的现象。
(2)操作步骤
铂丝 eq \(――→,\s\up7(酒精灯),\s\d5(灼烧)) 无色待测物 eq \(――→,\s\up7(酒精灯),\s\d5(灼烧)) 观察火焰颜色 eq \(――→,\s\up7(用盐酸),\s\d5(洗涤)) 铂丝 eq \(――→,\s\up7(酒精灯),\s\d5(灼烧)) 无色。
(3)常见元素的焰色
钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃观察)。
[名师点拨] 铂丝在使用前要用盐酸将其表面物质洗净,而不用稀H2SO4洗涤,其原因是金属氯化物在灼烧时易挥发,若用稀H2SO4洗涤铂丝,由于硫酸盐的熔、沸点较高而难以挥发,会对后续实验造成干扰。
1. 下列关于钠的说法中错误的是( )
A. 金属钠和氧气反应,条件不同,产物则不同
B. 若钠着火,可以用沙子灭火
C. 钠的化学性质比较活泼,少量的钠可以保存在煤油中
D. 做完实验多余的钠,不能放回原来的试剂瓶
2.钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是( )
A. 钠的密度比液氨大
B. 溶液的导电性增强
C. 0.1 ml钠投入液氨生成0.01 ml H2时,Na共失去0.02 ml 电子
D. 钠和液氨可发生以下反应:
2NH3+2Na===2NaNH2+H2↑
3. 钠及其化合物与生活密切相关,下列说法错误的是( )
A. 碳酸氢钠常用于治疗胃酸过多
B. 热的纯碱溶液可去除油污
C. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D. 相同温度下NaHCO3的溶解度大于Na2CO3的溶解度
4. 为除去括号内的杂质,下列各选项中所选用的试剂或方法错误的是( )
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在空气中加热
D. Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
5. 下列装置能达到实验目的的是( )
1.(福建省龙岩第一中学2022届高三下学期第一次模拟考试)焦亚硫酸钠(Na2S2O5)在印染、电镀、酿造等工业生产中广泛应用,其制备流程如图所示。已知:NaHSO3过饱和溶液经结晶脱水得到Na2S2O5,下列说法正确的是
A.反应I制备Na2CO3,反应时先通入氨气,再通入CO2
B.气体a为SO2,反应Ⅲ为
C.调pH=7~8,并再次通入气体a的目的是得到NaHSO3过饱和溶液
D.结晶后的脱水反应为氧化还原反应
2.(甘肃省2022届高三第二次高考诊断考试(二模))下列过程中的化学反应,相应的离子方程式书写不正确的是
A.向稀盐酸中加入少量钠粒:2Na+2H2O=Na++2OH-+H2↑
B.硫酸酸化的淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:+2H+=2SO2↑+S↓+H2O
D.向含氯化铁的氧化镁溶液中加入氧化镁:2Fe3++3MgO+3H2O=2Fe(OH)3↓+3Mg2+
3.(2021·长春模拟)下列有关物质的实验操作、现象及结论描述正确的是( )
4.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
A.过氧化钠 B.钠
C.氧化钠 D.钾
5.(2021·佳木斯模拟)以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列说法不正确的是( )
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
1.(2022·浙江卷)关于反应,下列说法正确的是
A.发生还原反应
B.既是氧化剂又是还原剂
C.氧化产物与还原产物的物质的量之比为2∶1
D.发生反应,转移电子
2.(2022·全国乙卷)某白色粉末样品,可能含有、、和。取少量样品进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加溶液有沉淀生成。
该样品中确定存在的是
A.B.
C.D.
3.(2020江苏卷)下列有关化学反应的叙述正确的是
A.室温下,Na在空气中反应生成Na2O2
B.室温下,Al与4.0 ml﹒L-1NaOH溶液反应生成NaAlO2
C.室温下,Cu与浓HNO3反应放出NO气体
D.室温下,Fe与浓H2SO4反应生成FeSO4
4.(2020天津卷)在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是
A.NaOHB.NaClC.NaClOD.Na2CO3
5.(2020年7月浙江选考)下列说法不正确的是( )
A.Cl-会破坏铝表面的氧化膜
B.NaHCO3的热稳定性比Na2CO3强
C.KMnO4具有氧化性,其稀溶液可用于消毒
D.钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
1. 【答案】D
【解析】 常温下钠与氧气反应:4Na+O2===2Na2O,加热条件下与氧气反应2Na+O2eq \(=====,\s\up7(△))Na2O2,条件不同,产物不同,A正确;钠性质活泼,与水能够剧烈反应生成氢氧化钠和氢气,所以钠着火时可用沙土盖灭,不能用水灭火,B正确;钠的密度比煤油大,且与煤油不反应,少量的钠可保存在煤油中,C正确;因钠活泼,易与水、氧气反应,如在实验室随意丢弃,可引起火灾,因此剩余的钠粒需要放回原试剂瓶中,D错误。
2. 【答案】C
【解析】 钠沉入液氨说明钠的密度比液氨大,A正确;液氨中没有能导电的离子,而钠投入液氨中生成蓝色的溶剂合电子,能导电,说明溶液的导电性增强,B正确;0.1 ml钠反应失去0.1 ml电子,C错误;反应中钠失去电子,只能是氢元素得到电子,所以钠和液氨可发生以下反应:2NH3+2Na===2NaNH2+H2↑,D正确。
3. 【答案】D
【解析】 相同温度下碳酸氢钠的溶解度小于碳酸钠的溶解度,D错误。
4. 【答案】 D
【解析】 Na2CO3溶液中含Na2SO4,加Ba(OH)2溶液,Na2CO3、Na2SO4都产生沉淀,无法分离。
5. 【答案】 C
【解析】 瓷坩埚中含SiO2,高温下SiO2可与Na2CO3发生反应,A错误;加热固体时试管口应略朝下,B错误;NH3的密度小于空气,应该用向下排空气法收集,D错误。
1. 【答案】C
【分析】
饱和NaCl溶液中通入NH3和CO2,生成NaHCO3沉淀和NH4Cl溶液;过滤出沉淀,加热,溶于水得到Na2CO3饱和溶液;通入气体a(SO2),调节pH=4.1,得到Na2SO3溶液,加入Na2CO3调节pH=7~8,此时NaHSO3转化为Na2SO3,再通入SO2,并使pH=4.1,则生成NaHSO3过饱和溶液,结晶脱水得Na2S2O5。
【详解】
A.反应I、Ⅱ是通过侯氏制碱法制备碳酸钠,反应I制备NaHCO3的化学方程式为,反应时先通入氨气,再通入CO2,反应Ⅱ为NaHCO3加热分解生成Na2CO3,选项A错误;
B.根据已知信息可知,反应Ⅲ是为了制备NaHSO3,发生反应:,选项B错误;
C.由于得到的NaHSO3不是过饱和溶液,后加碳酸钠固体、并再次充入SO2的目的,得到NaHSO3过饱和溶液,结晶得NaHSO3晶体,选项C正确;
D.由流程图可知,NaHSO3失水得到Na2S2O5,反应的化学方程式为,该反应中各元素化合价不变,为非氧化还原反应,选项D正确;
答案选C。
2.【答案】A
【详解】
A.向稀盐酸中加入少量钠粒,钠和HCl电离的氢离子反应,2Na+2H+=2Na++H2↑,A错误;
B.硫酸酸化的碘化钾淀粉溶液久置后变蓝是因为碘离子被空气中的氧气氧化为碘单质,B正确;
C.硫代硫酸钠在酸性条件下发生反应生成二氧化硫、硫单质和水,该离子方程式正确,C正确;
D.向含氯化铁的氯化镁溶液中加入氧化镁,氧化镁消耗Fe3+水解产生的氢离子,使Fe3+的水解平衡正向移动生成Fe(OH)3沉淀,该离子方程式正确,D正确;
答案选A。
3.【答案】A
【解析】
火焰呈紫色(透过蓝色钴玻璃),说明待测试液中一定含有钾元素,由于蓝色钴玻璃能滤去黄色光,所以可能含钠元素,故A正确;白色沉淀可能是硅酸、氢氧化铝等,该溶液中可能含有SiO eq \\al(\s\up1(2-),\s\d1(3)) 、AlO eq \\al(\s\up1(-),\s\d1(2)) ,故B错误;使品红溶液褪色的气体可能是臭氧、氯气、二氧化硫等,故C错误;NaOH溶液过量,可与氯化镁、氯化铁反应,均有沉淀生成,而不是沉淀的转化,则不能说明Fe(OH)3的溶解度小于Mg(OH)2的溶解度,故D错误。
4. 【答案】C
【解析】
过氧化钠溶于水放出热量并生成氧气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故A错误;钠加入水中放热并生成氢气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故B错误;氧化钠与水反应放出热量,使容器内温度升高,压强增大,U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,故C正确;钾加入水中放热并生成氢气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故D错误。
5. 【答案】C
【解析】
装置②中试剂可以是NaOH溶液,用来除掉二氧化碳气体,故A正确;装置③中盛有浓硫酸,作用是干燥O2,故B正确;由于氧气密度大于空气,应选择装置b,故C错误;装置②、③之间应增加盛澄清石灰水的洗气瓶,验证二氧化碳是否除尽,故D正确。
1. 【答案】B
【解析】Na2S2O3+H2SO4=Na2SO4+S ↓+SO2↑ +H2O,该反应的本质是硫代硫酸根离子在酸性条件下发上歧化反应生成硫和二氧化硫,化合价发生变化的只有S元素一种,硫酸的作用是提供酸性环境。
A.H2SO4转化为硫酸钠和水,其中所含元素的化合价均未发生变化,故其没有发生还原反应,A说法不正确;
B.Na2S2O3中的S的化合价为+2,其发生歧化反应生成S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,B说法正确;
C.该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的物质的量之比为1:1,C说法不正确;
D.根据其中S元素的化合价变化情况可知,1ml Na2S2O3发生反应,要转移2 ml电子,D说法不正确。
综上所述,本题选B。
2. 【答案】A
【解析】由题意可知,①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能共存,②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应S2O+2H+=S↓+H2O+SO2↑,离心分离,③取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象覆盖掉,综上分析,该样品中确定存在的是:Na2SO4、Na2S2O3,
答案选A。
3.【答案】B
【解析】A.室温下,钠与空气中氧气反应生成氧化钠,故A错误;
B.室温下,铝与NaOH溶液反应生成偏铝酸钠和氢气,故B正确;
C.室温下,铜与浓硝酸反应生成二氧化氮气体,故C错误;
D.室温下,铁在浓硫酸中发生钝化,故D错误。
综上所述,答案为B。
4.【答案】C
【解析】工业上用Cl2与NaOH溶液反应制取“84消毒液”,反应原理为Cl2+2NaOH=NaCl+NaClO+H2O,NaClO具有强氧化性,能用于杀菌消毒,故“84消毒液”的主要有效成分是NaClO,答案选C。
5.【答案】B
【解析】A.Cl-很容易被吸附在铝表面的氧化膜上,将氧化膜中的氧离子取代出来,从而破坏氧化膜,A选项正确;
B.碳酸氢钠受热分解可产生碳酸钠、水和二氧化碳,则稳定性:NaHCO3<Na2CO3,B选项错误;
C.KMnO4具有强氧化性,可使病毒表面的蛋白质外壳变形,其稀溶液可用于消毒,C选项正确;
D.钢铁在潮湿的空气中,铁和碳、水膜形成原电池,发生电化学腐蚀,腐蚀速率更快,D选项正确;
答案选B。
制取
化学方程式为2NaCl(熔融) eq \(=====,\s\up7(电解)) 2Na+Cl2↑
保存
通常保存在石蜡油或煤油中
用途
(1)钠、钾合金(液态)用于原子反应堆,作导热剂。
(2)作强还原剂,熔融状态冶炼某些金属(如钛)。
(3)作电光源,制作高压钠灯
名称
氧化钠
过氧化钠
电子式
氧元素
化合价
-2
-1
色、态
白色固体
淡黄色固体
阴、阳离
子个数比
1∶2
1∶2
是否为碱
性氧化物
是
不是
与水反
应的化
学方程式
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
与CO2反
应的化学
方程式
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
与盐酸反
应的化学
方程式
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
混合物(括号内为杂质)
除杂方法
Na2CO3(s)(NaHCO3)
加热法
NaHCO3(aq)(Na2CO3)
通入足量CO2
Na2CO3(aq)(NaHCO3)
滴加适量NaOH溶液
相似性
递变性(由Li→Cs)
原子结构
最外层均为1个电子
电子层数逐渐增多
核电荷数逐渐增大
原子半径逐渐增大
元素性质
都具有较强的金属性,最高正价均为+1价
金属性逐渐增强
单质
性质
物理
性质
(除Cs外)都呈银白色,密度较小,熔、沸点较低
密度逐渐增大(钾反常),熔、沸点逐渐降低
化学
性质
都具有较强的还原性
还原性逐渐增强;与O2反应越来越剧烈,产物越来越复杂
A
B
C
D
熔化Na2CO3
加热分解NaHCO3固体
加热比较热稳定性
制备干燥氨气
选项
实验操作及现象
结论
A
用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃)
待测试液中一定含有钾元素,可能含钠元素
B
向某无色溶液中通入过量的CO2气体,有白色沉淀产生
该溶液中一定含有SiO eq \\al(\s\up1(2-),\s\d1(3))
C
向品红溶液中通入某气体后,溶液褪色
该气体一定是SO2
D
向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液,产生红褐色沉淀
Fe(OH)3的溶解度小于Mg(OH)2的溶解度
相关试卷
新高考化学一轮复习考点过关练考向16 化学键(含解析):
这是一份新高考化学一轮复习考点过关练考向16 化学键(含解析),共15页。
新高考化学一轮复习考点过关练考向11 硫及其化合物(含解析):
这是一份新高考化学一轮复习考点过关练考向11 硫及其化合物(含解析),共19页。
新高考化学一轮复习考点过关练考向10 氯及其化合物(含解析):
这是一份新高考化学一轮复习考点过关练考向10 氯及其化合物(含解析),共17页。












