

压轴题10晶体结构及相关计算(5大题型方法总结压轴题速练)-2025年高考化学压轴题专项训练(
展开一、晶胞参数的有关计算
1.金属晶胞中原子空间利用率的计算
(1)空间利用率=×100%,球体积为金属原子的总体积。
(2)四种类型
①简单立方堆积
如图所示,原子的半径为r,立方体的棱长为2r,则V球=πr3,V晶胞=(2r)3=8r3,空间利用率=×100%=×100%≈52%。
②体心立方堆积
如图所示,原子的半径为r,体对角线c为4r,面对角线b为a,由(4r)2=a2+b2得a=r。1个晶胞中有2个原子,故空间利用率=×100%=×100%=×100%≈68%。
③六方最密堆积
如图所示,原子的半径为r,底面为菱形(棱长为2r,其中一个角为60°),则底面面积S=2r×r=2r2,h=r,V晶胞=S×2h=2r2×2×r=8r3,1个晶胞中有2个原子,则空间利用率=×100%=×100%≈74%。
④面心立方最密堆积
如图所示,原子的半径为r,面对角线为4r,a=2r,V晶胞=a3=(2r)3=16r3,1个晶胞中有4个原子,则空间利用率=×100%=×100%≈74%。
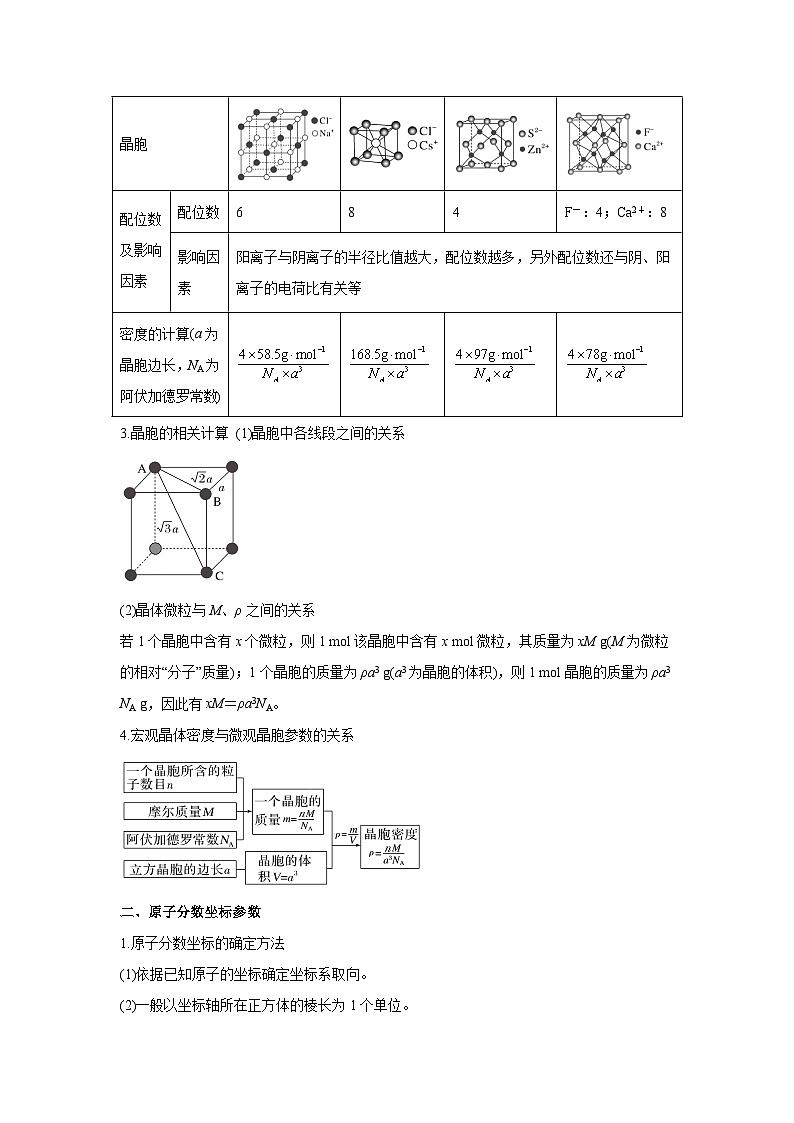
2.常见离子晶体结构分析
3.晶胞的相关计算 (1)晶胞中各线段之间的关系
(2)晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 ml该晶胞中含有x ml微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 ml晶胞的质量为ρa3 NA g,因此有xM=ρa3NA。
4.宏观晶体密度与微观晶胞参数的关系
二、原子分数坐标参数
1.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
2.代表晶体
通常确定原子坐标参数的晶体主要有铜型(面心立方最密堆积)和镁型(六方最密堆积)两种晶体类型。
三、晶胞结构的投影图
(1)判断投影图时,一定要注意x、y、z轴的方向。
(2)上面结构模型中的原子也可以换为不同的原子,但在投影图中的位置不变。
01 考查晶胞化学式
(2024·湖南邵阳·一模)
1.某富锂超离子导体的晶胞是立方体(图1)。进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法正确的是
A.基态溴原子的核外电子排布式为
B.图1晶体中O周围最近的Cl数目为4
C.图1晶体的化学式为
D.图2表示的化学式为
02 考查晶体密度
(2024·湖南邵阳·二模)
2.采用氮化镓元件的充电器体积小、质量轻,在发热量、效率转换上相比普通充电器也有更大的优势,被称为“快充黑科技”,下图是氮化镓的一种晶体结构(NA表示阿伏加德罗常数的值)。下列有关说法错误的是
A.晶体结构中Ga原子的配位数为8
B.一个该晶胞结构中含有4个Ga、4个N
C.Ga元素位于元素周期表中第四周期第ⅢA族
D.晶体结构中若Ga和N的距离为x nm,则晶体的密度为
03 考查原子分数坐标参数
(2024·辽宁葫芦岛·一模)
3.一种由Cu、In、Te组成的晶体如图,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。已知:A点、B点原子的分数坐标分别为(0,0,0)、(,,),下列叙述不正确的是
A.In原子的配位数为2
B.该晶体的化学式为CuInTe2
C.C点原子的分数坐标为()
D.该晶体的密度为
04 考查晶胞结构的投影图
(2024·辽宁沈阳·模拟预测)
4.下列有关物质结构的说法正确的是
A.图①中18-冠-6通过离子键与K+作用,体现了超分子“分子识别”的特征
B.图②物质相较NaBF4摩尔质量更大,具有更高的熔沸点
C.图③晶体磷化硼晶胞沿轴方向上的投影图为
D.图③晶胞参数为,则晶体的密度为g/cm3
05 考查晶胞空间利用率
(2024·北京东城·模拟预测)
5.钠元素和硒元素可组成一种对蛋白质的合成和糖代谢有保护作用的无机化合物,其晶胞结构如图所示。已知和的半径分别为anm和bnm,晶胞参数为cnm。下列有关说法错误的是
A.该晶体的化学式为
B.与距离最近且相等的数目为8
C.该晶胞的空间利用率为
D.位于由构成的四面体空隙中,位于由构成的六面体空隙中
(2024·河北唐山·一模)
6.2022年诺贝尔化学奖授予了三位研究点击化学的科学家。Cu+催化的叠氮化物-炔烃环加成和催化剂CuCl的晶体结构如图所示。下列说法正确的是
A.晶胞结构中,Cu+的配位数为8
B.基态Cu的价层电子排布式为3d94s2
C.叠氮化物-炔烃环加成反应只有σ键的断裂与形成
D.若晶体的密度为dg/cm3,则晶胞参数
(2024·河北·模拟预测)
7.钒(V)被誉为“金属维生素”,V2O5是接触法制备硫酸的催化剂。V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),也可以得到偏钒酸钠,偏钒酸钠阴离子呈现如图甲所示的无限链状结构。晶胞参数为a pm的钒晶胞如图乙所示。已知:原子空间利用率等于原子体积与晶胞体积之比。下列说法错误的是
A.钒酸钠阴离子的空间结构为正四面体形
B.偏钒酸钠的化学式为(NaVO3)n或NaVO3
C.钒晶胞中钒原子半径为a pm
D.钒晶胞中原子空间利用率为π
(2024·湖北·一模)
8.一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示(晶胞边长为apm,晶胞高为cpm,为阿伏加德罗常数的值)。
下列说法正确的是
A.该物质的化学式为B.硼原子间最近距离为
C.的配位数为12D.该物质的摩尔体积为
(2024·安徽滁州·一模)
9.钙钛矿电池是第三代非硅薄膜太阳能电池的代表,具有较高的能量转化效率.如图是一种边长为的钙钛矿的正方体晶胞结构,其中Ca原子占据正方体中心,O原子位于每条棱的中点.下列有关说法错误的是
A.的核外电子排布式为:
B.两个O原子最近距离为
C.距离原子3最近的原子有4个
D.该晶胞密度约为
(2024·山东聊城·一模)
10.科学工作者发现了一种光解水的催化剂,其晶胞结构如图所示,已知晶胞参数为a pm,设为阿伏加德罗常数的值。下列说法中错误的是
A.O位于由Ce构成的四面体空隙中
B.Ce在晶胞中的配位数为8
C.Ce与Ce最近的距离为
D.该晶体的摩尔体积
(2024·湖南岳阳·二模)
11.一种超导材料(仅由、、F三种元素组成)的长方体晶胞结构如图所示(已知),下列说法错误的是
A.基态位于元素周期表的区
B.若N点原子分数坐标为,则P点原子分数坐标为
C.M、N之间的距离为
D.该晶体最简化学式为
(2024·湖南益阳·三模)
12.立方氮化硼晶体的晶胞如图1所示,图2是该晶胞的俯视投影图,阿伏加德罗常数的值为。下列说法错误的是
A.该晶体的化学式为B.晶体中既存在极性键,又存在非极性键
C.图2中表示硼原子相对位置的是3D.该晶体密度表达式为
(2024·吉林·三模)
13.由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:
下列说法错误的是
A.晶体中Li、Al、Si三种微粒的比例为1:1:1
B.图中所指Si原子的坐标为(,,)
C.晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个
D.晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构
(2024·安徽安庆·二模)
14.北京冬奥会使用的碲化镉(CdTe)太阳能电池,能量转化效率较高。立方晶系CdTe的晶胞结构如图甲所示,其晶胞参数为apm。下列说法正确的是
A.Cd的配位数为4B.相邻两个Te的核间距为
C.晶体的密度为D.若按图乙虚线方向切甲,可得到图丙
(2024·湖南长沙·二模)
15.汞及其化合物在我国应用的历史久远,可用作医药、颜料等。两种含汞化合物的晶胞结构如图所示,其中甲为四方晶胞结构,乙为立方晶胞结构。下列说法正确的是
A.甲和乙中Hg2+的配位数相同
B.甲的化学式为(NH4)2HgCl4
C.乙中相邻的两个S2-之间的距离为anm
D.每个甲、乙晶胞中含有的阴离子数目相等
(2024·吉林延边·一模)
16.叠氮化合物是重要的有机合成试剂,化学兴趣小组的同学在实验室制备了一种叠氮化合物,结构如图。下列说法正确的是
A.该晶体中每个周围距离最近且相等的共有12个
B.该叠氮化合物的密度为
C.测定该晶体结构的方法是红外光谱法
D.与相比,的熔点低于的熔点
(2024·湖南常德·一模)
17.某储氢材料(化学式:),其晶体结构属于立方晶胞,如图所示,晶胞参数为,原子位于顶点与面心,原子位于晶胞中顶点与最近距离的所形成的四面体中心。该晶胞的密度是晶胞中氢原子密度的倍,晶胞氢原子的密度为晶胞单位体积内所含氢原子的质量。已知阿伏加德罗常数为。下列说法错误的是
A.该储氢材料的化学式为B.晶胞中原子总数为24
C.原子A、B之间的间距为D.晶体的密度为
(2024·湖南·一模)
18.硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,图乙为晶胞的俯视图,已知原子分数坐标a点(0,0,0),c点(1,1,1),晶胞参数为p nm。下列说法不正确的是
A.晶胞中Zn原子的配位数为4
B.Se位于元素周期表的p区
C.晶胞中d点原子分数坐标为()
D.Zn和Se的最短距离为nm
(2024·安徽·一模)
19.一定条件下,K、CuCl2和F2反应生成KCl和化合物X,化合物 X 的晶胞结构如图所示(晶胞参数a≠c,α=β=γ=90°), 其中灰球代表 Cu、黑球代表 K、白球代表F。若阿伏加德罗常数的值为NA。下列说法错误的是
A.上述反应中 CuCl2与F2的物质的量之比为1:2
B.基态F原子核外电子有5 种空间运动状态
C.Cu原子填充在由 F原子构成的八面体空隙中
D.化合物X的密度
(2024·黑龙江·二模)
20.氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。表示阿伏加德罗常数的值。下列说法错误的是
A.的配位数为12
B.每个位于距其最近且等距的构成的正四面体空隙中
C.若位于晶胞的体心,则位于晶胞的面心
D.若晶胞参数为a nm,则晶体的密度是
(2024·河北·一模)
21.某晶体由镁、铝、氧三种元素组成,若将其晶胞按图1方式切成8个体积相同的小立方体,和在小立方体中的分布如图2、图3所示。已知之间的最小间距为。下列说法错误的是
A.晶体中的配位数为4B.晶胞的体积为
C.晶体中三种元素的第一电离能:D.晶体的化学式为
(2024·辽宁鞍山·二模)
22.科研工作者合成了低温超导化合物M,再利用低温去插层法,获得了一个新化合物N。二者的晶体结构如图所示,下列说法正确的是
A.去插层过程中Cs元素均转化为Cs单质B.N的化学式为
C.M中与Cs原子最临近的Se原子有2个D.N中V原子填充了Se原子构成的正八面体空隙
(2024·山西·二模)
23.可充电“Na-Cu2-xSe”电池具有导电率高、成本低等优点,可与锂电池相媲美。其工作原理如图所示。
已知:充、放电过程中存在如下转化,充、放电过程中晶胞内未标出因放电产生的0价Cu原子。下列说法错误的是
A.电流方向:M→用电器→N→钠离子交换膜→M
B.b为放电反应,正极反应为:
C.充电时,若两极质量变化差为46g,则电路中转移1ml电子
D.Na2Se晶胞中Se的原子坐标,若①为(0,0,0),则②为()
(2024·吉林白山·二模)
24.铜的一种氯化物立方晶胞如图所示。已知:晶体密度为,为阿伏加德罗常数的值,A、B的原子坐标分别为、。下列有关叙述正确的是
A.该化合物的化学式为
B.的原子坐标为
C.该晶胞中铜的配位数为8
D.A和B粒子之间的距离为
(2024·湖南长沙·一模)
25.下图为KCN的晶胞示意图,已知晶胞边长为,阿伏加德罗常数的值为NA.下列说法不正确的是
A.中所有原子均满足8电子稳定结构
B.晶胞中,离K+距离最近的有5个
C.每个晶胞中含有4个
D.该晶胞的密度为
命题预测
本专题命题采取结合新科技,新能源等社会热点为背景,晶体的结构与性质主要考查晶体类型判断、晶胞的计算等,侧重考查的抽象思维能力、逻辑思维能力;同时培养学生的分析和推理能力。预计2024年命题以确定晶体的化学式、求算晶体的密度或晶体晶胞的体积,考查的核心素养以宏观辨识与微观探析为主。
高频考法
(1)晶胞粒子数的确定(2)查晶体的化学式
(3)晶体类型判断及性质
(4)晶胞中粒子分数坐标
(5)晶体密度及粒子间距的计算
NaCl型
CsCl型
ZnS型
CaF2型
晶胞
配位数及影响因素
配位数
6
8
4
F-:4;Ca2+:8
影响因素
阳离子与阴离子的半径比值越大,配位数越多,另外配位数还与阴、阳离子的电荷比有关等
密度的计算(a为晶胞边长,NA为阿伏加德罗常数)
晶胞结构
x、y平面上的投影图
参考答案:
1.D
【详解】A.溴原子核外有35个电子,根据构造原理书写其基态核外电子排布式,则Br原子基态原子核外排布式为[Ar]3d104s24p5,故A错误;
B.由图可知,图1中与O原子距离最近且相等的Cl原子的个数为8,故B错误;
C.均摊法可知,图1晶体含有Li:8×+1=3,Cl:4×=1,O:2×=1,则该晶体的化学式为Li3ClO,故C错误;
D.由图可知,晶胞中含有Cl或Br:4×=1,含有O:2×=1,含有Li:1,含有Mg或空位:8×=2,所以晶胞的化学式可以为LiMgOClxBr1-x,故D正确;
故选:D。
2.A
【详解】A.以晶胞上边平面中心的Ga原子为研究对象,可知:在该晶胞中Ga与2个N原子距离相等且最近,在通过该平面上边还存在1个晶胞,其中Ga与2个N原子距离相等且最近,故Ga原子的配位数是4,A错误;
B.用均摊方法计算,在一个晶胞中含有Ga原子数目是8×+6×=4;含有的N原子数目是4×1=4,故一个该晶胞结构中含有4个Ga、4个N,B正确;
C.Ga与Al处于同一主族,位于Al的下一周期,故Ga元素位于元素周期表中第四周期第ⅢA族,C正确;
D.根据选项B分析可知:在一个该晶胞结构中含有4个Ga、4个N,结合晶体结构中若Ga和N的距离为x nm,二者的距离为晶胞体对角线的,假设晶胞边长为L,则,L=,故该晶胞的密度ρ==,D正确;
故合理选项是A。
3.A
【详解】A.根据晶胞结构图,观察上下底面的In可以看出In原子的配位数为4,故A错误;
B.由晶胞结构可知,晶胞中位于顶点、面上和体内的铜原子个数为8×+4×+1=4,位于棱上、面心和面上的铟原子个数为6×+4×=4,位于体内的碲原子个数为8,则铜、铟、碲的原子个数为4:4:8=1:1:2,晶体的化学式为CuInTe2;故B正确;
C.A点、B点原子的分数坐标分别为(0,0,0)、(,,),结合C的位置可知C的原子分数坐标为(),故C正确;
D.由B项计算可知该晶胞含有4个CuInTe2,则该晶体的密度为=g/cm3=,故D正确。
答案选A。
4.D
【详解】A.图①中18-冠-6中不含有阴离子,与K+间不能形成离子键,应为18-冠-6通过配位键与K+作用,体现了超分子“分子识别”的特征,A不正确;
B.图②物质属于离子晶体,构成阳离子的基团较NaBF4中半径更大,离子键能更弱,具有较低的熔沸点,B不正确;
C.图③晶体磷化硼晶胞中,六个面心都存在P原子,则沿轴方向上的投影图为 ,C不正确;
D.图③晶胞中,含有4个B原子,含P原子个数为,参数为,则晶体的密度为=g∙cm-3,D正确;
故选D。
5.B
【详解】A.由题图可知,该晶胞中位于顶点和面心,共有个,位于晶胞体内,共有8个,则该晶体的化学式为,A正确;
B.由题图可知,与距离最近且相等的共有12个,B错误;
C.该晶胞的空间利用率为,C正确;
D.由题给晶胞结构可知,位于由构成的四面体空隙中,位于由构成的六面体空隙中,D正确;
故选B。
6.D
【详解】A.由题干晶胞示意图可知,晶胞结构中,Cu+位于顶点和面心的Cl-形成的8个正四面体中的4个中心,故Cu+的配位数即离Cu+最近且距离相等的Cl-数目为4,A错误;
B.已知Cu是29号元素,故基态Cu的价层电子排布式为3d104s1,B错误;
C.已知单键均为σ键,双键为一个σ键和一个π键,三键为一个σ键和2个π键,根据题干反应可知,叠氮化物-炔烃环加成反应只有π键的断裂和只有σ键的形成,C错误;
D.由题干晶胞示意图可知,一个晶胞中含有4个Cu+,Cl-个数为:=4,即一个晶胞的质量为:,故若晶体的密度为dg/cm3,则晶胞参数,D正确;
故选D。
7.D
【详解】A.钒酸钠阴离子中,中心V原子的价层电子对数为=4,则发生sp3杂化,孤电子对数为=0,所以空间结构为正四面体形,A正确;
B.由链状结构可知每个V与3个O形成阴离子,且偏钒酸钠中,V显+5价,Na显+1价、O显-2价,则化学式为(NaVO3)n或NaVO3,B正确;
C.设钒晶胞中钒原子半径为r,在体对角线上,存在定量关系4r=apm,r=a pm,C正确;
D.钒晶胞中,含V原子个数为=2,原子空间利用率为=π,D错误;
故选D。
8.C
【详解】A.结合投影图可知,晶体结构中实线部分为1个晶胞, Mg个数为4×=1,有2个B位于晶胞体内,化学式为,A错误;
B.晶胞沿c轴的投影图中硼原子位于正三角形的中心,硼原子间的最近距离,应为,B错误;
C.由晶胞图可知,6个B距底面中心的Mg距离相同,底面的Mg为2个晶胞共有,即距Mg最近的B有12个,即Mg的配位数为12,故C正确;
D.该物质的摩尔体积为,D错误;
故选C。
9.D
【详解】A.基态钙原子的核外电子排布式为1s2 2s22p63s2 3p64s2基态钙离子的电子排布式为:1s2 2s22p63s2 3p6,A正确;
B.氧原子位于棱心,则距离最近的两个氧原子之间的距离为 =apm,B正确;
C.原子3是氧原子,距离原子3最近的钙原子位于晶胞的体心。共用原子3所在棱的4个晶胞的体心的钙原子距离氧原子最近,共4个,C正确;
D.该晶胞中,钙原子数为1个,氧原子数为12×=3个,碳原子数为8×=1个,晶胞密度为g·cm-3=×1030g·cm-3,D错误。
故答案选D。
10.D
【分析】据“均摊法”,晶胞中,Ce的个数为,O的个数为8,
【详解】A.根据晶胞结构可知O位于Ce构成的正四面体空隙中 ,A正确;
B.以底面面心的Ce为例,上、下层各有4个氧原子,故在晶胞中的配位数为8,B正确;
C.Ce与Ce最近的距离为Ce与Ce最近的距离为面对角线一半,为,C正确;
D.1个晶胞体积为a3×10-36m3,含有4个Ce和8个O,则该晶体的摩尔体积为 ×a3×10-36m3×NA = ,D错误;
故选D。
11.D
【详解】A.基态位于元素周期表的第IB族,是区的元素,故A正确;
B.若N点原子分数坐标为,则M点为O点,P点在x、y、z轴上的投影分别是0、0、,P点原子分数坐标为,故B正确;
C.M、N之间的距离为底面对角线长度的,为,故C正确;
D.该晶胞中F原子个数为16×+4=12,Cs原子个数为8×+2=4,Ag原子个数为4×+8×=4,所以Ag、Cs、F原子个数之比为4:4:12=1:1:3,其化学式为CsAgF3,故D错误。
答案选D。
12.B
【详解】A.由晶胞结构知,N原子数目为8×+6×=4,B原子数目为4,则立方氮化硼的化学式是BN,A正确;
B.由晶胞结构知,该晶体中只存在极性键,B错误;
C.根据原子在晶胞中的位置,可知3号原子为B原子,C正确;
D.晶胞中原子的质量为g,晶胞的体积为a3cm3,计算得到密度为g/cm3,D正确;
故答案选B。
13.D
【详解】A.该晶胞中,Li原子个数==4,Al原子个数==4,Si原子个数=4,原子个数比为1:1:1,A正确;
B.根据晶胞结构图可得,图中所指原子的坐标为,B正确;
C.根据晶胞结构图可得,晶体中与每个Al距离最近的Li为6个,与每个Si距离最近的Si为12个,C正确;
D.晶体中Al和Li构成NaCl型骨架,而CsCl型为体心结构;晶体中Al、Si构成正四面体型结构,与金刚石型的结构相同,D错误。
故选D。
14.A
【详解】A.由题干晶胞甲图所示信息可知,Cd位于8个顶点和6个面心,Te位于体内,故Cd的配位数即离某个Cd原子距离相等且最近的Te原子个数,故为4,A正确;
B.由题干晶胞甲图所示信息可知,相邻两个Te的核间距为面对角线的一半即为,B错误;
C.由题干晶胞甲图所示信息可知,Cd位于8个顶点和6个面心,Te位于体内,则一个晶胞中含有Cd个数为:=4,Te原子个数为4个,故一个晶胞的质量为:g,晶胞参数为apm,则一个晶胞的体积为:(a×10-10)3,故晶体的密度为,C错误;
D.由题干晶胞甲图所示信息可知,若按图乙虚线方向切甲,可得到图示为:,即体心上没有原子,D错误;
故答案为:A。
15.C
【详解】A.甲中,Hg2+位于Cl-构成的正八面体的体心,其配位数为6,乙中Hg2+的配位数与S2-的配位数相同,都为4,A不正确;
B.甲晶胞中,含个数为=1,含Cl-个数为=3,含Hg2+个数为1,则其化学式为NH4HgCl3,B不正确;
C.乙中,4个S2-位于互不相邻的小正方体的体心,相邻两个S2-之间的距离等于面对角线长的,即为anm,C正确;
D.甲晶胞中,阴离子Cl-数目为3,乙晶胞中,阴离子S2-数目为4,则含有的阴离子数目不相等,D不正确;
故选C。
16.B
【详解】A.由图可知,晶体中左侧底角的钾离子为例,在xy平面有4个、在xz平面由4个,故每个周围距离最近且相等的共有8个,故A错误;
B.每个晶胞中含有=2个K+,=2个,则该叠氮化物的密度为=,故B正确;
C.测定晶体结构的方法是X射线衍射法,故C错误;
D.与结构相似,均为离子晶体,钠离子半径小于钾离子半径,离子键键能更大,的晶格能大于的晶格能,故的熔点大于的熔点,故D错误;
故选B。
17.C
【分析】原子位于顶点与面心,据均摊法,晶胞中含,原子位于晶胞中顶点与最近距离的所形成的四面体中心,晶胞中含8个Mg,晶胞的密度是晶胞中氢原子密度的倍,晶胞氢原子的密度为晶胞单位体积内所含氢原子的质量,设1个晶胞有y个氢原子,可得,即,,解得y=24,据此作答。
【详解】A.根据上述分析可知,晶胞中含4个,8个Mg,24个H,可知该储氢材料的化学式为,故A正确;
B.根据上述分析可知,晶胞中含24个H,故B正确;
C.原子A、B均为原子,原子位于晶胞中顶点与最近距离的所形成的四面体中心,因此原子A、B之间的间距为体对角线的二分之一,即,故C错误;
D.晶体的密度为,故D正确;
故答案选C。
18.C
【详解】A.根据均摊法,晶胞中Zn的个数为4,Se的个数为4,Se在顶点和面心,与Zn构成的立体结构为正四面体形,与其距离最近的Zn原子的个数为4,故A正确;
B.Se位于周期表中第四周期第ⅥA族,属于p区,故B正确;
C.将晶胞均分为8个小立方体,c的分数坐标为1,1,1,原子d应在上层四个小立方体的右前面一个小立方体的体心,d的分数坐标为,故C错误;
D.图中相邻的Zn与Se之间的距离为体对角线的,对角线为nm,则相邻的Se和Zn之间的距离为nm,D正确;
本题选C。
19.D
【详解】A.由晶胞结构图,晶胞中Cu的个数为,K的个数,F的个数,则Cu、K、F的个数比为1:2:4,所以化合物X的化学式为K2CuF4,反应的方程式为4K+CuCl2+2F2=2KCl+K2CuF4,所以CuCl2与F2的物质的量之比为1:2,A正确;
B.基态F原子电子排布为1s22s22p5,电子占据5个原子轨道,有5种空间运动状态,B正确;
C.由晶胞结构图,Cu原子填充在由F原子构成的八面体空隙中,C正确;
D.化合物X的密度即晶体的密度,即ρ=,D错误;
故选D。
20.B
【详解】A.由图可知,与等距且最近的F-位于棱心,共12个,即的配位数为12,故A正确;
B.每个位于距其最近且等距的构成的正八面体体心中,故B错误;
C.若位于晶胞的体心,则K+位于晶胞的顶点处,位于面心,故C正确;
D.由均摊法可知,1个晶胞中含有Mg2+的数目为,F-的数目为,K+的数目为1,晶胞的质量为:,密度为:,故D正确;
故选B。
21.B
【详解】A.由A型小晶格结构可知,每个与4个紧邻,则配位数为4,A项正确;
B.设晶胞变成为2L,,,晶胞体积为,B项错误;
C.主族元素第一电离能同周期自左向右逐渐增大,但两处反常:第IIA族大于第IIIA主族,第VA主族大于第VIA主族,而自上而下则逐渐减小,则晶体中三种元素的第一电离能:O>Mg>Al,C项正确;
D.A块中,个数 = 1+4/8=3/2,个数 = 0,个数 = 4,B块中,个数 = 4/8=1/2,个数 = 4,个数 =4,图1由4个A,4个B构成。所以:数 = 2×4 = 8,数 = 4×4 = 16,数 =8×4 = 32,所以 化学式, D项正确;
答案选B。
22.B
【详解】A.去插层过程中Cs元素均转化为CsI,故A错误;
B.根据均摊原则,晶胞中含有V原子数 、Se原子数、O原子数,N的化学式为,故B正确;
C.根据图示,M中与Cs原子最临近的Se原子有8个,故C错误;
D.N中V原子位于Se原子围成的正方形中心,故D错误;
选B。
23.D
【分析】由题意可知,Cu2-xSe为正极材料,钠较为活泼,钠为负极材料,充电时Cu2-xSe为阳极,发生氧化反应,钠为阴极,发生还原反应,根据均摊法,Na2Se晶胞中含有个Se2-,Na+在内部为4个,据此回答。
【详解】A.电流从正极经导线到负极,然后又回到正极,所以电流方向:M→用电器→N→钠离子交换膜→M,A正确;
B.放电时,正极Cu2-xSe得到电子发生还原反应生成零价铜,电极反应式为:,B正确;
C.充电时外电路中转移1ml电子,阳极释放出1ml钠离子,质量减小23g,阴极生成1ml钠,质量增加23g,两极质量变化差为46g,C正确;
D.根据分析可知,若①为(0,0,0),②为后面面心,②为则,D错误;
故选D。
24.B
【详解】A.根据均摊法计算:氯位于顶点和面心,1个晶胞含个氯,铜位于体内,1个晶胞含4个铜,故其化学式为,A项错误;
B.由A、B原子坐标和晶胞图示可知,原子位于体对角线,坐标为,B项正确;
C.1个铜与4个氯连接,配位数为4,C项错误;
D.设晶胞参数为,1个晶胞含4个,则,,体对角线长为,故A和B粒子之间的距离,D项错误;
答案选B。
25.B
【详解】A.中,C原子与N原子形成三对共用电子,C原子又获得1个电子,则所有原子均满足8电子稳定结构,A正确;
B.晶胞中,我们选定位于体心的K+,离K+距离最近的有6个,B不正确;
C.每个晶胞中含有K+的数目为=4,C正确;
D.该晶胞的密度为=,D正确;
故选B。
2024年高考化学压轴题专项训练(新高考通用)压轴题07_水溶液中微粒变化图像题(原卷版+解析版): 这是一份2024年高考化学压轴题专项训练(新高考通用)压轴题07_水溶液中微粒变化图像题(原卷版+解析版),文件包含2024年高考化学压轴题专项训练新高考通用压轴题07水溶液中微粒变化图像题原卷版docx、2024年高考化学压轴题专项训练新高考通用压轴题07水溶液中微粒变化图像题解析版docx等2份试卷配套教学资源,其中试卷共0页, 欢迎下载使用。
有机合成与推断--2024年高考化学压轴题专项训练: 这是一份有机合成与推断--2024年高考化学压轴题专项训练,文件包含压轴有机合成与推断解析版pdf、压轴题有机合成与推断学生版pdf等2份试卷配套教学资源,其中试卷共90页, 欢迎下载使用。
化学实验综合题--2024年高考化学压轴题专项训练: 这是一份化学实验综合题--2024年高考化学压轴题专项训练,文件包含化学实验综合题解析版pdf、化学实验综合题学生版pdf等2份试卷配套教学资源,其中试卷共61页, 欢迎下载使用。












