
黑龙江省大庆实验中学2024-2025学年高二上学期8月开学考试化学试题(Word版附答案)
展开化学学科试题
—
说明:1.请将答案填涂在答题卡的指定区域内。
满分100分,考试时间90分钟。
可能用到的相对原子质量 H:1 C:12 O:16 Na:23 Mn:55 I:127
一.选择题(本大题共20小题,1-15题每小题2分,16-20题每小题3分。共45分)
1.化学创造美好生活,下列说法正确的是
A.苯甲酸及其钠盐常用作食品防腐剂
B.天宫一号使用的太阳能电池板主要成分为二氧化硅
C.淀粉、纤维素和油脂均是天然有机高分子
D.氧化亚铁常用作油漆的红色颜料
2.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,15g甲基(-CH3)含有电子数为10NA
B.标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA
C.常温常压下,28g乙烯和丙烯(C3H6)的混合气体中含有原子总数目为6NA
D.1mlCH3CH2OH分子中含有的共价键数目为7NA
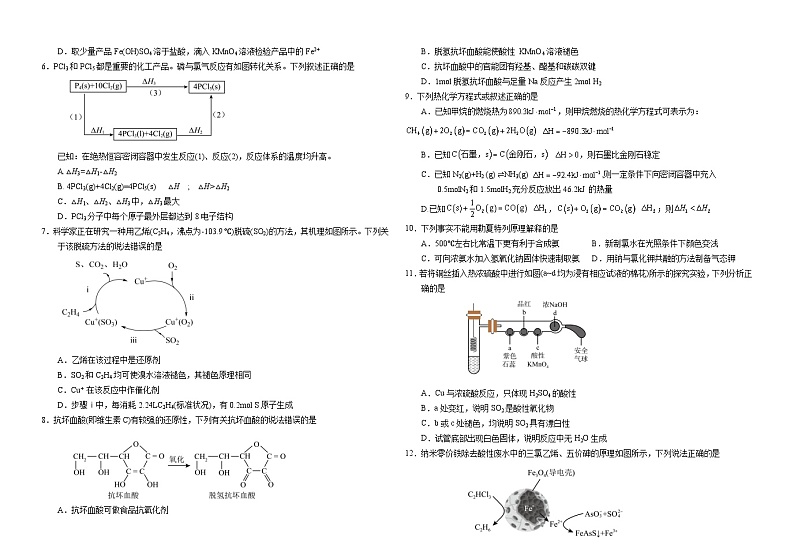
3.用如图所示装置完成相应实验(a、b、c中分别盛有试剂1、2、3),能达到实验目的的是
4.下列装置和操作不能达到实验目的的是
A.用图①装置检验纯碱中是否含有钾元素
B.用图②装置测定锌和一定浓度稀硫酸的反应速率
C.用图③装置分离I2和NH4Cl固体
D.用图④装置检验石蜡油分解产生的不饱和烃
5.某工业废水中含有大量的Fe2+、SO42-、Cu2+。兴趣小组模拟工业从该废水中回收金属铜,并制备Fe(OH)SO4,流程如下:
已知:该流程中NaNO2的还原产物为NO
下列说法错误的是
A.甲为铁粉,乙为稀硫酸溶液
B.固体1为铁、铜混合物,固体2为铜
上述流程中欲制备2mlFe(OH)SO4,理论上至少需要加入2mlNaNO2
D.取少量产品Fe(OH)SO4溶于盐酸,滴入KMnO4溶液检验产品中的Fe2+
6.PCl3和PCl5都是重要的化工产品。磷与氯气反应有如图转化关系。下列叙述正确的是
已知:在绝热恒容密闭容器中发生反应(1)、反应(2),反应体系的温度均升高。
A.△H3=△H1-△H2
B. 4PCl3(g)+4Cl2(g)=4PCl5(s) △H ; △H>△H2
C.△H1、△H2、△H3中,△H3最大
D.PCl3分子中每个原子最外层都达到8电子结构
7.科学家正在研究一种用乙烯(C2H4,沸点为-103.9 ℃)脱硫(SO2)的方法,其机理如图所示。下列关于该脱硫方法的说法错误的是
A.乙烯在该过程中是还原剂
B.SO2和C2H4均可使溴水溶液褪色,其褪色原理相同
C.Cu+ 在该反应中作催化剂
D.步骤ⅰ中,每消耗2.24LC2H4(标准状况),有0.2ml S原子生成
8.抗坏血酸(即维生素C)有较强的还原性,下列有关抗坏血酸的说法错误的是
A.抗坏血酸可做食品抗氧化剂
B.脱氢抗坏血酸能使酸性 KMnO4溶液褪色
C.抗坏血酸中的官能团有羟基、酯基和碳碳双键
D.1ml脱氢抗坏血酸与足量Na反应产生2ml H2
9.下列热化学方程式或叙述正确的是
A.已知甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
B.已知 ,则石墨比金刚石稳定
C.已知N2(g)+H2 (g) ⇌NH3(g) ,则一定条件下向密闭容器中充入 0.5mlN2和1.5mlH2充分反应放出46.2kJ 的热量
D.已知 , ;则
10.下列事实不能用勒夏特列原理解释的是
A.500℃左右比常温下更有利于合成氨 B.新制氯水在光照条件下颜色变浅
C.可向浓氨水加入氢氧化钠固体快速制取氨 D.用钠与氯化钾共融的方法制备气态钾
11.若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
12.纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如图所示,下列说法正确的是
A.该处理过程中将电能转化为化学能
B.该处理过程中纳米零价铁中的Fe为正极
C.每生成11.2L乙烷,转移电子0.4ml
D.酸性废水中的五价砷除去过程中As和S都被Fe2+还原了
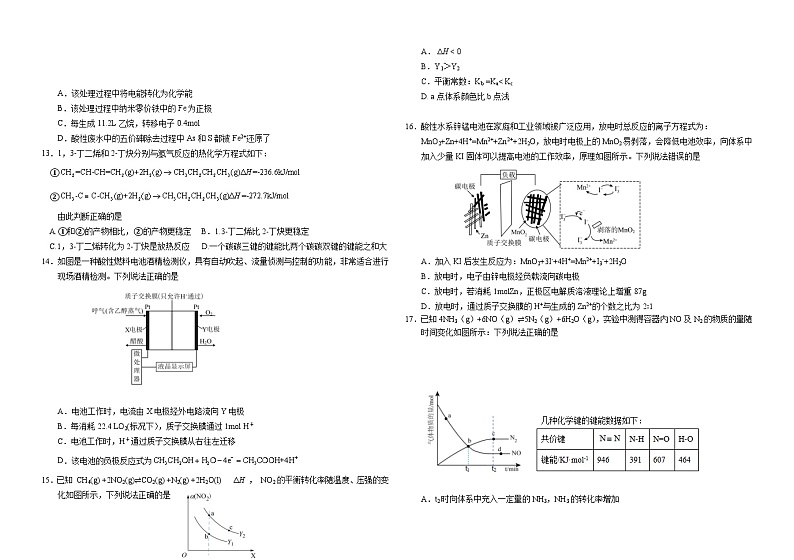
13.1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
①
②
由此判断正确的是
A.①和②的产物相比,②的产物更稳定B.1.3-丁二烯比2-丁炔更稳定
C.1,3-丁二烯转化为2-丁炔是放热反应 D.一个碳碳三键的键能比两个碳碳双键的键能之和大
14.如图是一种酸性燃料电池酒精检测仪,具有自动吹起、流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是
A.电池工作时,电流由X电极经外电路流向Y电极
B.每消耗22.4 LO2(标况下),质子交换膜通过1ml H+
C.电池工作时,H+通过质子交换膜从右往左迁移
D.该电池的负极反应式为
15.已知 CH4(g) +2NO2(g)⇌CO2(g) +N2(g) +2H2O(l) ΔH , NO2的平衡转化率随温度、压强的变化如图所示,下列说法正确的是
A. ΔH < 0
B.Y1>Y2
C.平衡常数:Kb =Ka< Kc
D. a点体系颜色比.b点浅
16.酸性水系锌锰电池在家庭和工业领域被广泛应用,放电时总反应的离子方程式为:MnO2+Zn+4H+=Mn2++Zn2++2H2O,放电时电极上的MnO2易剥落,会降低电池效率,向体系中加入少量KI固体可以提高电池的工作效率,原理如图所示。下列说法错误的是
A.加入KI后发生反应为:MnO2+3I-+4H+=Mn2++I3-+2H2O
B.放电时,电子由锌电极经负载流向碳电极
C.放电时,若消耗1mlZn,正极区电解质溶液理论上增重87g
D.放电时,通过质子交换膜的H+与生成的Zn2+的个数之比为2∶1
17.已知4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g),实验中测得容器内NO及N2的物质的量随时间变化如图所示:下列说法正确的是
A.t2时向体系中充入一定量的NH3,NH3的转化率增加
B.图中b点对应的速率关系是v(正)= v(逆)
C.反应达平衡后,升高温度平衡正向移动
D.混合气体的平均相对分子质量不变,说明反应达到平衡状态
18.在容积为2 L的恒容密闭容器中发生反应,图I表示200 ℃时容器中A、B、C的物质的量随时间的变化关系,图Ⅱ表示不同温度下达到平衡时C的体积分数随起始的变化关系,则下列结论正确的是
A.由图可知反应方程式为2A(g)+B(g)⇌C (g) △H<0
B.200℃时,反应从开始到平衡的平均速率
C.由题意可知,图Ⅱ中 a=2
D.平衡后,再向体系中充入Ar,重新达到平衡前
19.根据下列实验操作不能达到实验目的的是
20.钠离子电池以其快速充放电的特性受到科研工作者的重视,具有广泛的应用前景。某基于有机电解质的钠离子可充电电池的放电工作原理如图所示:下列说法正确的是
A.x>y B.放电时,外电路通过0.1ml电子,A电极质量减少4.6g
C.放电时,B电极发生的反应为
D.该电池中的有机电解质可用水溶液替换
二、填空题(本大题共4个小题,共55分)
21.(14分)海洋中蕴含着丰富的资源,海水中Br-的含量约为67mg/L,海洋植物如海带、海藻中含有丰富的碘元素,以碘离子的形式存在。
Ⅰ.为研究海水提溴工艺,设计了如下实验流程:
(1)实验中,通入热空气吹出Br2,利用了溴的 性。
(2)操作x为 。
(3)流程中SO2被氧化生成SO42-,实验室检验SO42-的方法为 。
Ⅱ.实验室里从海带中提取碘的流程如图:
(4)写出步骤④中主要反应的离子方程式: 。
(5)流程中后期处理用反萃取法:
①上述操作1的反应中还原剂与氧化剂的物质的量之比为 。
②操作2使用的玻璃仪器为 。
③反萃取流程中可循环利用的物质是 。
22.(13分)某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与Na2SO3固体反应制备SO2气体。
制备SO2气体最合适的发生装置是 (填写字母)。
A中温度计插入的仪器名称为 。
Ⅱ.制备硫代硫酸钠
室温时,往Na2S、Na2CO3混合溶液中均匀通入SO2气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入SO2气体。产生Na2S2O3。反应原理:
(3)制备Na2S2O3反应分三步进行
反应i:;
反应ii:;
反应iii的化学方程式为 。
(4)当pH值接近于7时,停止通入的原因是 。
Ⅲ.探究性质
(5)向某浓度的过量KIO3酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
针对该现象产生的原因某实验小组提出假设:
t秒前生成了I2(反应A),但I2继续与溶液中的SO2反应(反应B),其中反应较快的是 (填“A”或“B”)。 因此t秒前溶液无明显变化;t秒后溶液中的IO3-与I-又生成I2,因此溶液变蓝。
为验证该实验小组的假设合理,设计实验:向变蓝色的溶液中 ;可观察到现象为:蓝色迅速消失,一段时间后再次变蓝。
Ⅳ.尾气处理
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示,请分析并回答下列问题:
(6)分析可知X为 (填化学式)。
(7)0~t1 时间段的温度为 。
23.(14分)以H2、CO为原料,可以合成甲醇。反应原理为CO(g)+2H2(g) ⇌CH3OH(g) △H = a kJ·ml-1 回答下列问题:
(1)已知:CO(g)+1/2O2(g )⇌CO2(g) △H = -283 kJ·ml-1
H2(g)+1/2O2(g )⇌H2O(g) △H = -242 kJ·ml-1
CH3OH(g)+3/2O2(g) ⇌CO2(g)+2H2O(g) △H = -676kJ·ml-1
则a= 。
(2)下列措施既可增大反应速率又可提高H2的平衡转化率的是 _______(填字母)。
A.压缩容器的体积 B.将CH3OH从体系中分离
C.恒温恒容时充入He D.使用高效催化剂
(3)工业上用反应CO(g)+2H2(g)⇌CH3OH(g)合成甲醇。在容积为1L的恒容密闭容器中,初始CO的物质的量均为1ml, 分别在230℃、250℃和270℃进行实验,结果如图。其中270℃的实验结果所对应的曲线是 (填字母),此温度下的平衡常数K= (ml/L)-2。当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投料比的要求是 。
(4)我国学者采用量子力学法研究了钯基催化剂表面吸附CO和H2合成CH3OH的反应,其中某段反应的相对能量与历程的关系如图所示,图中的TS1-TS5为过渡态,吸附在钯 催化剂表面上的物种用*标注。
图中决速步骤的能垒(活化能)为 kJ·ml-1,该步骤反应的化学方程式为 。
24.(14分)有机物I(乙酸环己酯)是一种香料,用于配制苹果、香蕉、醋栗和树莓等果香型香精,下面是利用两种石油化工产品制备I的一种合成路线:
已知:。
(1)由石油生产A的工艺名称为 。I的分子式为 。
(2)C中官能团的名称为 。
(3)反应①~ ⑥中属于加成反应的是 (填序号)。
(4)反应⑥的化学方程式为 。
(5)H的同分异构体中,能够使新制的氢氧化铜产生砖红色沉淀的结构有 种。
(6)下列关于合成路线中所涉及物质的说法正确的是 。
A.B与互为同系物
B. A、E分子中的原子均处于同一平面
C.一定条件下,1mlG可与3mlH2反应生成H
可用NaHCO3溶液鉴别B和D
大庆实验中学实验一部2023级高二上学期开学考试
化学学科试题答案
选择题(本大题共20小题,1-15题第小题2分,16-20题第小题3分,共45分)
二、填空题(本大题共4个小题,共55分)
21.(14分)
答案:(每空2分,共14分)
挥发性
蒸馏
(3)取少量溶液于试管中,滴加几滴(盐酸酸化的)BaCl2溶液,若有白色沉淀产生,则说明有SO42-
(4)H2O2+2I-+2H+=2H2O+I2
(5) ①1:5 ②烧杯、漏斗、玻璃棒 ③CCl4
22. (13分)
答案:(除标注1分,其余每空2分,共13分)
(1)C(1分) (2)蒸馏烧瓶
(3)S+Na2SO3=Na2S2O3
(4)二氧化硫继续通入会反应生成亚硫酸,而硫代硫酸钠易与酸反应,故减少硫代硫酸钠的损失
(5)B 通入少量SO2
(6)H2S(1分) (7)300℃(1分)
(14分)
答案:(每空2分,共14分)
(1)-91 (2)A
(3)Z 4 温度越高 投料比越大
(4)178.3 CO*+4H* = CHO*+3H*
24.(14分)
答案:(每空2分,共14分)
裂解 C8H14O2
醛基
1 、 5
略 (5)8 (6) BCD
选项
试剂1
试剂2
试剂3
实验目的
A
浓氨水
CaO
浓硫酸
制取干燥的NH3
B
浓硫酸
Fe片
浓硫酸
制取干燥的SO2
C
浓盐酸
MnO2
饱和NaCl溶液
制取Cl2并除去HCl
D
稀硝酸
Cu片
H2O
制取NO并除去NO2
选项
实验操作
实验目的
A
向盛有Cu片的试管中加入NaNO3溶液,无明显现象,再加入适量的稀H2SO4
验证NaNO3在酸性环境中具有氧化性
B
向足量KI溶液中加入几滴FeCl3溶液,充分反应后,加入几滴KSCN溶液
验证Fe3+与I-反应为可逆反应
C
将盛有2mL0.1ml/LNa2S2O3溶液的两支试管分别放入盛有冷水和热水的烧杯中,再同时向试管中分别加入2mL0.1ml/LH2SO4溶液,振荡
研究温度对化学反应速率的影响
D
向试管中加入0.5g淀粉和4mL2ml/LH2SO4溶液,加热。冷却后,加入少量的银氨溶液,加热
验证淀粉在硫酸催化下的水解产物
1
2
3
4
5
6
7
8
9
10
A
C
D
C
D
D
B
D
B
A
11
12
13
14
15
16
17
18
19
20
B
D
B
D
A
C
D
C
D
A
黑龙江省大庆市实验中学实验二部2023-2024学年高一下学期开学考试化学试卷(Word版附答案): 这是一份黑龙江省大庆市实验中学实验二部2023-2024学年高一下学期开学考试化学试卷(Word版附答案),共11页。试卷主要包含了满分100分,考试时间90分钟,下列叙述正确的有等内容,欢迎下载使用。
黑龙江省大庆市大庆中学2023-2024学年高一下学期开学考试化学试题(Word版附答案): 这是一份黑龙江省大庆市大庆中学2023-2024学年高一下学期开学考试化学试题(Word版附答案),文件包含化学试题docx、高一年级化学试题答题卡pdf、开学考试化学试题答案docx等3份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
黑龙江省大庆实验中学二部2023-2024学年高二上学期开学考试化学试题: 这是一份黑龙江省大庆实验中学二部2023-2024学年高二上学期开学考试化学试题,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












