
江西省上饶市广丰一中2024-2025学年高三补习班8月化学测试卷
展开1.答题前,先将自己的姓名、考号等填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接写在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量有:H 1 O 16 Ne 20 C 12 N 14 Na 23 Fe 56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
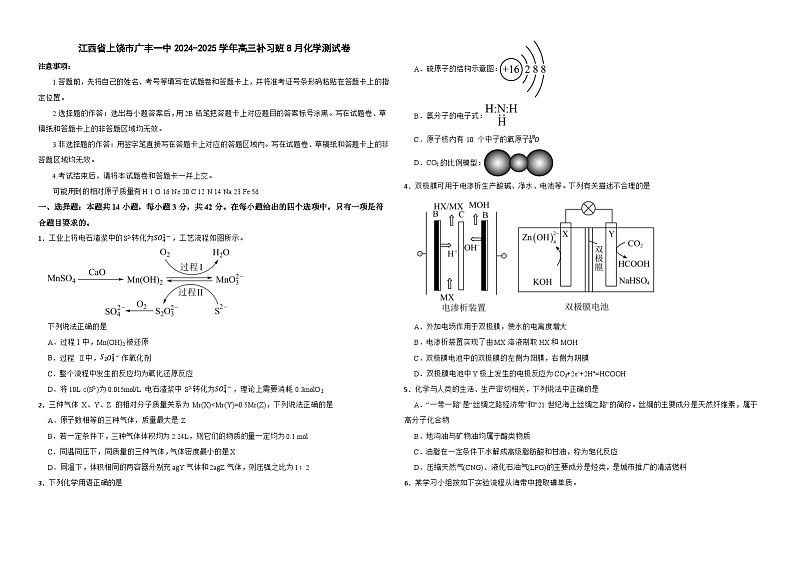
1.工业上将电石渣浆中的S2-转化为SO42-,工艺流程如图所示。
下列说法正确的是
A.过程Ⅰ中,Mn(OH)2被还原
B.过程 Ⅱ中,S2O32-作氧化剂
C.整个流程中发生的反应均为氧化还原反应
D.将10L c(S2-)为0.015ml/L电石渣浆中 S2-转化为SO42-,理论上需要消耗 0.3mlO2
2.三种气体 X、Y、Z 的相对分子质量关系为 Mr(X)
B.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1 ml
C.同温同压下,同质量的三种气体,气体密度最小的是X
D.同温下,体积相同的两容器分别充agY气体和2agZ气体,则压强之比为1:2
3.下列化学用语正确的是
A.硫原子的结构示意图:
B.氨分子的电子式:
C.原子核内有 10 个中子的氧原子818O
D.CO2的比例模型:
4.双极膜可用于电渗析生产酸碱、净水、电池等。下列有关描述不合理的是
A.外加电场作用于双极膜,使水的电离度增大
B.电渗析装置实现了由MX溶液制取HX和MOH
C.双极膜电池中的双极膜的左侧为阳膜,右侧为阴膜
D.双极膜电池中Y极上发生的电极反应为CO2+2e-+2H+=HCOOH
5.化学与人类的生活、生产密切相关,下列说法中正确的是
A.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是天然纤维素,属于高分子化合物
B.地沟油与矿物油均属于酯类物质
C.油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
D.压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料
6.某学习小组按如下实验流程从海带中提取碘单质。
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,I2的沸点高于CCl4,根据以上流程,判断下列说法正确的是
A.步骤X“萃取”时,可用无水乙醇代替CCl4
B.加入H2SO4溶液后发生反应的离子方程式为:5I-+IO3-+6H+=3I2+3H2O
C.方案甲采用蒸馏法时,碘蒸气先汽化冷凝,在锥形瓶中先得到I2
D.步骤Y后下层液体不可循环利用
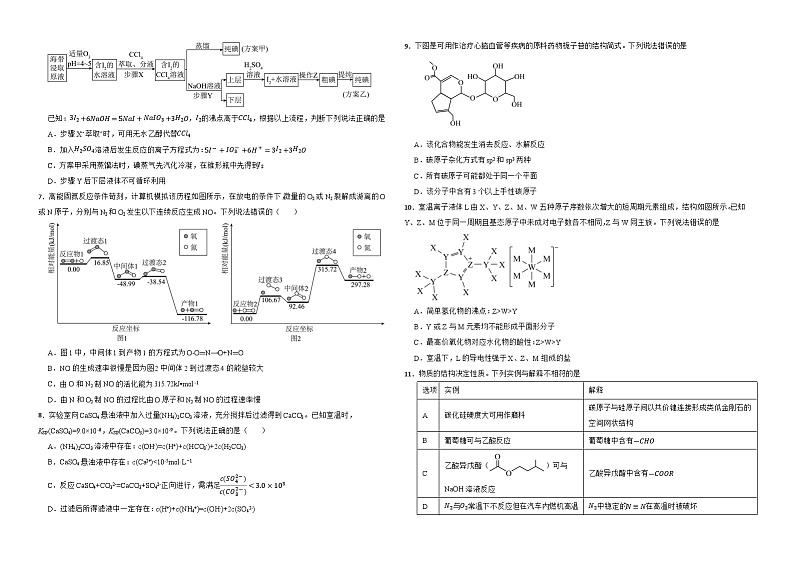
7.高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )
A.图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72kJ•ml-1
D.由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
8.实验室向CaSO4悬浊液中加入过量(NH4)2CO3溶液,充分搅拌后过滤得到CaCO3。已知室温时,KSP(CaSO4)=9.0×10-6,KSP(CaCO3)=3.0×10-9。下列说法正确的是( )
A.(NH4)2CO3溶液中存在:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B.CaSO4悬浊液中存在:c(Ca2+)<10-5ml·L−1
C.反应CaSO4+CO32-=CaCO3+SO42-正向进行,需满足c(SO42-)c(CO32-)<3.0×103
D.过滤后所得滤液中一定存在:c(H+)+c(NH4+)=c(OH-)+2c(SO42-)
9.下图是可用作治疗心脑血管等疾病的原料药物栀子苷的结构简式。下列说法错误的是
A.该化合物能发生消去反应、水解反应
B.碳原子杂化方式有sp2和sp3两种
C.所有碳原子可能都处于同一个平面
D.该分子中含有3个以上手性碳原子
10.室温离子液体L由X、Y、Z、M、W五种原子序数依次增大的短周期元素组成,结构如图所示。已知Y、Z、M位于同一周期且基态原子中未成对电子数各不相同,Z与W同主族。下列说法错误的是
A.简单氢化物的沸点:Z>W>Y
B.Y或Z与M元素均不能形成平面形分子
C.最高价氧化物对应水化物的酸性:Z>W>Y
D.室温下,L的导电性强于X、Z、M组成的盐
11.物质的结构决定性质。下列实例与解释不相符的是
A.AB.BC.CD.D
12.已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是
A.A分子中所有原子均在同一平面内
B.A→B所用试剂为H2O,该反应可生成一种重要有机溶剂
C.分子式为C4H8O2的酯有3种
D.等物质的量的B、D分别与足量钠反应生成气体的量相等
13.下列反应的离子方程式书写正确的是
A.用硫化亚铁除去废水中汞离子:S2-+Hg2+=HgS↓
B.用铁氰化钾溶液检验Fe2+:K++Fe2++FeCN63-=KFeFeCN6↓
C.用铁作电极电解饱和NaCl溶液:2Cl-+2H2O电解2OH-+H2↑+Cl2↑
D.溴乙烷的水解:CH3CH2Br+OH-→△醇CH3CH2OH+Br
14.化学与工农业生产、日常生活、材料等有密切的联系,下列说法正确的是( )
A.华为公司自主研发的“麒麟970芯片需要以高纯度的二氧化硅为原料
B.笔、墨、纸、砚为传统的文房四宝,上述物质中的(毛)笔与(宣)纸均含有机物
C.电影《红高粱》中用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
D.有机高分子明星材料石墨烯,具有优异的光学、电学、力学和热学性质
二、非选择题:本题共4小题,共58分。
15.以硫化铜矿(主要成分为CuS,含一定量的Zn2+、Fe2+)为原料制备粗铜的流程如下:
已知:①浸取液中c(Cu2+)约为0.1ml·L−1
②几种离子开始沉淀及沉淀完全(金属离子浓度≤10-5ml·L−1)时的pH:
(1)“浸取”时,CuS转化为S的离子方程式为 。
(2)已知CuS难溶于硫酸。溶液中存在CuS(s)=Cu2+(aq)+S2−(aq)。“浸取”时采用高压O2的原因是 。
(3)“调pH”时需控制的pH范围是 。
(4)“过滤1”所得固体X主要成分是 。
(5)经过如上流程,“Zn2+”存在于 (何处)。
(6)粗铜中铜含量的测定
步骤1:取0.2000g粗铜,加入一定量浓HNO3、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的HNO3,冷却;
步骤2:将步骤1所得溶液加水定容至250mL,量取25.00mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用0.01000ml·L−1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00mL。
已知:Cu2++I−-CuI+I2,I2+S2O32--S4O62-+I−(未配平)
粗铜中铜的质量分数为 (写出计算过程)。
16.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图所示的实验,回答下列问题:
(1)浓硫酸与木炭发生反应的化学方程式为 。
(2)装置A中无水硫酸铜的作用为 。
(3)装置B中的实验现象为 。
(4)装置D中溶液不褪色,装置E中澄清石灰水变浑浊,证明产物中有 。
(5)浓硝酸与木炭在加热条件下也可发生化学反应,对比分析下列实验,所得结论不正确的是___________。(已知:碎瓷片与浓硝酸不反应)
A.试管①中产生红棕色气体,说明浓硝酸受热易分解
B.试管②中产生红棕色气体,说明浓硝酸一定被木炭还原
C.试管③中产生红棕色气体,说明浓硝酸具有挥发性,NO2是氧化产物
D.试管③的气体产物中检测出CO2,说明木炭一定被浓硝酸氧化
17.某同学设计如图所示装置制备一硝基甲苯。
实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1:3)的混合物(混酸);
②在三颈烧瓶里装15mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量(淡黄色油状)液体出现;
⑥分离出—硝基甲苯(已知:甲苯的密度为0.866g∙cm-3,沸点为110.6℃;硝基苯的密度为1.20 g∙cm-3,沸点为210.9℃)。
根据上述实验,回答下列问题:
(1)实验方案中缺少一种必要的仪器,它是 。本实验的关键是控制温度在30℃左右,如果温度过高,可能产生的后果是 。
(2)L仪器名称是 ,其作用是 。
(3)甲苯与混酸反应生成对硝基甲苯的化学方程式是 ,反应类型是 。
(4)分离产品方案如图:
经测定,产品1的核磁共振氢谱中有3个峰,则其结构简式为 ;产品2的核磁共振氢谱中有5个峰,它的名称为 。
18.苯甲酸乙酯可用于配制香水及食用香精。实验室可用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)。
已知信息如表:
Ⅰ.合成苯甲酸乙酯粗产品:按如图装置,在仪器C中加入2.44g苯甲酸、20.0mL乙醇、3.0mL浓硫酸和适量环己烷(与乙醇、水可形成共沸物),控制一定温度加热2h后停止加热。
(1)仪器A名称是 ,进水口为 (填“a”或者“b”)
(2)本实验中制取苯甲酸乙酯的化学方程式为 。
(3)实验时使用过量乙醇的目的是 。
(4)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是 。
Ⅱ.粗产品的精制:将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至如图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.0mL。
(5)加入Na2CO3溶液的作用有 。
(6)采用图乙装置进行蒸馏操作,收集 ℃的馏分。
(7)该实验中苯甲酸乙酯的产率是 。
高三化学参考答案解析
1.【答案】D
2.【答案】C
3.【答案】C
4.【答案】C
5.【答案】D
6.【答案】B
7.【答案】D
8.【答案】C
【解析】【解答】A.根据质子守恒, (NH4)2CO3 溶液中存在: c(OH-)+c(NH3.H2O)=c(H+)+c(HCO3-)+2c(H2CO3) ,故A不符合题意;
B.KSP(CaSO4)=9.0×10-6 , CaSO4悬浊液中存在: c(Ca2+)=9×10-6=3×10-3ml/L>10-5ml·L−1 ,故B不符合题意;
C.反应CaSO4+CO32-⇌CaCO3+SO42- ,K=Ksp(CaSO4)Ksp(CaCO3)=3.0×103,反应正向进行,需满足c(SO42-)c(CO32-)<3.0×103 ,故C符合题意;
D.根据电荷守恒,过滤后所得滤液中一定存在: c(H+)+c(NH4+)+2c(Ca2+)=c(OH-)+2c(SO42-) +c(HCO3-)+2c(CO32-),故D不符合题意;
故答案为:C
【分析】A.考虑铵根离子结合氢氧根,因此即可质子守恒即可写出;
B.根据KSP(CaSO4)=9.0×10-6 ,即可计算出浓度;
C.CaSO4+CO32-⇌CaCO3+SO42- ,即可计算出常数K即可判断;
D.根据电荷守恒即可判断。
9.【答案】C
【解析】【解答】A.含有醇羟基且邻碳有氢,可以发生消去反应,含有酯基可以发生水解反应,A正确;
B.碳碳双键上的碳原子,酯基上的碳原子为sp2杂化,全部都是单键的碳原子为sp3杂化,B正确;
C.分子中有碳原子同时连有3个碳原子,不可能所有碳原子都处于同一个平面,C错误;
D.该分子含有3个以上手性碳原子,如图所示:,D正确;
故答案为:C。
【分析】A、醇羟基且邻碳有氢,可以发生消去反应;
B、碳原子都是单键,为sp3杂化,碳含有一个双键为sp2杂化,含有一个三键为sp杂化;
C、共平面的判断要注意一个原子周围有3个或以上的单键连接时,最多两个单键原子共平面;
D、手性碳原子指的是一个碳原子周围连接四个完全不相同的结构。
10.【答案】B
【解析】【解答】X可形成1个共价键,为H、F、Cl;Y形成4个共价键,为C、Si;Z形成3个共价键,为N、P;W形成5个共价键,为N或P;Y、Z、M的基态原子中未成对电子数各不相同,未成对电子数应是1,2,3个,则X、Y、Z、M、W五种原子分别是H、C、N、F、P。A.NH3、PH3、CH4的相对分子质量越大,其沸点越高,若而NH3形成氢键,沸点反常,则沸点NH3>PH3>CH4,A正确;
B.C与F可以形成CF2=CF2,为平面结构,B错误;
C.最高价氧化物对应水化物的酸性可以通过非金属性判断,非金属性N>P>C,因此酸性HNO3>H3PO4>H2CO3,C正确;
D.L是离子液体,可以导电,H、N、F组成的盐是NH4F,常温下为固体,不能导电,D正确;
故答案为:B
【分析】A、分子晶体的沸点可以根据范德华力判断,范德华力受相对分子质量影响,若分子存在氢键,则沸点反常;
B、参考乙烯分子,可以知道分子为平面形;
C、最高价氧化物对应水化物的酸性可以通过非金属性判断;
D、离子晶体熔融状态或者溶液中可以导电。
11.【答案】B
【解析】【解答】A.碳化硅中碳原子与硅原子间以共价键连接形成类似金刚石的空间网状结构,硬度很大,可用作磨料,故A不符合题意;
B.葡萄糖中含有-OH,可与乙酸反应,故B符合题意;
C.乙酸异戊酯()因含有-COOR(酯基)可与NaOH溶液发生水解反应,故C不符合题意;
D.N2中含有的稳定的N≡N在高温时被破坏,与O2反应生成NO,故D不符合题意;
故答案为:B
【分析】A.碳化硅中碳原子和硅原子形成网状结构,因此耐磨性强;
B.葡萄糖与乙酸反应主要是含有羟基;
C.乙酸异戊酯含有酯基可与氢氧化钠反应;
D.氮气与氧气反应主要是氮氮三键被破坏。
12.【答案】C
13.【答案】B
【解析】【解答】A.用FeS处理含Hg2+废水,离子方程式为:Hg2++FeS=HgS+Fe2+,故A不符合题意;
B.将K3[Fe(CN)6]溶液滴入FeCl2溶液中产生蓝色沉淀,反应的离子方程式为:K++Fe2++FeCN63-=KFeFeCN6↓,故B符合题意;
C.铁为电极,阳极铁放电,得到氢氧化亚铁,正确的电极反应为:Fe+2H2O =Fe(OH)2↓+H2↑,故C不符合题意;
D.溴乙烷水解的条件为氢氧化钠的水溶液并加热,生成溴化钠,不会生成溴原子,正确的离子方程式为:CH3CH2Br+OH-→△水CH3CH2OH+Br-,故D不符合题意;
故答案为:B
【分析】
A.硫化亚铁不能拆开即可写出离子方程式;
B.根据将K3[Fe(CN)6]溶液滴入FeCl2溶液中产生蓝色沉淀即可写出方程式;
C.铁做电极,阳极是铁失去电子不是氯离子失去电子;
D.溴乙烷水解得到乙醇。
14.【答案】B
15.【答案】(1)2CuS+O2+4H+=2Cu2++2S+2H2O
(2)增大溶解氧的浓度,提高O2氧化S2-的速率,使CuS沉淀溶解平衡正向移动
(3)3.2 ~4.2
(4)S、Fe(OH)3
(5)“过滤2”的滤液中
(6)n(Na2S2O3)=0.01000 ml·L−1×20.00×10-3 L=2.0×10-4ml,2Cu2+~I2~2Na2S2O3,n(Cu2+)=n(Na2S2O3)=2.0×10-4mL,0.2000 g粗铜中m(Cu)=25025×2.0×10-4mL×64 g/ml=0.128 g,粗铜中铜的质量分数为:× 100% = 64%。
【解析】【解答】(1)在浸取时,CuS、H2SO4、O2发生氧化还原反应产生CuSO4、S、H2O,反应的离子方程式为2CuS+O2+4H+=2Cu2++2S+2H2O;
(2)已知CuS难溶于硫酸。溶液中存在沉淀溶解平衡:CuS(s)⇌Cu2+(aq) + S2−(aq),“浸取”时采用高压O2是为了增大溶解氧的浓度(或增加O2在溶液中的溶解度),提高O2氧化S2-的速率,使CuS沉淀溶解平衡正向移动,促进物质的转化;
(3)在浸取时O2可以将Fe2+氧化变为Fe3+,发生反应:4Fe2++4H++O2=4Fe3++2H2O,结合溶液中各种离子沉淀完全时溶液的pH,调整溶液pH在3.2 ~ 4.2,Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,故“调pH”时需控制的pH范围是3.2 ~ 4.2;
(4)S难溶于水,以固体形式存在,Fe3+形成Fe(OH)3沉淀,故“过滤1”所得固体X主要成分是S、Fe(OH)3;
(5)由分析可知,浸取、调pH、过滤1、还原等步骤中没有除去Zn2+,因此Zn2+在“过滤2”的滤液中;
(6)在滴定过程中发生反应为:2Cu2++4I−=2CuI+I2,I2+2S2O32-= S4O62- +2I−,故反应的关系式为:2Cu2+~I2~2Na2S2O3,25.00 mL0.01000 ml/LNa2S2O3溶液中溶质的物质的量n(Na2S2O3)=0.01000 ml·L−1×20.00×10-3 L=2.0×10-4 ml,根据反应转化关系可知反应消耗Cu2+的物质的量n(Cu2+)= n(Na2S2O3)=2.0×10-4 ml,在0.2000 g粗铜中含有Cu的质量m(Cu)=10×2.0×10-4 mL×64 g/ml=0.128 g,该粗铜中Cu的质量分数为× 100% = 64%;
【分析】(1)CuS、H2SO4、O2发生氧化还原反应产生CuSO4、S、H2O,即可写出离子方程式;
(2)存在CuS(s)⇌Cu2+(aq) + S2−(aq),因此加入氧气可氧化硫离子促使平衡正向移动;
(3)根据调节pH是沉淀铁离子即可判断;
(4)硫单质和氢氧化铁均不溶于水即可判断;
(5)浸取、调pH、过滤1、还原等步骤中没有除去Zn2+,因此在滤液2中;
(6)根据滴定2Cu2++4I−=2CuI+I2,I2+2S2O32-= S4O62- +2I−,找出数量关系即可计算出铜的量计算出质量分数。
16.【答案】(1)C+2H2SO4浓ΔCO2↑+2SO2↑+2H2O
(2)检验产物中是否有H2O
(3)品红溶液褪色
(4)CO2
(5)
17.【答案】(1)温度计;生成二硝基甲苯、三硝基甲苯
(2)球形冷凝管;冷凝回流,提高原料利用率
(3)+HO-NO2→30°C浓硫酸+H2O;取代反应(或硝化反应)
(4);邻硝基甲苯
18.【答案】球形冷凝管;b;CH3CH2OH+⇌浓H2SO4△+H2O;提高苯甲酸的转化率或苯甲酸乙酯的产率;分水器内水层高度不再发生变化;除去硫酸和苯甲酸、降低苯甲酸乙酯的溶解度;212.0;70%选项
实例
解释
A
碳化硅硬度大可用作磨料
碳原子与硅原子间以共价键连接形成类似金刚石的空间网状结构
B
葡萄糖可与乙酸反应
葡萄糖中含有-CHO
C
乙酸异戊酯()可与NaOH溶液反应
乙酸异戊酯中含有-COOR
D
N2与O2常温下不反应但在汽车内燃机高温下会反应
N2中稳定的N≡N在高温时被破坏
离子
Fe2+
Fe3+
Cu2+
Zn2+
开始沉淀的pH
7.5
1.9
4.2
6.2
沉淀完全的pH
9.6
3.2
6.7
8.2
物质
乙醇
苯甲酸
乙醚
苯甲酸乙酯
密度/ g⋅cm-3
0.7893
0.7318
1.0500
沸点/℃
78.5
249.0
34.5
212.0
相对分子质量
46
122
74
150
江西省上饶市第一中学2024届高三下学期模拟预测化学试题(Word版附解析): 这是一份江西省上饶市第一中学2024届高三下学期模拟预测化学试题(Word版附解析),文件包含2024届江西省上饶市信州区上饶市第一中学高三下学期模拟预测化学试题原卷版docx、2024届江西省上饶市信州区上饶市第一中学高三下学期模拟预测化学试题解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
2024届江西省上饶市信州区上饶市第一中学高三下学期模拟预测化学试题: 这是一份2024届江西省上饶市信州区上饶市第一中学高三下学期模拟预测化学试题,共22页。试卷主要包含了考试结束后,上交答题卡, 环己烷的制备原理如图等内容,欢迎下载使用。
江西省上饶市第一中学2024届高三下学期模拟预测化学试卷(PDF版附答案): 这是一份江西省上饶市第一中学2024届高三下学期模拟预测化学试卷(PDF版附答案),文件包含2024届高三模拟考试化学试卷-答案pdf、化学pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。












