





2025届高中化学全程复习构想课件全套54难溶电解质的溶解平衡
展开1. 了解难溶电解质的沉淀溶解平衡。2.理解溶度积(Ksp)的含义,能进行相关的计算。3.了解沉淀的生成、溶解与转化,并能应用化学平衡原理解释。
考点一 沉淀溶解平衡1.在20 ℃时,物质的溶解度与溶解性的关系2.沉淀溶解平衡(1)概念:在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
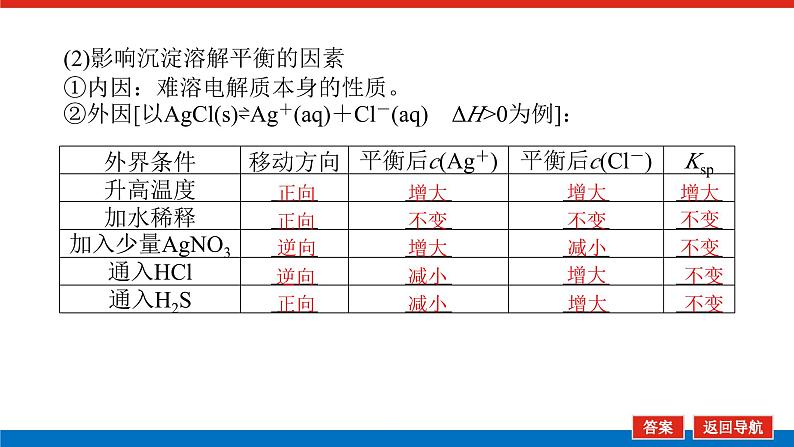
(2)影响沉淀溶解平衡的因素①内因:难溶电解质本身的性质。②外因[以AgCl(s)⇌Ag+(aq)+Cl-(aq) ΔH>0为例]:
【易错诊断】 判断正误,错误的说明理由。1.升高温度,沉淀溶解平衡一定正向移动:_________________________________________________________。2.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同:_________________________________________________________。3.难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动:_________________________________________________________。4.为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀:_________________________________________________________。
错误。沉淀溶解过程不一定是吸热的过程。
错误。NaCl电离出的Cl-抑制AgCl在水中的溶解,故相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的。
错误。难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,沉淀溶解平衡不移动。
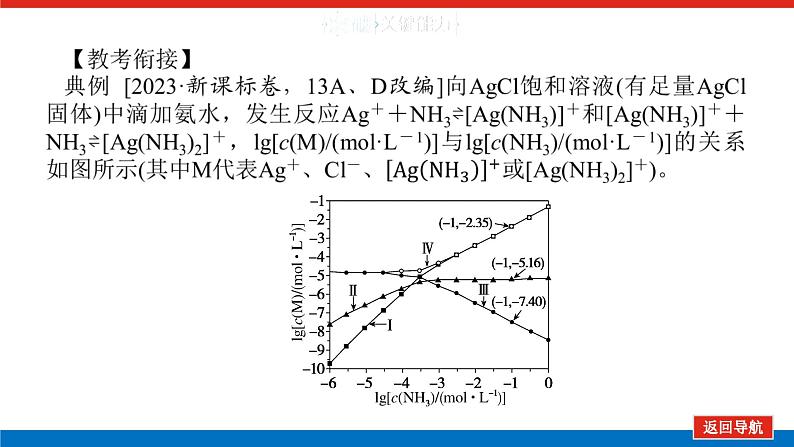
判断下列说法是否正确。(1)曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线。(2)c(NH3)=0.01 ml·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)。
解析:(1)氨的浓度较小时AgCl(s) ⇌Ag+(aq)+Cl-(aq),浓度较大时AgCl(s) +2NH3⇌[Ag(NH3)2]+(aq)+Cl-(aq),氯化银的溶解度曲线应与氯离子的曲线吻合,应该为曲线Ⅳ,故错误。(2)曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线,则c(NH3)=0.01 ml·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),故正确。答案:(1)错误 (2)正确
【解题思路】 氯化银饱和溶液中银离子和氯离子的浓度相等;向饱和溶液中滴加氨水,溶液中银离子浓度减小、氯离子浓度增大、一氨合银离子增大、AgCl的溶解度也增大;继续滴加氨水,一氨合银离子增大的幅度小于二氨合银离子,则曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子(AgCl的溶解度)随氨气浓度对数变化的曲线。
【对点演练】考向一 沉淀溶解平衡1.下列有关AgCl沉淀溶解平衡的说法中正确的是( )A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等B. AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度减小D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
解析:A项:沉淀溶解平衡是动态平衡,A项正确;B项:AgCl在水中存在溶解平衡,溶液中有极少量的Ag+和Cl-,B项错误;C项:通常固体的溶解度随温度的升高而增大(氢氧化钙等除外),C项错误;D项:加入NaCl固体,增大Cl-浓度,使AgCl(s)⇌Ag+(aq)+Cl-(aq)的平衡左移,析出氯化银沉淀,因此AgCl沉淀溶解的量减少,D项错误。
考向二 沉淀溶解平衡的实验探究3.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是( )A.①浊液中存在平衡:AgSCN(s)⇌Ag+(aq)+SCN-(aq)B.②中颜色变化说明上层清液中含有SCN-C.③中颜色变化说明有AgI生成D.该实验可以证明AgI比AgSCN更难溶
解析:A项,根据信息,白色沉淀是AgSCN,存在沉淀溶解平衡:AgSCN(s)⇌Ag+(aq)+SCN-(aq),故说法正确;B项,取上层清液,加入Fe3+出现红色溶液,说明生成Fe(SCN)3,说明溶液中含有SCN-,故说法正确;C项,AgI是黄色沉淀,现象是产生黄色沉淀,说明有AgI产生,故说法正确;D项,可能是c(I-)·c(Ag+)>Ksp,出现沉淀,故说法错误。
考点二 溶度积常数及其应用1.溶度积和离子积(1)以AmBn(s)⇌mAn+(aq)+nBm-(aq)为例。
(2)应用:在一定条件下,判断沉淀能否生成或溶解。①Q>Ksp:溶液过饱和,有________析出;②Q=Ksp:溶液饱和,处于________状态;③Q
【易错诊断】 判断正误,错误的说明理由。1.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度:_________________________________________________________。2.不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5 ml·L-1时,已经完全沉淀:_________________________________________________________。3.在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀:______________________________________________________。4.溶度积常数Ksp只受温度影响,温度升高,Ksp增大:_________________________________________________________。
错误。AB2与CD的离子个数比不同,不能直接用沉淀溶度积常数比较它们的溶解度。
错误。温度升高,有的溶度积常数Ksp增大,有的减小。
【对点演练】考向一 溶度能力大小的比较1.分别进行下列操作,由现象得出的结论正确的是( )
解析:生成的硫化氢会与硝酸银溶液反应生成硫化银沉淀,没有沉淀的转化,无法判断Ksp(AgCl)、Ksp(Ag2S)的大小,A错误;AgNO3溶液过量,KI直接与AgNO3反应,无法判断Ksp(AgCl)与Ksp(AgI)的大小关系,B错误;溶度积常数大的物质能转化为溶度积常数小的物质,AgI悬浊液中滴入Na2S溶液,固体变黑,Ag2S与AgI虽属于不同类型的沉淀,但Ksp(Ag2S)与Ksp(AgI)相差较大,故可以直接比较大小,说明Ksp(Ag2S)<Ksp(AgI),C错误;难溶的物质先沉淀出来,说明Ksp(CuS)<Ksp(ZnS),D正确。
考向二 有关溶度积的计算2.(能否沉淀) 25 ℃时,在1.00 L 0.03 ml·L-1 AgNO3溶液中加入0.50 L 0.06 ml·L-1的CaCl2溶液,能否生成AgCl沉淀?(已知:AgCl的Ksp=1.8×10-10)
3.(沉淀时的pH)常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20,计算有关Cu2+沉淀的pH。(1)某CuSO4溶液中c(Cu2+)=0.02 ml·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。(2)要使0.2 ml·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH为________。
5.(沉淀能否转化)Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,溶解能力:CaSO4大于CaCO3。请用数据说明溶解能力小的CaCO3能否转化为溶解能力大的CaSO4?
答案:(1)1.8×10-6(2)97.38%,计算过程见解析
考点三 沉淀溶解平衡的应用1.沉淀的生成(1)生成溶解能力小的难溶电解质,越小越好。(2)方法与实例
Cu2(OH)2CO3
3Ag2S+8HNO3(稀)===6AgNO3+2NO↑+3S+4H2O
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
3.沉淀的转化(1)原理:由一种沉淀转化为另一种沉淀的过程,实质是沉淀溶解平衡的移动。(2)应用实例①锅炉除垢:将CaSO4转化为CaCO3,离子方程式为:____________________________________________。②矿物转化:CuSO4溶液遇ZnS转化为CuS,离子方程式为:___________________________________________。
ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)
【教考衔接】典例 [2023·全国乙卷,13]一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
【对点演练】考向一 沉淀溶解平衡的应用1.可溶性钡盐有毒,医院中常用无毒硫酸钡作为内服“钡餐”造影剂。医院抢救钡离子中毒者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=5.1×10-9,Ksp(BaSO4)=1.1×10-10。下列推断正确的是( )A.不用碳酸钡作为内服造影剂,是因为碳酸钡比硫酸钡更难溶B.可以用0.36 ml·L-1的Na2SO4溶液给钡离子中毒者洗胃C.抢救钡离子中毒者时,若没有硫酸钠也可以用碳酸钠溶液代替D.误饮c(Ba2+)=1.0×10-5 ml·L-1的溶液时,会引起钡离子中毒
2.在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。已知:Cu+Cu2+⇌2Cu+ K=7.6×10-7;Ksp(CuCl)=2.0×10-6。(1)通过计算说明上述除Cl-的反应能完全进行的原因为___________。(2)若用Zn替换Cu可加快除Cl-的速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是________________________。
考向二 应用沉淀溶解平衡原理解释问题3.试用平衡移动原理解释下列事实。(1)BaCO3不溶于水,为什么不能作钡餐?(2)分别用等体积的蒸馏水和0.01 ml·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成AgCl的损失大于用稀盐酸洗涤的损失量。
2025届高中化学全程复习构想课件全套60卤代烃 醇 酚: 这是一份2025届高中化学全程复习构想课件全套60卤代烃 醇 酚,共52页。PPT课件主要包含了考点一,考点二,考点三,碳卤键,答案C,①④②③,答案B,ABD,答案D等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套44化学平衡移动: 这是一份2025届高中化学全程复习构想课件全套44化学平衡移动,共36页。PPT课件主要包含了考点一,考点二,答案C,x+y<z,不移动,p甲<p′甲<2p甲,p′乙=2p乙,p′丙=2p丙,降低温度,如图所示等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套22氨和铵盐: 这是一份2025届高中化学全程复习构想课件全套22氨和铵盐,共43页。PPT课件主要包含了考点一,考点二,实验室制法,碱石灰,湿润的红色石蕊,答案A,答案C,ace,Ⅱ或Ⅲ,NaOH等内容,欢迎下载使用。












