






所属成套资源:全套人教版高中化学必修第一册课时教学课件
人教版 (2019)必修 第一册实验活动3 同周期、同主族元素性质的递变多媒体教学ppt课件
展开这是一份人教版 (2019)必修 第一册实验活动3 同周期、同主族元素性质的递变多媒体教学ppt课件,共24页。PPT课件主要包含了变橙色,变褐色,Cl2Br2I2,ClBrI,浮在水面上,熔成小球,四处游动,发出响声,少量气泡,浅红色等内容,欢迎下载使用。
【实验目的】1.加深对同周期、同主族元素性质递变规律的认识。2.体会元素周期表和元素周期律在学习元素化合物知识中的重要作用。【实验仪器】试管、试管夹、试管架、量筒、胶头滴管、酒精灯、白色点滴板、镊子、砂纸、火柴。
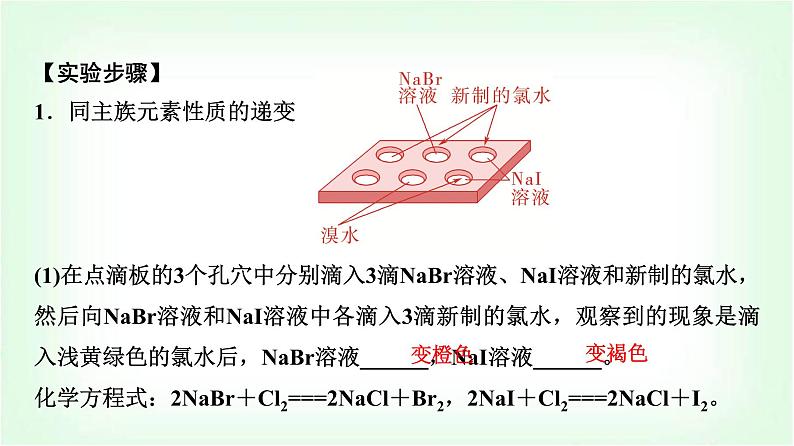
【实验步骤】1.同主族元素性质的递变 (1)在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和新制的氯水,然后向NaBr溶液和NaI溶液中各滴入3滴新制的氯水,观察到的现象是滴入浅黄绿色的氯水后,NaBr溶液______,NaI溶液______。化学方程式:2NaBr+Cl2===2NaCl+Br2,2NaI+Cl2===2NaCl+I2。
(2)在点滴板的两个孔穴中分别滴入3滴NaI溶液和溴水,然后向NaI溶液中滴入3滴溴水,观察到的现象是NaI溶液______。化学方程式:2NaI+Br2===2NaBr+I2。结论:卤素单质的氧化性:____________。卤族元素的非金属性:__________。
2.同周期元素性质的递变(1)钠、镁与水的反应①向盛有冷水的烧杯中加入一块绿豆粒大小的钠块,向盛有冷水的试管中加入一小块已用砂纸打磨好的镁条,并分别向烧杯和试管中滴入3滴酚酞溶液,观察到烧杯中钠__________,________,________,________,溶液变____,试管内镁条表面产生________,镁条周围溶液变为______。化学方程式:2Na+2H2O===2NaOH+H2↑、Mg+2H2O===Mg(OH)2+H2↑。
②向一支试管中加入少量冷水,并加入一小块已用砂纸打磨好的镁条,用酒精灯加热至沸腾,滴入3滴酚酞溶液,观察到的现象是____________________,溶液变为______。结论:与水反应的剧烈程度:__________,金属性:__________。镁与热水反应比与冷水反应快。
(2)Mg(OH)2、Al(OH)3的碱性强弱比较①向一支试管中加入少量MgCl2溶液,然后逐滴滴加2 ml·L-1 NaOH溶液直至过量,观察到的现象是____________。化学方程式:MgCl2+2NaOH===Mg(OH)2↓+2NaCl。②向另一支试管中加入少量AlCl3溶液,然后逐滴滴加2 ml·L-1 NaOH溶液直至过量,观察到的现象是___________________________________。
先产生白色沉淀,后白色沉
Mg(OH)2>Al(OH)3
【问题和讨论】1.实验中所用氯水为什么要用新制的?
提示:氯水中存在反应:Cl2+H2O⥫⥬HCl+HClO,氯水久置,HClO会发生分解,会使更多的Cl2与水反应,最终久置的氯水会变为稀盐酸,没有氯气分子。
2.通过本实验活动,你对原子结构与元素性质的关系及元素周期律(表)有什么新的认识?
提示:结构决定性质,同周期或同主族元素的原子半径呈现周期性变化,故元素的性质也呈现周期性变化。
3.为了比较氯元素与碳元素的非金属性强弱,可否用盐酸与碳酸钠反应生成二氧化碳,得出非金属性氯大于碳?原因是什么?
提示:否,比较非金属性强弱应该比较最高价氧化物对应水化物的酸性强弱,而盐酸是HCl的水溶液,不是氯元素的最高价氧化物对应水化物的水溶液。
【针对训练】1.下列各组物质性质比较不正确的是( )A.酸性强弱:HClO4<HBrO4<HIO4B.碱性强弱:Mg(OH)2<NaOH<KOHC.还原性:Al<Mg<NaD.单质与氢气化合由易到难的顺序:Cl2、S、P、Si
A [HClO4、HBrO4、HIO4均为非金属元素最高价氧化物对应的水化物,因非金属性:Cl>Br>I,故酸性:HClO4>HBrO4>HIO4,故A符合题意;因金属性:K>Na>Mg,故其最高价氧化物对应水化物的碱性:Mg(OH)2<NaOH<KOH,故B不符合题意;Al、Mg、Na为同周期主族元素,根据元素周期律可知,还原性:Al<Mg<Na,故C不符合题意;Cl、S、P、Si为同周期主族元素,根据元素周期律可知,非金属性:Cl>S>P>Si,故其单质与氢气化合由易到难的顺序:Cl2、S、P、Si,故D不符合题意。]
2.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
B [同主族金属元素从上到下元素的金属性逐渐增强,与水反应剧烈程度增强。元素的金属性:Ba>Ca>Mg,故可根据Ca与水反应较快推知Ba与水反应会更快,A正确;半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,而C和Pb不能作半导体,所以第ⅣA族元素并不都是半导体材料,B错误;同主族元素从上到下元素的非金属性逐渐减弱,元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:Cl>Br>I,所以HBr的稳定性介于HCl、HI之间,其分解温度介于二者之间,C正确;同周期主族元素的非金属性从左到右逐渐增强,元素的非金属性越强,其单质与H2化合就越容易,元素的非金属性:S>P>Si,所以可根据Si与H2高温时反应,S与H2加热能反应推知P与H2在高温时能反应,D正确。]
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
由实验1和实验2得出的结论是:金属性__________>_________>________(填元素符号),用原子结构理论解释:同周期主族元素从左到右,____________________________________________。
原子半径逐渐减小,失电子能力逐渐减弱
4.甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。实验室提供的试剂:NaBr溶液、NaI溶液、新制的氯水(1)探究同主族元素性质的递变规律。①写出下列实验报告中的实验现象和离子方程式。
2Br-+Cl2===Br2+2Cl-
2I-+Cl2===I2+2Cl-
②[评价]甲同学设计的实验方案的合理性是________(填字母)。A.非常合理 B.部分合理 C.完全不合理③[补充和完善]上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是________。
(2)下表是元素周期表中主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
请回答下列问题:①写出Z的原子结构示意图:_________________。②由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:____________________。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律实验活动3 同周期、同主族元素性质的递变说课ppt课件,共13页。PPT课件主要包含了滴入浅黄绿色的氯水,后NaBr溶液呈橙,向NaI溶液中滴,入橙色的溴水后,溶液变褐色,NaCl+Br2,NaCl+I2,NaBr+I2,加热至沸腾后有较,多的无色气泡冒出等内容,欢迎下载使用。
这是一份化学必修 第一册实验活动3 同周期、同主族元素性质的递变图文课件ppt,共11页。PPT课件主要包含了Cl2Br2I2,I-Br-Cl-,ClBrI,MgOH2,AlOH3等内容,欢迎下载使用。
这是一份浙江专用高中化学实验活动3同周期同主族元素性质的递变课件新人教版必修第一册2,共9页。













