
高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃导学案
展开
这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃导学案,共4页。
[课标要求目标]
1.了解烯烃的顺反异构及二烯烃的加成反应,理解烯烃的结构与化学性质。
2.依据烷烃的物理性质递变规律,掌握烯烃的物理性质的变化规律;通过烯烃的结构特征,分析掌握烯烃的化学性质。
[重点难点]烯烃的结构和化学性质
[教学过程]
一、烯烃的结构和性质
1.结构特点
(1)烯烃的官能团是____________(_______________)。
乙烯是最简单的烯烃。
(2)乙烯的结构特点
2.通式:
单烯烃的通式为________(n≥2)
3.物理性质
(1)常温常压下的状态:碳原子数≤4的烯烃为_________,其他为______________。
(2)熔、沸点:随着分子中碳原子数的增加,烯烃的熔、沸点逐渐_________;相同碳原子数时,支链越多,熔沸点________。
(3)密度:相对密度逐渐________,但相对密度均小于1。
(4)溶解性:都难溶于水,________溶于有机溶剂。
4.化学性质:
(1)氧化反应:
①能使酸性KMnO4溶液褪色,常用于的检验。
②燃烧:火焰明亮,并伴有黑烟,其燃烧通式为:CnH2n+eq \f(3n,2)O2eq \(—→,\s\up7(点燃))nCO2+nH2O。
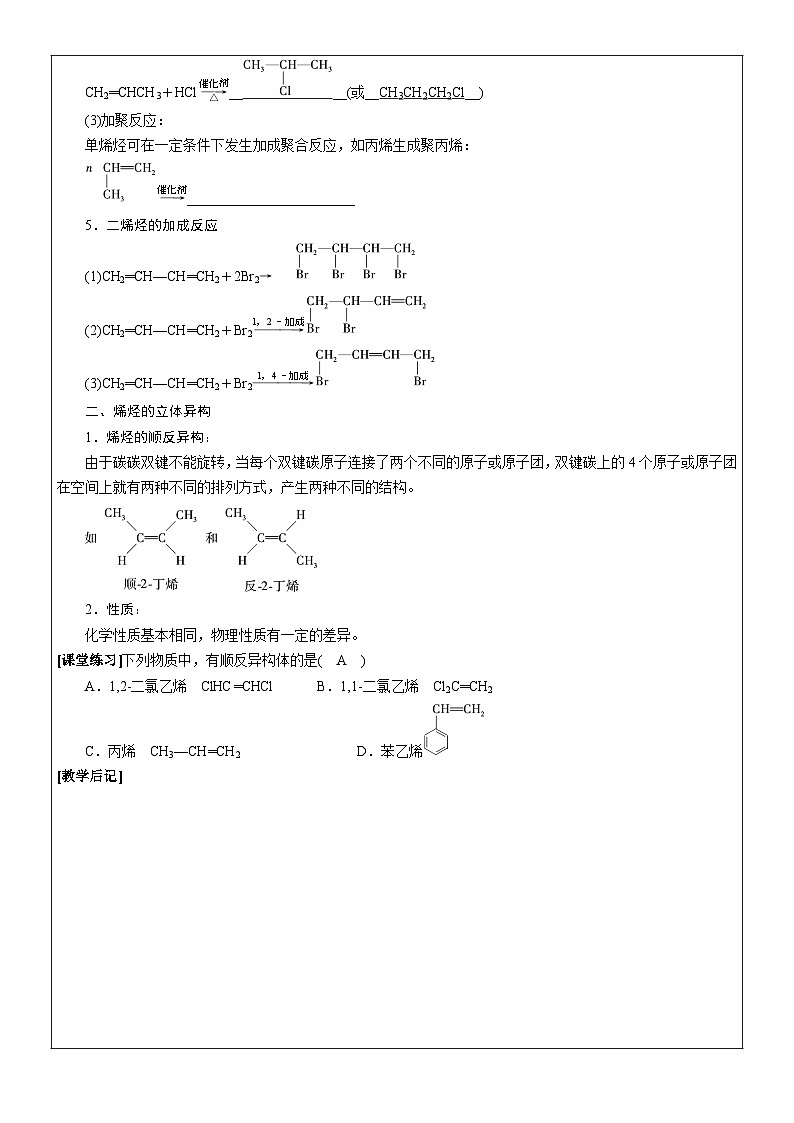
(2)加成反应:
烯烃可以与X2、HX(X表示卤素)、H2、H2O等在一定条件下发生加成反应。例如:
CH2═CH—CH3+Br2―→_______________________
CH2═CH2+H2Oeq \(————→,\s\up7(催化剂),\s\d5(加热、加压))____________________
CH2═CHCH3+H2Oeq \(————→,\s\up7(催化剂),\s\d5(加热、加压))____(或____)
CH2═CHCH3+HCleq \(—→,\s\up7(催化剂),\s\d5(△))____(或__CH3CH2CH2Cl__)
(3)加聚反应:
单烯烃可在一定条件下发生加成聚合反应,如丙烯生成聚丙烯:
eq \(—→,\s\up7(催化剂))________________________
5.二烯烃的加成反应
(1)CH2═CH—CH═CH2+2Br2→
(2)CH2═CH—CH═CH2+Br2eq \(———→,\s\up7(1,2-加成))
(3)CH2═CH—CH═CH2+Br2eq \(————→,\s\up7(1,4-加成))
二、烯烃的立体异构
1.烯烃的顺反异构:
由于碳碳双键不能旋转,当每个双键碳原子连接了两个不同的原子或原子团,双键碳上的4个原子或原子团在空间上就有两种不同的排列方式,产生两种不同的结构。
2.性质:
化学性质基本相同,物理性质有一定的差异。
[课堂练习]下列物质中,有顺反异构体的是( A )
A.1,2-二氯乙烯 ClHC═CHCl B.1,1-二氯乙烯 Cl2C═CH2
C.丙烯 CH3—CH═CH2 D.苯乙烯
[教学后记]
第二章 烃
第二节 烯烃 炔烃(第2课时)
[课标要求目标]
1.以乙炔为例,掌握炔烃的结构与性质
2.掌握乙炔的实验室制法
[重点难点]炔烃的结构与性质
[教学过程]
一、乙炔的结构和性质
1.结构特点
2.物理性质:____色、____味的气体,___溶于水,____溶于有机溶剂。
3.化学性质
(1)氧化反应
能使酸性KMnO4溶液褪色;在空气中燃烧火焰明亮,并伴有浓烈黑烟。乙炔燃烧的化学方程式:
2C2H2+5O2eq \(—→,\s\up7(点燃))4CO2+2H2O。
(2)加成反应
①与Br2加成
C≡C+Br2―→__________________________
C≡C+2Br2―→_____________________________
②与H2加成
C≡C+H2eq \(—→,\s\up7(催化剂),\s\d5(△))__________________
C≡C+2H2eq \(—→,\s\up7(催化剂),\s\d5(△))___________________
③与HCl加成
________________________________________________
④与H2O反应(制乙醛)
______________________________
(3)加聚反应
____________________________________
4.实验室制法
实验室常用下图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
(1)写出电石(碳化钙CaC2)与水反应制取乙炔的化学方程式:
___________________________________________________
(2)装置A的作用是___________________,防止H2S等气体干扰乙炔性质的检验,装置B中的现象是_________________,装置C中的现象是________________________。
二、炔烃的结构和性质
1.结构特点
炔烃的官能团是_____________(_____________),结构和乙炔相似。
2.通式
单炔烃的通式为CnH2n-2(n≥2)
3.物理性质
炔烃的物理性质与烷烃和烯烃相似,沸点随碳原子数的递增而逐渐升高。
4.化学性质
炔烃的化学性质和乙炔相似,能发生加成反应、加聚反应和氧化反应。
5.命名与烯烃命名方法相同,称为某炔。如
命名为__4-甲基-1-戊炔__。
[课堂练习]如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( A )
A.将生成的气体直接通入溴水中,溴水褪色,说明有乙炔生成
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.逐滴加入饱和食盐水可控制生成乙炔的速率
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
[教学后记]
碳原子杂化方式
C—H键成分
C═C键成分
相邻两个键之间的键角
分子空间结构
_______化
__键
1个σ键和1个_π键
约为____
分子中所有原子都处于______________
分子式
电子式
结构式
结构简式
_________
_________
____________
____________
碳原子杂化方式
C—H键成分
C≡C键成分
相邻两个键之间的键角
分子空间结构
_______杂化
_______键__
1个___键和2个___键
_________
_______结构
相关学案
这是一份化学选择性必修3第二节 烯烃 炔烃优秀学案,共6页。学案主要包含了学习目标,学习重点,学习难点,课前预习,课中探究,学生活动1,学生活动2,典型例题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃优秀学案及答案,文件包含人教版2019高中化学选修3精品讲义第04讲烯烃炔烃教师版docx、人教版2019高中化学选修3精品讲义第04讲烯烃炔烃学生版docx等2份学案配套教学资源,其中学案共27页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修3第二节 烯烃 炔烃学案,共12页。









