





化学选修4 化学反应原理第3章 物质在水溶液中的行为第1节 水溶液授课ppt课件
展开1.了解水溶液的酸碱性与溶液中c平(H+)和c平(OH-)的关系,培养宏观辨识与微观探析的化学核心素养。2.知道pH的定义,了解水溶液的酸碱性与pH的关系。能够进行有关pH的简单计算,形成证据推理与模型认知的化学核心素养。
基础落实•必备知识全过关
重难探究•能力素养全提升
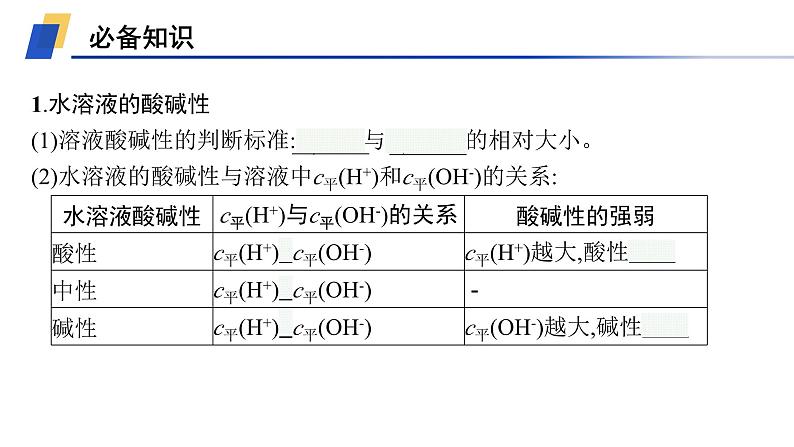
1.水溶液的酸碱性(1)溶液酸碱性的判断标准:c平(H+)与c平(OH-)的相对大小。(2)水溶液的酸碱性与溶液中c平(H+)和c平(OH-)的关系:
2.水溶液的pH(1)pH的定义公式:pH=-lgc平(H+)。(2)室温下,水溶液pH与溶液酸碱性的关系:
【微点拨】pH<7的溶液不一定是酸性溶液;pH>7的溶液不一定是碱性溶液;pH=7的溶液也不一定是中性溶液。如在某温度下,水的离子积常数为1×10-12 ml2·L-2,此时pH=6的溶液为中性溶液,pH>6的溶液为碱性溶液,pH<6的溶液为酸性溶液。
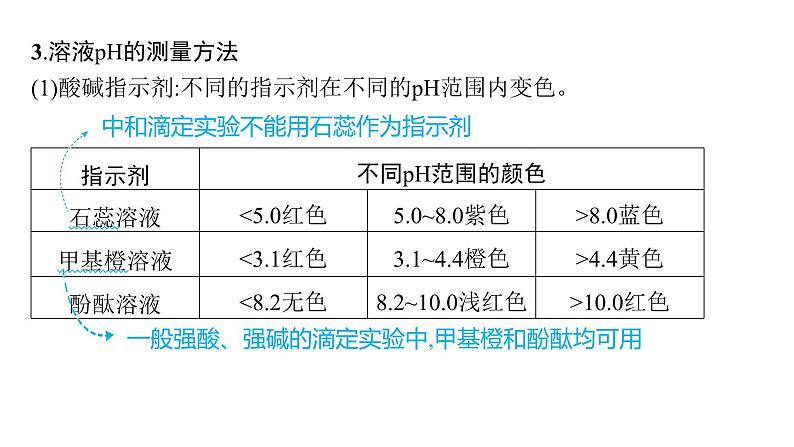
3.溶液pH的测量方法(1)酸碱指示剂:不同的指示剂在不同的pH范围内变色。
中和滴定实验不能用石蕊作为指示剂
一般强酸、强碱的滴定实验中,甲基橙和酚酞均可用
(2)pH试纸:将pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取待测溶液点在pH试纸的中部,待颜色变化稳定后对照标准比色卡可以得到溶液的pH,所得pH均为正整数。(3)酸度计:能够直接测量溶液的pH,读数可以精确到小数点后两位。
【微思考】某同学用pH试纸测得某硫酸溶液的pH为4.2,该同学的结论正确吗?提示 不正确。用pH试纸测定pH时,只能读取整数值。
判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)升高温度,水的电离平衡向电离方向移动,c平(H+)增大,溶液呈酸性。( )(2)任何温度下,利用溶液中c平(H+)和c平(OH-)的相对大小判断溶液的酸碱性。( )(3)4 ℃时,纯水的pH=7。( )(4)1.0×10-3 ml·L-1盐酸的pH=3.0,1.0×10-8 ml·L-1盐酸的pH=8.0。( )(5)100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性。( )(6)pH=4.5的番茄汁中c平(H+)是pH=6.5的牛奶中c平(H+)的100倍。( )
探究一 溶液酸碱性的判断方法
土壤的酸碱性直接影响植物的生长发育,如浙江的“龙井茶”只能生长于弱酸性的土壤中。可以用pH试纸测定pH,判断土壤的酸碱性。
1.如何使用pH试纸测定溶液的pH?提示 用镊子取一小片试纸放于玻璃片上,用蘸有待测液的玻璃棒点在试纸中央,变色后与标准比色卡对照可确定其pH。2.用pH试纸测pH时,若先用蒸馏水润湿,可能有什么结果?提示 用蒸馏水润湿,相当于将溶液稀释,若是酸性溶液,则c平(H+)变小,pH偏大;若是碱性溶液,则c平(OH-)变小,pH偏小;若是中性溶液,则c平(H+)和c平(OH-)不变,pH不变。
水溶液的酸碱性与c平(H+)、c平(OH-)以及pH的关系
【微点拨】pH越小,酸性越强;pH越大,碱性越强。
视角1 判断溶液的酸碱性1.下列说法正确的是( )A.pH=7的溶液一定显中性B.室温下由水电离的c水(OH-)为1×10-8 ml·L-1的溶液一定呈酸性C.c平(H+)
规律方法 溶液酸碱性的判断依据
2.某温度时水的离子积常数为1×10-12 ml2·L-2,若该温度下某溶液中c平(H+)=1×10-7 ml·L-1,则该溶液( )A.呈碱性B.呈酸性C.呈中性D.c平(OH-)=10c平(H+)
解析 溶液中c平(OH-)= ml·L-1=1×10-5 ml·L-1,c平(OH-)>c平(H+),溶液呈碱性。
3.下列溶液一定呈中性的是( )A.pH=7的溶液B.c平(H+)=c平(OH-)=10-6 ml·L-1的溶液C.使石蕊溶液呈紫色的溶液D.酸与碱恰好完全反应生成正盐的溶液
解析 pH=7的溶液不一定呈中性,故A错误;c平(H+)=c平(OH-)=10-6 ml·L-1的溶液,氢离子浓度与氢氧根离子浓度相等,溶液一定呈中性,故B正确;使石蕊溶液呈紫色的溶液,室温下溶液可能呈酸性,故C错误;CO2与NaOH恰好反应生成的Na2CO3溶液呈碱性,故D错误。
视角2 pH试纸的使用4.关于pH的测定,下列说法正确的是( )A.用pH试纸测定溶液的pH,在使用之前应用蒸馏水润湿B.用pH试纸测得某氢氧化钠溶液的pH=10.6C.利用酸、碱指示剂可以测溶液的pHD.pH计是精确测定溶液pH的仪器
解析 用pH试纸测定溶液的pH时不能用水润湿,A错误;pH试纸的测量结果只能是整数,B错误;酸碱指示剂只能测定溶液的酸碱性,不能测定溶液的pH,C错误;pH计能够精确测定溶液的pH,D正确。
相同温度时,pH=10的NaOH溶液与pH=12的NaOH溶液等体积混合,混合后的c平(H+)是否为 ml·L-1?
1.单一溶液的pH计算(1)强酸溶液,如HnA溶液,设溶质的物质的量浓度为c ml·L-1,c平(H+)=nc ml·L-1,pH=-lgc平(H+)=-lgnc。(2)强碱溶液,如B(OH)n溶液,设溶质物质的量浓度为c ml·L-1,c平(H+)= ml·L-1,pH=-lgc平(H+)=14+lgnc。
3.酸、碱稀释后溶液pH的计算
应用体验视角1 溶液pH的计算1.室温下,将0.1 ml·L-1 NaOH溶液与0.04 ml·L-1 H2SO4溶液等体积混合,该混合溶液的pH等于( )A.1.7D.12.4
解析 由题意知反应后NaOH过量,混合溶液中的c平(OH-)= =0.01 ml·L-1,故混合溶液的pH=12。
2.在常温下,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近( )A.8+lg 2B.9-lg 2C.9D.10-lg 2
解析 两种碱溶液混合,混合后溶液中c平(OH-)接近0.5×10-4 ml·L-1,故c平(H+)会接近2×10-10 ml·L-1,pH≈10-lg 2,故答案选D。
3.室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,则强碱溶液与强酸溶液的体积比是( )A.11∶1B.9∶1C.1∶11D.1∶9
解析 可设碱溶液与酸溶液的体积分别为V(碱) L和V(酸)L,由题意可知,混合后碱过量,可列等式: =10-(14-11),解之可得V(碱)∶V(酸) =1∶9。
4.(1)室温下0.01 ml·L-1 HCl溶液:①由水电离出的c水(H+)= ; ②溶液的pH= ; ③加水稀释到体积为原来的100倍,pH= 。
1.0×10-12 ml·L-1
(2)室温下0.01 ml·L-1 NaOH溶液:①溶液的pH= ; ②加水稀释到体积为原来的100倍,pH= 。
易错警示 计算溶液pH时注意的几个问题(1)温度是否为25 ℃。(2)水电离出来的c水(H+)何时忽略不计,何时不能忽略。(3)两种pH不同的碱溶液混合时,由于两碱溶液中水的电离程度不同,所以混合后溶液中水的电离平衡必发生移动,因此不可将两溶液中的H+的物质的量相加得到混合溶液中H+的物质的量。
视角2 溶液的酸、碱性与pH的关系5.25 ℃时,a ml·L-1一元酸HA的溶液与b ml·L-1 NaOH溶液等体积混合,充分反应后溶液的pH=7,则下列关系一定正确的是( )A.a=bB.a>bC.c平(A-)=c平(Na+)D.c平(A-)
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液图片ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液图片ppt课件,共52页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,玻璃片或表面皿上,标准比色卡,答案BD,答案C,答案CD,答案D等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课内容课件ppt,共43页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,溶质分子或离子,溶剂分子,水合离子,水合分子,答案A,答案AD等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课课件ppt,共38页。PPT课件主要包含了内容索引,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案D,答案C等内容,欢迎下载使用。













