











高中化学沪科技版(2020)选择性必修14.1氧化还原反应精品ppt课件
展开1.通过对氧化反应、还原反应的相关概念和实质的学习,培养宏观辨识与微观探析的化学学科核心素养。2.通过对氧化还原反应的特征——元素化合价的升降的理解,体会氧化还原反应的实质——电子的转移,培养变化观念与平衡思想的化学学科核心素养。3.会判断常见的氧化剂和还原剂,会比较物质氧化性或还原性的强弱,培养证据推理与模型认知的化学学科核心素养。4.学会氧化还原反应的配平原则和基本方法,建立配平氧化还原反应方程式的思维模型。
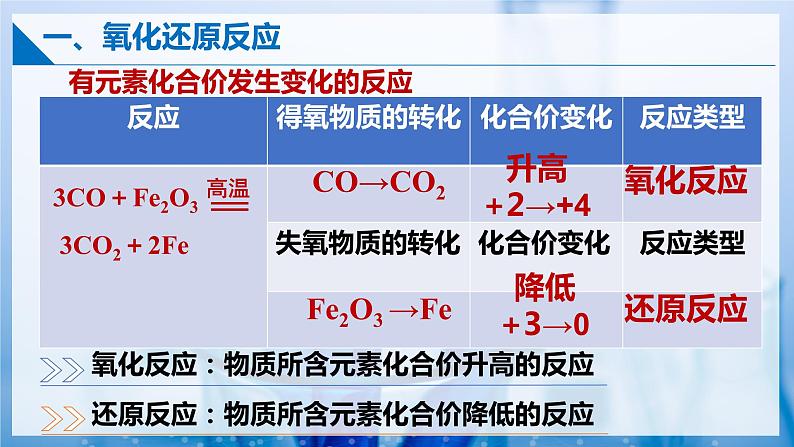
有元素化合价发生变化的反应
3CO+Fe2O3 3CO2+2Fe
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
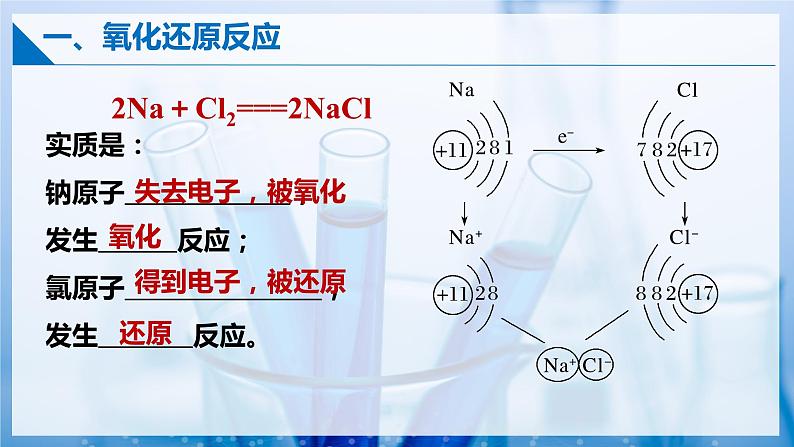
2Na+Cl2===2NaCl
实质是:钠原子 ,发生 反应;氯原子 ,发生 反应。
氧化还原反应中元素化合价发生变化的实质
氧化剂:所含元素得到电子(或电子对偏向)的反应物。
还原剂:所含元素失去电子(或电子对偏离)的反应物。
氧化产物:还原剂失去电子被氧化的产物
还原产物:氧化剂得到电子被还原的产物
CuSO4+Zn =ZnSO4+Cu
(元素化合价升高)生成物
(元素化合价降低)生成物
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
降得还原氧化剂 升失氧化还原剂
氧化性:物质得电子的性质或能力
还原性:物质失电子的性质或能力
氧化还原反应自发进行的方向,总是由氧化性较强的氧化剂与还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。
Cu2+ 强于 Zn2+
Zn -2e-=Zn2+
Cu2++2e- =Cu
氧化还原反应本质上是两个半反应之间竞争电子的反应。
书写半反应式时,除了应该考虑在反应中存在电子转移的元素所在的物质得失电子的情况外,还必须考虑这些元素形成的物质在溶液中的主要存在形式,应该遵循离子方程式的书写要求。
Pb+SO4 2--2e-=PbSO4
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
Pb+PbO2+2H2SO4 = 2PbSO4 +2H2O
得电子数等于失电子数——电子守恒
得电子数=化合价降低的原子个数×化合价差值=1×2e-=2e-(1代表化合价变化的Mn个数,2代表化合价差值)
失电子数=化合价升高的原子个数×化合价差值=2×1e-=2e-(2代表化合价变化的Cl个数,1代表化合价差值)
H2O2+ 2Fe2+ + 2H+ = 2H2O + 2Fe3+
例2:在稀酸条件下,过氧化氢可与2Fe2+反应,请写出离子方程式,并写出其半反应式。
H2O2+ 2H+ + 2e- = 2H2O
2Fe2+ - 2e- = 2Fe3+
三、氧化还原反应化学方程式的配平
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:还原剂失电子的总数=氧化剂得电子的总数。元素化合价降低的总数=元素化合价升高的总数。应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
配平步骤:① 标出化合价有变化的元素,以元素化合价升高和降低总数相等为原则,乘以适当的系数
MnO4- + Fe2+ + H+ = Mn2+ + Fe3+ + H2O
② 配平氧化剂、还原剂、还原产物和氧化产物
1 MnO4- + 5 Fe2+ + H+ = 1 Mn2+ + 5 Fe3+ + H2O
1 MnO4- + 5 Fe2+ + 8 H+ = 1 Mn2+ + 5 Fe3+ +4 H2O
____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+__H2O
____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
氧化反应还原反应氧化剂还原剂氧化产物还原产物
沪科技版(2020)选择性必修1第2章 化学反应的方向、限度和速率2.3化学反应的速率化学反应速率优秀课件ppt: 这是一份沪科技版(2020)选择性必修1<a href="/hx/tb_c4036433_t3/?tag_id=26" target="_blank">第2章 化学反应的方向、限度和速率2.3化学反应的速率化学反应速率优秀课件ppt</a>,文件包含23化学反应速率同步课件pptx、23化学反应速率分层练习原卷版-docx、23化学反应速率分层练习解析版-docx等3份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
化学选择性必修1化学平衡的移动优秀课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4036431_t3/?tag_id=26" target="_blank">化学平衡的移动优秀课件ppt</a>,文件包含222化学平衡的移动同步课件pptx、222化学平衡的移动分类练习原卷版docx、222化学平衡的移动分类练习解析版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
化学沪科技版(2020)化学平衡常数优秀课件ppt: 这是一份化学沪科技版(2020)<a href="/hx/tb_c4036430_t3/?tag_id=26" target="_blank">化学平衡常数优秀课件ppt</a>,文件包含221化学平衡常数同步课件pptx、221化学反应的限度化学平衡常数分层练习-原卷版docx、221化学反应的限度化学平衡常数分层练习-解析版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。













