











沪科技版(2020)必修第一册黑火药中的硫黄教课内容ppt课件
展开硫在古代中国被列为重要的药材,在中国古代第一部药物学专著《神农本草经》中所记载的46种矿物药品中,就有石硫黄(即硫磺)。在这部著作里还指出:“石硫黄能化金银铜铁,奇物”。这说明当时已经知晓硫能与铜、铁等金属直接作用而生成金属硫化物。在东晋炼丹家葛洪的《抱朴子内篇》中也有“丹砂烧之成水银,积变又还成丹砂”的记载。中国对火药的研究,大概始于公元七世纪。当时的火药是黑火药,它是由硝酸钾、硫磺和木炭三者组成。
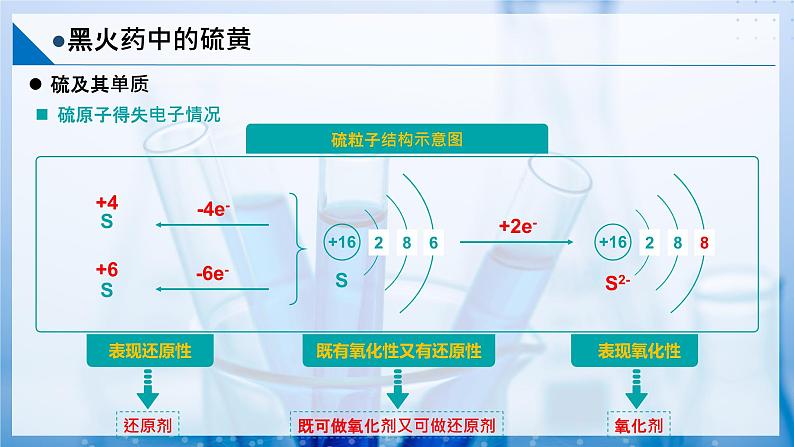
硫在自然界中既能以单质的形式存在又能以化合物的形式存在。
在岩层深处和海底的无氧环境下,硫元素通常以硫化物的形式存在;地表附近,由于受氧气和水的长期作用,硫化物会转化为硫酸盐。
硫的密度比水大,为2.06gcm-3
常温下,黄色晶体,质脆,易研成粉末
难溶于水、微溶于酒精、易溶于二硫化碳(CS2)
熔点为113°C,沸点445°C
硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。
与Fe反应:_________________;
与Cu反应:__________________;
与H2反应:_________________;
标准状况下是一种无色易燃的酸性气体,剧毒
低浓度时有臭鸡蛋气味,浓度极低时有硫磺味,浓度高时反而没有气味(可以麻痹嗅觉神经)
20℃时1体积水能溶解2.6体积的硫化氢,水溶液为氢硫酸,酸性较弱,比碳酸弱
特性:Hg、Ag在常温下不跟氧气反应,但易跟S反应,生成高价化合物。
与Hg反应:__________________;
与Ag反应:__________________;
硫的氧化物——二氧化硫
观察实验桌上的二氧化硫气体,总结二氧化硫的物理性质
通过之前的学习,我们知道:通常情况下,二氧化碳能溶于水(体积比1:0.759) ,那么,二氧化硫是否易溶于水?请设计一个实验来证明。
实验步骤 把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的变化情况。
SO2 溶于水
液面迅速 ,最后充满试管。
实验步骤 待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度。
二氧化硫溶于水时可与水反应生成亚硫酸
向生成物方向进行的反应——正反应
向反应物方向进行的反应——逆反应
实验步骤 用试管取2 mL上述实验中得到的溶液,向其中滴入 1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
加入品红后,溶液变成_______,振荡后_________________,再加热溶液_______________
SO2具有漂白性,但生成的无色物质不稳定
二氧化硫的漂白作用是由于它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质若加热,容易分解而使有色物质恢复原来的颜色。
溶液很快变成红色,但不褪色
溶液立即变红,随后褪色
不同,氯气使品红溶液褪色是因为氯气与水反应生成的次氯酸具有强氧化性,可以将有色物质氧化成无色物质,此过程是不可逆的,而二氧化硫使品红溶液褪色是可逆的。若将等物质的量的氯气和二氧化硫气体相混合后,在溶液中发生反应SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
高价氧化,低价还原,中间价态两边转
SO2中的化合价是+4价,故SO2既有氧化性,又有还原性
如KMnO4 ,K2Cr2O4 ,H2O2 ……
说明:发生歧化反应,此时二氧化硫做氧化剂,硫化氢作还原剂说明二氧化硫的氧化性。
标准状况下为____体
硫的氧化物——三氧化硫
熔沸点较低(16.8)、沸点(44.8),具有强刺激性臭味。
三氧化硫具有酸性氧化物的通性,主要反应如下:
和碱性氧化物(CaO)
密度大(ρ=1.84g/cm3,ω=98.3%,c=18.4ml/L)
高沸点(338℃ )——难挥发
极易溶于水,能与水以任意比混溶
(溶解时放出大量的热)
硫酸是强酸,电离方程式:________________________
浓硫酸的特性——归纳总结
浓硫酸还具有很强的氧化性,能氧化大多数金属单质和部分非金属单质。
铜丝表面__________
紫色石蕊溶液变为____
溶液__________
铜和浓硫酸反应的化学方程式:
常温下,铁遇到浓硫酸会发生钝化。在表面形成一层致密的氧化膜,从而阻止进一步的反应,不会腐蚀。
注意:常温下,与浓硫酸接触发生钝化的金属还有:铝!
H2SO4+xH2O H2SO4·xH2O
1.实验探究在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
2.实验结论在溶液中,SO42-可与Ba2+反应,生成不溶于稀盐酸的白色BaSO4沉淀。反应的离子方程式为Ba2++SO42-=== BaSO4↓。3.检验SO42-的正确操作方法:
先加稀盐酸的目的是排除CO32-、SO32-、Ag+干扰
1. 除去试管壁上的附着的硫,可采用的方法是( )A.通入氢气后加热 B.伸入灼热的铁丝C.用水洗涤 D.用二硫化碳洗涤后再用水洗
【答案】D【解析】硫与氢气反应需要加热,实验操作复杂,且产物硫化氢有毒;硫与铁反应需要加热,其产物硫化亚铁固体会附着在试管壁上;硫不溶于水,微溶于酒精,易溶于二硫化碳,试管壁上的硫可用二硫化碳溶解而除去。
2.下列说法不正确的是( )A.硫是一种难溶于水的黄色固体B.硫与铁反应生成硫化亚铁C.单质硫既有氧化性,又有还原性D.硫在过量纯氧中的燃烧产物是三氧化硫
【答案】D【解析】硫单质或含硫物质在空气中燃烧时应生成SO2,而不能直接生成SO3。
3.下列物质中,不能由单质直接化合生成的是( )①CuS ②FeS ③SO3 ④H2S ⑤FeCl2A.①③⑤ B.①②③⑤ C.①②④⑤ D.全部
【答案】A【解析】 ①硫的氧化性较弱,和变价金属反应生成低价态金属化合物,硫和铜反应生成Cu2S;②硫和铁反应能生成FeS;③硫和氧气反应生成SO2而不是SO3;④硫和氢气反应生成H2S;⑤氯气的氧化性较强,和变价金属反应生成高价态金属化合物,氯气和铁反应生成FeCl3。
4.下列变化可以说明SO2具有漂白性的是( )A.SO2通入溴水中,溴水褪色B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去C.SO2通入品红溶液中,溶液的红色褪去D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
5.下列有关SO3的说法中正确的是( )A.SO3极易溶于水,且与水反应生成H2SO4B.标准状况下,1 ml SO3的体积约为22.4 LC.硫粉在过量的纯氧中燃烧可以生成SO3D.SO2、SO3均具有漂白性,均能使紫色石蕊溶液褪色
6.向盛有下列溶液的试管中分别通入SO2气体:①紫色石蕊溶液;②NaOH溶液(滴有酚酞溶液);③品红溶液;④溴水。请回答下列问题:(1)试管①中的现象是_________________,发生反应的化学方程式:____________________。
(2)试管②中的现象是__________,发生反应的化学方程式为______________________________,若继续通入过量的SO2,则发生反应的化学方程式为_____________________________。
Na2SO3+SO2+H2O===2NaHSO3
===Na2SO3+H2O
(3)试管③中的现象是______________,若将吸收SO2的溶液加热,现象是_____________。
(4)试管④中的现象是__________。
(5)上述实验,SO2表现出酸性氧化物性质的是_____(填序号,下同),SO2表现出漂白性的是____,SO2表现出还原性的是____。
高中化学沪科技版(2020)必修第一册自然界中的硫循环优质课课件ppt: 这是一份高中化学沪科技版(2020)必修第一册<a href="/hx/tb_c4025843_t3/?tag_id=26" target="_blank">自然界中的硫循环优质课课件ppt</a>,文件包含33硫循环和氮循环同步课件pptx、33硫循环和氮循环分层练习原卷版docx、33硫循环和氮循环分层练习解析版docx等3份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
高中化学固氮评优课ppt课件: 这是一份高中化学<a href="/hx/tb_c4025840_t3/?tag_id=26" target="_blank">固氮评优课ppt课件</a>,文件包含32氮及其重要化合物同步课件pptx、32氮及其重要化合物分层练习原卷版docx、32氮及其重要化合物分层练习解析版docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
2023届高中化学一轮复习课件:硫及其重要化合物: 这是一份2023届高中化学一轮复习课件:硫及其重要化合物,共58页。PPT课件主要包含了硫化物,硫酸盐,FeS2,CuFeS2,CaSO4·2H2O,有刺激性,品红溶液,检验SO2,酸性KMnO4溶液,澄清石灰水等内容,欢迎下载使用。













