




第四章 第十二讲 碳酸钠和碳酸氢钠 碱金属-2025年高考化学一轮总复习课件
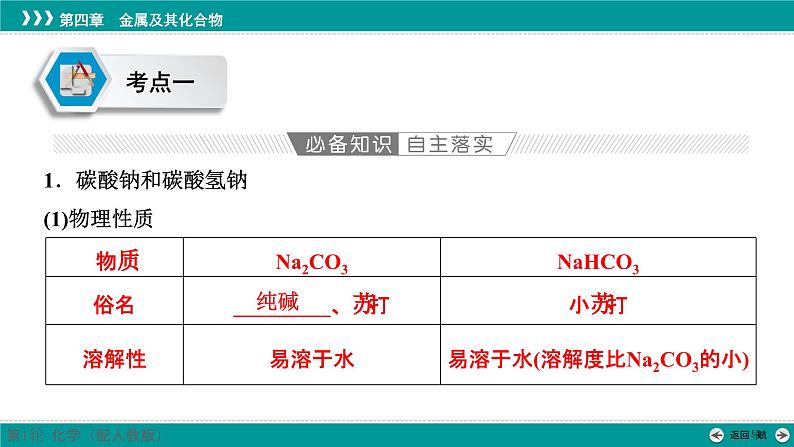
展开1.碳酸钠和碳酸氢钠(1)物理性质
(2)化学性质及用途(写出离子或化学方程式)
判断正误:正确的打“√”,错误的打“×”。(1)(2022·全国乙卷)碳酸氢钠可做食品膨松剂( )(2)(2022·海南卷)小苏打的主要成分是Na2CO3( )(3)(2022·广东卷)Na2CO3可与酸反应,故面包师用小苏打作发泡剂烘焙面包( )
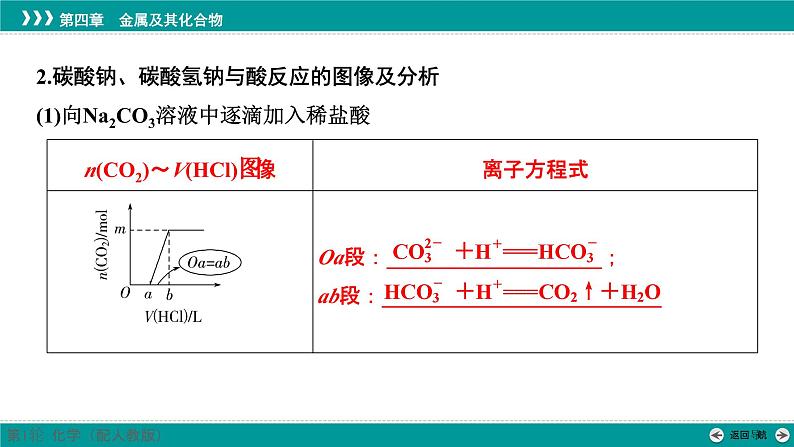
2.碳酸钠、碳酸氢钠与酸反应的图像及分析(1)向Na2CO3溶液中逐滴加入稀盐酸
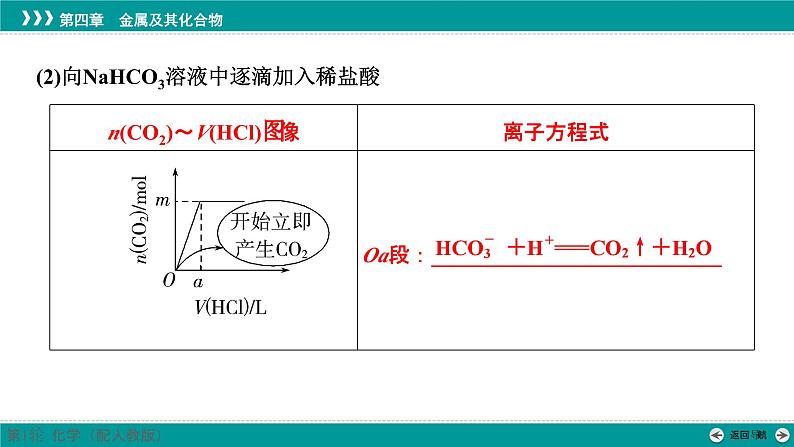
(2)向NaHCO3溶液中逐滴加入稀盐酸
(3)向等浓度Na2CO3和NaOH混合液中逐滴加入稀盐酸
(3)反应原理(写出化学方程式)①生成NaHCO3的反应:__________________________________________。②生成Na2CO3的反应:_____________________________________。(4)绿色化学理念:循环使用的物质为______、_____________。
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl
考向一 Na2CO3和NaHCO3的性质、转化及应用 [例1] (2024·湖南省长郡中学月考)某课外小组的同学为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如下几种实验方法。下列说法不正确的是( )
A.装置 Ⅰ 中的Na2CO3和NaHCO3均能与盐酸反应,产生气体速率大的是NaHCO3B.当稀盐酸足量时,装置 Ⅰ 中气球鼓起体积较小的是NaHCO3C.加热装置 Ⅱ ,澄清石灰水变浑浊一侧的白色固体是NaHCO3D.装置 Ⅲ 也可以鉴别Na2CO3和NaHCO3
碳酸钠和碳酸氢钠均与盐酸反应生成二氧化碳气体,盛放碳酸氢钠的气球鼓得更快,说明产生气体速率大的是碳酸氢钠,A正确;等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸氢钠产生的二氧化碳量多,故气球鼓起体积较大的是碳酸氢钠,B错误;碳酸氢钠受热分解生成二氧化碳,使澄清石灰水变浑浊,而碳酸钠加热不反应,C正确;碳酸钠受热不反应,碳酸氢钠受热分解生成二氧化碳,能使澄清石灰水变浑浊,故可以用来鉴别两者,D正确。
Na2CO3、NaHCO3的三种鉴别方法(1)利用热稳定性不同
(3)利用溶液的碱性不同
[练1] 两种固体分别是碳酸钠和碳酸氢钠,下列鉴别方法不合理的是 ( )
A.取两种固体溶于水,分别加入Ca(OH)2溶液,产生白色沉淀的是碳酸钠B.取两种固体分别滴入少量水,用温度计测量温度变化,升温的是碳酸钠C.取两种固体溶于水,分别加入少量稀盐酸,立即产生气体的是碳酸氢钠D.取两种固体分别装入X、Y两试管中,按如图装置进行实验,若试管b中的澄清石灰水出现浑浊而试管a中无明显现象,说明试管Y中的固体是碳酸氢钠
考向二 Na2CO3和NaHCO3与酸的反应原理及计算[例2] (2024·河北邯郸六校联考)将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1 L溶液,取出50 mL溶液,然后滴加一定物质的量浓度的盐酸与其反应,得到的图像如下。下列说法正确的是( )
A.标注NaCl的直线也能代表产生的CO2的物质的量的变化情况B.原混合物中Na2CO3和NaHCO3的物质的量之比为1∶2C.盐酸的浓度为0.05 ml/LD.原混合物中有10.6 g Na2CO3
考向三 侯氏制碱法的原理及实验探究[例3] 实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,下列说法错误的是( )
A.通过活塞K可控制CO2的流速B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸C.装置c中含氨的饱和食盐水提高了CO2吸收效率D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
[练3] (2024·中山大学附中月考)实验室模拟侯氏制碱法制取纯碱和氯化铵溶液,下列操作错误的是( )
用氯化铵和氢氧化钙共热制备氨,A正确;侯氏制碱法中从溶液里析出的晶体为碳酸氢钠,故应通过过滤获得碳酸氢钠,且应用玻璃棒引流,B错误;在坩埚中灼烧碳酸氢钠制备碳酸钠,C正确;在蒸发皿中蒸发浓缩氯化铵溶液,并不断搅拌,D正确。
1.碱金属(1)原子结构
2.焰色试验(1)概念很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,属于____变化,与______跃迁有关,是元素的性质。(2)操作流程
判断正误:正确的打“√”,错误的打“×”。(1)(2022·全国乙卷)焰火中红色来源于钠盐灼烧( )(2)(2021·辽宁卷)在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,则溶液中含Na元素( )(3)(2020·浙江7月选考卷)做焰色试验前,铂丝用稀盐酸清洗并灼烧至火焰呈无色( )
考向一 碱金属的性质及递变规律[例1] 下列对碱金属元素的叙述正确的是( )①K通常保存在煤油中以隔绝与空气的接触②碱金属常温下呈固态,取用时可直接用手拿③碱金属中还原性最弱的是锂④碱金属阳离子中氧化性最强的是Li+⑤碱金属的原子半径随核电荷数的增大而增大⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越低A.①③④⑤ B.②③⑤⑥C.①②③④ D.①②③⑤
钾和空气中的水蒸气、氧气等发生反应,金属钾密度比煤油大,所以钾通常保存在煤油中以隔绝与空气的接触,①正确;碱金属的活动性较强,会和皮肤中的水反应生成碱,具有强腐蚀性,故取用时不能直接用手拿,②错误;依据同主族元素性质递变规律,碱金属中还原性最弱的是锂,③正确;元素金属性越弱,对应阳离子的氧化性越强,所以碱金属阳离子中氧化性最强的是Li+,④正确;同主族元素原子的最外层电子数相同,电子层数逐渐增多,随着核电荷数的增大,碱金属的原子半径逐渐增大,⑤正确;从Li到Cs,碱金属的熔、沸点逐渐降低,密度呈增大趋势,钾反常,⑥错误。
碱金属的化学性质的相似性和递变性
[练1] 下列有关碱金属元素的性质的判断正确的是( )A.K与H2O反应最剧烈B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出NaC.碱金属的阳离子没有还原性,所以有强氧化性D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
碱金属中Rb和Cs的金属性更强,与H2O反应更剧烈,A错误;Rb虽比Na活泼,但Rb加入NaCl溶液中先与水剧烈反应,不能置换出溶液中的Na,B错误;碱金属的阳离子具有一定的氧化性,但氧化性不强,C错误;从Li到Cs,随原子半径逐渐增大,失去最外层1个电子的能力逐渐增强,D正确。
考向二 焰色试验的原理及应用[例2] 某同学用铂丝蘸取某混合液进行焰色试验,下列说法正确的是( )A.焊在玻璃棒上的铂丝可用光洁无锈的铁丝代替B.焰色试验有发光现象,所以是化学变化C.透过蓝色钴玻璃观察到紫色火焰,证明原溶液有钾元素无钠元素D.每次实验结束可用水洗净铂丝并在外焰上灼烧至没有颜色
洁净的铁丝,放在酒精灯上灼烧至无色,本身并无颜色,可用来进行焰色试验,A正确; 焰色试验是某些金属元素在灼烧时表现的性质,属于物理变化,B错误;透过蓝色钴玻璃的目的是滤去黄光的干扰,透过蓝色钴玻璃观察到紫色火焰,证明原溶液有钾元素,但不能说明没有钠元素,C错误;不能用水洗净铂丝,应该用盐酸,盐酸易挥发,其盐高温时也易挥发,铂丝蘸盐酸灼烧时,盐酸及其盐可一起挥发掉,可以达到洗净的目的,D错误。
[练2] (2024·江西省红色十校联考)利用焰色试验,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法正确的是( )A.非金属单质燃烧时火焰均为无色B.Na2SO4与NaOH灼烧时火焰颜色相同C.焰色实验均应透过蓝色钴玻璃观察D.只有金属单质灼烧时火焰才有颜色
某些非金属单质燃烧时火焰也有颜色,如H2燃烧产生淡蓝色火焰,单质硫在空气中燃烧产生淡蓝色火焰,在纯氧中燃烧产生蓝紫色火焰,A错误;焰色试验是金属元素的性质,与元素的存在形式(化合态或游离态)无关,同种金属元素的焰色试验相同,Na2SO4、NaOH均含钠元素,火焰颜色均为黄色,B正确;只有观察钾元素的焰色试验时需要透过蓝色钴玻璃,其他金属元素不需要,C错误;焰色试验是金属元素的物理性质,可以是金属单质或金属化合物灼烧时火焰的颜色,D错误。
1.下列关于碳酸钠和碳酸氢钠的说法正确的是( )A.用澄清石灰水不能鉴别Na2CO3溶液和NaHCO3溶液B.相同温度时,碳酸氢钠的溶解度大于碳酸钠C.碳酸氢钠的热稳定性比碳酸钠强D.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3产生的CO2多
碳酸钠、碳酸氢钠都能与氢氧化钙反应生成碳酸钙沉淀,现象相同,所以澄清石灰水不能鉴别Na2CO3溶液和NaHCO3溶液,A正确;同温度时,碳酸氢钠的溶解度小于碳酸钠,B错误;碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,则碳酸氢钠的热稳定性比碳酸钠弱,C错误;等质量的Na2CO3和NaHCO3,Na2CO3的摩尔质量大,其物质的量少,盐酸足量,则与盐酸完全反应,Na2CO3产生的气体少,D错误。
2.(2024·湖北鄂东南名校联考)向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 ml/L盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。下列叙述正确的是( )
A.溶液乙中含有的溶质是Na2CO3、NaHCO3B.当0
回答下列问题:(1)过程中晶体A的化学式为________,晶体A能够析出的原因是__________。(2)过程中“300 ℃加热”所选用的仪器是________(填标号)。
4.(2021·河北卷,节选)化工专家侯德榜发现的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
回答下列问题:(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是________(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或______________________________________。
(2)B中使用雾化装置的优点是________________________________________。(3)生成NaHCO3的总反应的化学方程式为_______________________________________________________________________________________________。(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液,向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)―→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为________、________、洗涤、干燥。
答案:(1) a→e→f→b→c→g→h 将玻璃塞上的凹槽对准漏斗颈部的小孔(2)使氨盐水雾化,可增大与二氧化碳的接触面积,从而提高产率(或其他合理答案)(3)NH3·H2O+NaCl+CO2===NH4Cl+NaHCO3↓(4)蒸发浓缩 冷却结晶
(1)根据工艺流程知,浓氨水中加入氯化钠粉末形成饱和氨盐水后,再通入二氧化碳气体,发生反应NH3·H2O+NaCl+CO2===NH4Cl+NaHCO3↓,得到的碳酸氢钠晶体烘干后受热分解会生成碳酸钠、二氧化碳和水,从而制备得到纯碱,故仪器连接顺序为a→e→f→b→c→g→h。(2)B中使用雾化装置使氨盐水雾化,可增大与二氧化碳的接触面积,从而提高产率。
(4)根据溶解度随温度的变化曲线可以看出,NH4Cl的溶解度随着温度的升高而不断增大,而NaCl的溶解度随着温度的升高变化并不明显,为使NH4Cl沉淀充分析出并分离,需采用蒸发浓缩、冷却结晶、洗涤、干燥的方法。
课件 高考化学一轮复习第四单元 重要的金属元素 第十二讲 碳酸钠和碳酸氢钠 碱金属: 这是一份课件 高考化学一轮复习第四单元 重要的金属元素 第十二讲 碳酸钠和碳酸氢钠 碱金属,共60页。PPT课件主要包含了夯实必备知识,小苏打,固体质量,NaOH,CO2,对点自测,纯碱或苏打,提升关键能力,焰色试验,2实验操作流程等内容,欢迎下载使用。
2025届高考化学一轮总复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件: 这是一份2025届高考化学一轮总复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件,共46页。PPT课件主要包含了Na2CO3,NaHCO3,纯碱或苏打,小苏打,2NaHCO3,3相互转化,2图像分析,强还原等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第4章 第13讲 碳酸钠和碳酸氢钠 碱金属 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第13讲 碳酸钠和碳酸氢钠 碱金属 (含解析),共60页。PPT课件主要包含了碳酸钠和碳酸氢钠,必备知识,应用举例,关键能力,碱金属焰色试验,真题演练明确考向,课时精练等内容,欢迎下载使用。












