



2023年高考化学一轮复习碳酸钠、碳酸氢钠 碱金属课件
展开考点二 碱金属 焰色试验
考点一 Na2CO3和NaHCO3
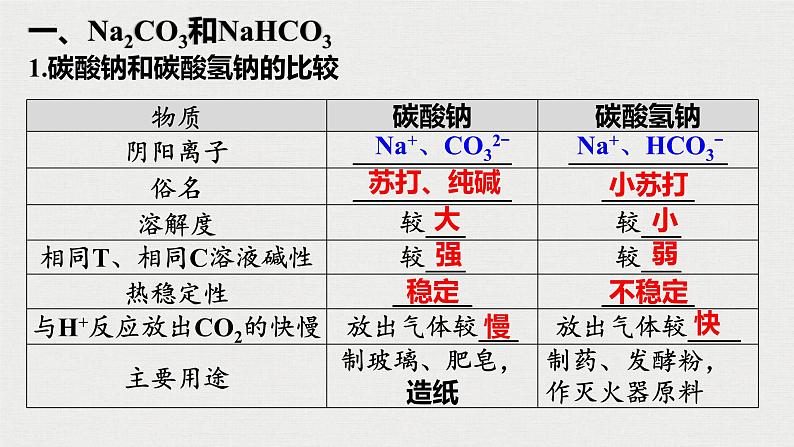
一、Na2CO3和NaHCO3
1.碳酸钠和碳酸氢钠的比较
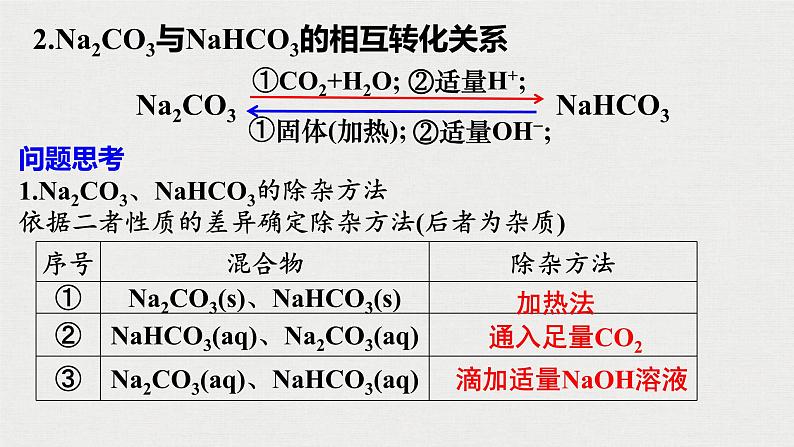
2.Na2CO3与NaHCO3的相互转化关系
问题思考1.Na2CO3、NaHCO3的除杂方法依据二者性质的差异确定除杂方法(后者为杂质)
Na2CO3 NaHCO3
3.请设计实验方案,用50 mL 2 ml·L-1 NaOH溶液和足量的 CO2气体,制取50 mL 1 ml·L-1的Na2CO3溶液。
答案 开始无明显现象,后有沉淀析出。原因是NaHCO3的溶解度小于Na2CO3的溶解度,而且反应消耗溶剂水。 Na2CO3+CO2+H2O==2NaHCO3↓
答案 将50 mL NaOH溶液,等分成两份,一份通入过量的CO2,然后加热煮沸、冷却后与另一份混合,即可。 第一步: NaOH+CO2===NaHCO3 第二步:NaHCO3+NaOH===Na2CO3+H2O
问题思考2.将CO2气体通入到饱和Na2CO3溶液中有何现象?原因是什么?
3.Na2CO3与NaHCO3的鉴别
(1)利用热稳定性不同
(2)利用阴离子的不同
(3)相同条件下利用反应速率不同
(4)利用溶液的碱性不同
与HCl 溶液反应 或滴加盐酸
用BaCl2 溶液 不能用Ba(OH)2
2.若向NaHCO3溶液中滴加BaCl2溶液,既有沉淀生成又有气泡冒出,反应离子方程式:______________________________________。
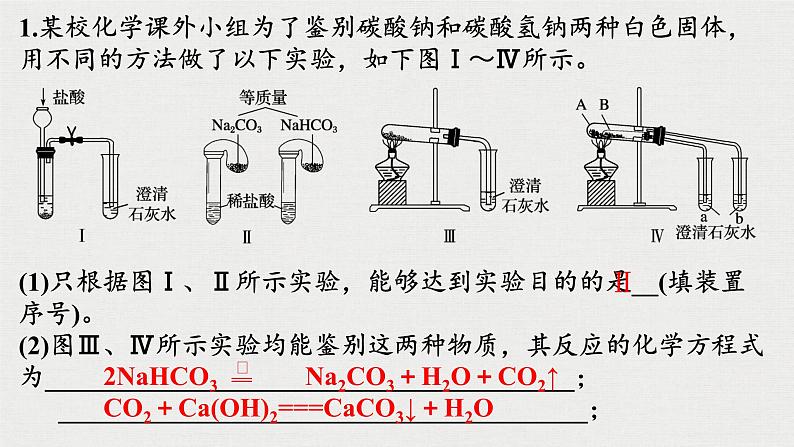
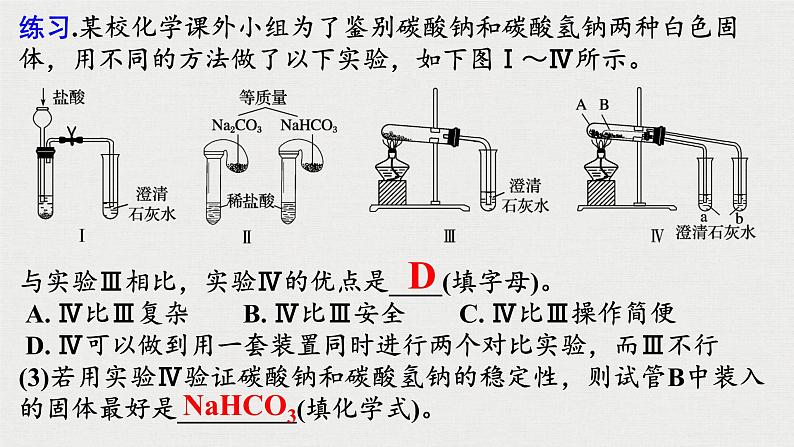
NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH
2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3
2HCO3-+Ba2+=BaCO3↓+H2O+CO2↑
CO2+Ca(OH)2===CaCO3↓+H2O
4.Na2CO3、NaHCO3与酸反应的定量关系
(1)向NaHCO3溶液中逐滴滴入盐酸①现象:______________。②离子方程式: __________________________。③画出产生CO2的物质的量随n(HCl)的变化图像。
HCO3-+H+=H2O+CO2↑
(2)向Na2CO3溶液中逐滴滴入盐酸①现象:__ ____________。②写出反应的离子方程式:______________________________________________。③画出产生CO2的物质的量随n(HCl)的变化图像。
CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑
例题.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 ml·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):(1)在A情况下,溶质是_______________(填化学式),其物质的量之比为______。
NaOH、Na2CO3
例题.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 ml·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):(2)在B情况下,溶质是_________________(填化学式),其物质的量之比为_____(3)原氢氧化钠溶液的物质的量浓度为_____________。
Na2CO3、NaHCO3
练习.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 ml·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )A.原NaOH溶液的浓度为0.2 ml·L-1B.通入CO2在标准状况下的体积为448 mLC.所得溶液的溶质成分的物质的量之比为: n(NaOH)∶n(Na2CO3)=1∶3D.所得溶液的溶质成分的物质的量之比为 n(NaHCO3)∶n(Na2CO3)=1∶1
(1)Na2CO3、NaHCO3与足量盐酸反应的比较
(2)依据图像特点判断溶液溶质成分的方法
5.测定碳酸钠质量分数的常用方法
气体法(1)测定原理:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑。(2)实验操作:向m g纯碱样品中加入足量的稀硫酸,准确测量产生CO2气体的体积为V mL(已折算为标准状况)。
沉淀法(1)测定原理:Na2CO3+BaCl2===BaCO3↓+2NaCl。(2)实验操作:先将m g纯碱样品溶于水配成溶液,向溶液中加入过量的BaCl2溶液,经过滤、洗涤、干燥得BaCO3沉淀的质量为n g。
1.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
2.为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分的含量,某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。下列说法错误的是( )
A.①②③中可以依次盛装碱石灰、无水CaCl2、碱石灰B.硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气, 直至a处出来的空气不再使澄清石灰水变浑浊为止C.若将①装置换成盛放NaOH溶液的洗气瓶, 则测得的NaCl含量偏大D.实验过程中一直通入空气,停止加热后再停止通入空气
① ② ③
③若样品质量为w g,反应后C、D装置增加的质量分别为 m1 g、m2 g,则测定NaCl、Na2CO3·10H2O和NaHCO3 的混合物中Na2CO3·10H2O的质量分数为 ____________________(用含w、m1、m2的代数式表示)。
6.侯德榜制碱法(本质:离子浓度过剩时,优先析出 的物质。)
(1)分别写出沉淀池、煅烧炉中发生的化学方程式。
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
(或NH3+CO2+H2O=NH4HCO3、 NH4HCO3+NaCl=NH4Cl+NaHCO3↓)
(3)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气除了增大NH4+的浓度,使NH4Cl更多地析出外,还有什么作用?循环Ⅰ的作用是什么?
答案 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。循环Ⅰ的作用是提高原料氯化钠的利用率。
NaCl(s)+NH4Cl(aq)―→NaCl(aq)+NH4Cl(s)
1.以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )A.A气体是NH3,B气体是CO2B.侯氏制碱法的工艺过程中应用了物质溶解度的差异C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
2.实验室模拟侯氏制碱法制取纯碱和氯化铵溶液,下列有关操作错误的是( )A.图1为制取氨气将其溶于饱和食盐水B.图2为过滤获得碳酸钠晶体C.图3为灼烧碳酸氢钠制取碳酸钠D.图4为蒸发浓缩氯化铵溶液
二、碱金属 焰色试验
1.碱金属的相似性和递变性
2.碱金属的特性(1)单质密度一般随核电荷数的增大而增大,但钾的密度比钠的小。(2)碱金属一般都保存在 中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。(3)碱金属跟氢气反应生成的碱金属氢化物都是 ,其中氢以H-形式存在,显-1价,碱金属氢化物是 。(4)试剂瓶中的药品取出后,一般不能放回原瓶,但Na、K等需放回原瓶。(5)锂与O2反应与钠不同,只生成Li2O。
(1)焰色反应的概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,属于______变化,是元素的性质。(2)焰色反应的操作
(3)常见元素的焰色钠元素 色;钾元素 色(透过 观察);铜元素 色;钡元素 色;锶元素 色;锂元素 色;钙元素 色。
1.下列有关铯及其化合物的说法不正确的是A.CsOH的碱性比KOH的强B.铯与水或稀盐酸反应剧烈,都生成H2C.Cs的还原性比Na的强,故Na+的氧化性强于Cs+D.Li的金属性比Cs的强
2.利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是A.非金属单质燃烧时火焰均为无色B.Na2SO4与NaOH灼烧时火焰颜色相同C.焰色反应均应透过蓝色钴玻璃观察D.只有金属单质灼烧时火焰才有颜色
碱金属单质及其化合物有广泛应用。回答下列问题:(1)锂是最轻的活泼金属,常用于制造高效锂电池。电解池中的电解液不能用水作溶剂,原因是________________。(2)金属钾是一种活泼的金属,下列有关其性质的说法正确的是 _____(填字母)。A.钾在空气中燃烧时,只生成K2OB.钾与水反应,由于反应剧烈可能会发生爆炸C.1 ml·L-1KOH溶液比1 ml·L-1NaOH溶液碱性强
(3)KH是一种野外供氢剂,其电子式为________,与水反应放出氢气,化学方程式为_______________________。生成1 ml氢气时,反应中转移电子数为_____。(4)NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程中生成两种产物,其反应的化学方程式: ____________________________。
KH+H2O===KOH+H2↑
3NaH+Fe2O3===2Fe+3NaOH
练习.下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )A.取a克混合物充分加热,减重b克B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧, 得b克固体C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收, 增重b克D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、 烘干,得b克固体
新高考化学一轮复习精品课件 第4章 第13讲 碳酸钠和碳酸氢钠 碱金属 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第13讲 碳酸钠和碳酸氢钠 碱金属 (含解析),共60页。PPT课件主要包含了碳酸钠和碳酸氢钠,必备知识,应用举例,关键能力,碱金属焰色试验,真题演练明确考向,课时精练等内容,欢迎下载使用。
第八讲 钠及其氧化物 碳酸钠和碳酸氢钠(课件)-【大一轮课堂】2024年高考化学大一轮复习课件+习题: 这是一份第八讲 钠及其氧化物 碳酸钠和碳酸氢钠(课件)-【大一轮课堂】2024年高考化学大一轮复习课件+习题,共60页。PPT课件主要包含了学习目标,单质--钠,碳酸钠和碳酸氢钠,图像分析,真题验收制胜高考,知能训练素养落实等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习专题:碳酸钠和碳酸氢钠 碱金属课件: 这是一份2024届高三化学高考备考一轮复习专题:碳酸钠和碳酸氢钠 碱金属课件,共35页。PPT课件主要包含了Na2CO3,NaHCO3,小苏打,焰色试验,侯氏制碱法等内容,欢迎下载使用。












