



所属成套资源:【暑假衔接】人教版新高一(初升高)化学暑假衔接讲义
第04讲 氧化剂与还原剂-【暑假衔接】新高一化学暑假讲义+习题(人教版2019必修第一册)
展开
这是一份第04讲 氧化剂与还原剂-【暑假衔接】新高一化学暑假讲义+习题(人教版2019必修第一册),文件包含第04讲氧化剂与还原剂-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册原卷版docx、第04讲氧化剂与还原剂-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
1、帮助孩子系统梳理上学期所学知识。带领孩子构建完备、扎实牢固的知识体系;
2、帮助孩子预习新学期功课。提前掌握重难点、考点、易错点,领先一步提高学习效率;
3、假期持续稳定的学习。避免孩子长时间沉迷于电视、手机,养成坏习惯,影响新学期学习。
第04讲 氧化剂与还原剂
能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系。
2、认识物质的氧化性、还原性,学会判断物质具有的氧化性或还原性。
一、氧化剂、还原剂
1、氧化还原反应中的相关概念
(1)化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
(2)氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
(3)氧化性与还原性
2、氧化性和还原性
(1)氧化性是指物质得电子的性质(或能力);还原性是指物质失电子的性质(或能力)。
(2)从元素的价态考虑:最高价态微粒只有氧化性;最低价态微粒只有还原性;中间价态微粒有氧化性和还原性。
(3)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。
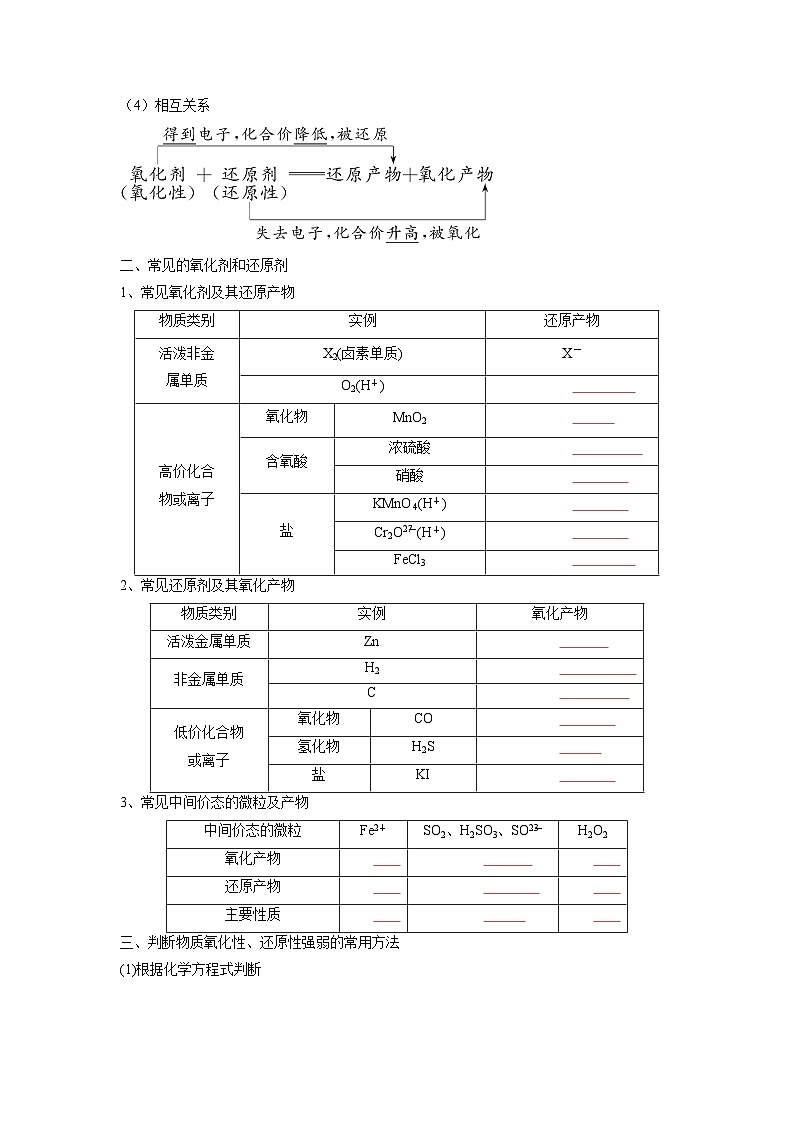
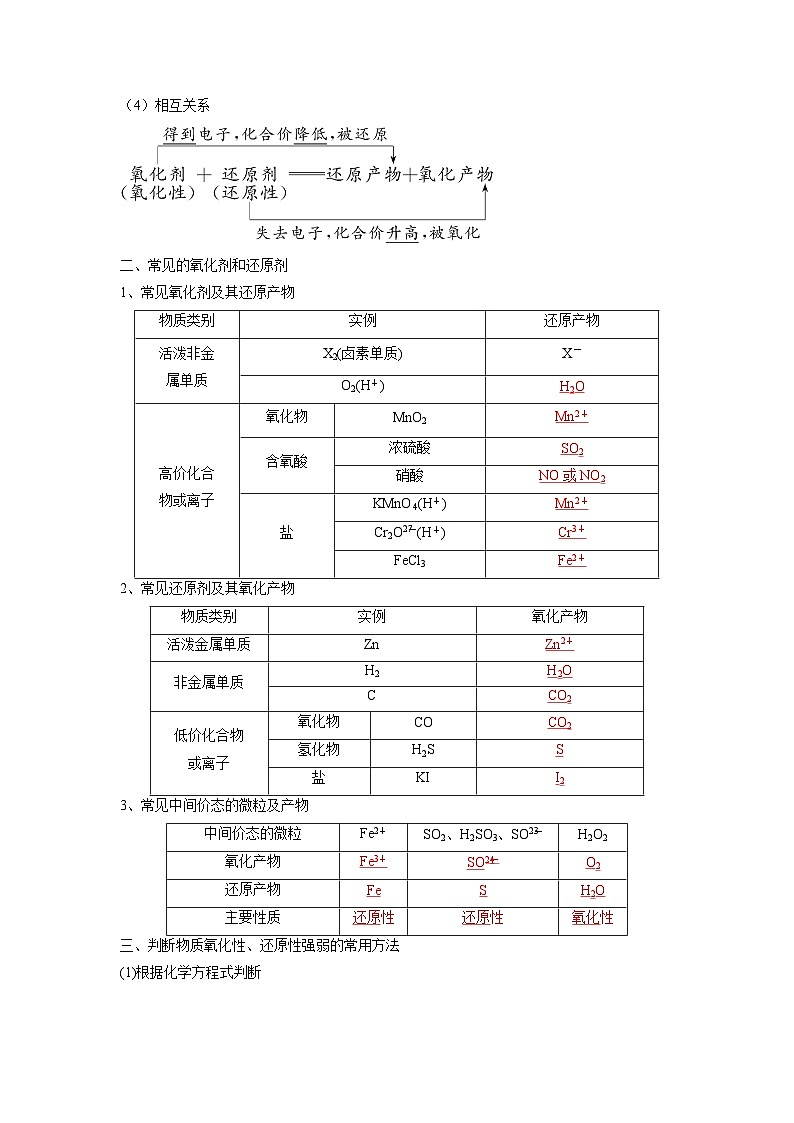
(4)相互关系
二、常见的氧化剂和还原剂
1、常见氧化剂及其还原产物
2、常见还原剂及其氧化产物
3、常见中间价态的微粒及产物
三、判断物质氧化性、还原性强弱的常用方法
(1)根据化学方程式判断
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
(2)根据金属的活动性顺序判断
(3)根据反应条件和产物价态高低判断。
(4)熟记常见物质氧化性、还原性顺序
①氧化性:KMnO4>Cl2>Br2>Fe3+>I2>S;
②还原性:Cl-SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
【答案】D
【解析】在①I2+SO2+2H2O=2HI+H2SO4中还原剂是SO2、还原产物是HI,所以还原性SO2>HI;
在②2FeCl2+Cl2=2FeCl3中还原剂是FeCl2、还原产物是FeCl3,所以还原性FeCl2>FeCl3;③2FeCl3+2HI=I2+2FeCl2+2HCl中还原剂为HI、还原产物是FeCl2,所以还原性KI>FeCl2;通过以上分析知,物质的还原性有强到弱的顺序是SO2>I->Fe2+>Cl-,D正确。
考点三:氧化还原反应的相关计算
例3.(2023浙江省名校协作体开学联考)反应3NO2+H2O=2HNO3+NO中,氧化产物与还原产物的分子个数之比是
A. 1∶2 B. 2∶1 C. 1∶1 D. 3∶2
【答案】B
【解析】反应3NO2+H2O=2HNO3+NO中,二氧化氮中氮元素由+4价升高到+5价,生成硝酸,为氧化产物,物质的量为2ml;二氧化氮中氮元素由+4价降低到+2价,生成一氧化氮,为还原产物,物质的量为1ml,所以氧化产物与还原产物的物质的量之比是2:1,B正确。
1、(2023北京顺义高一检测)单宁是一种天然防腐剂,可有效避免葡萄酒因氧化而变酸,下列判断正确的是( )
A.单宁做还原剂 B.单宁做氧化剂
C.单宁被还原 D.单宁中某元素化合价降低
【答案】A
【解析】由题目可知,单宁能有效避免葡萄酒氧化,因此单宁为还原剂,A正确、B错误;还原剂被氧化,C错误;还原剂具有还原性,化合价升高,D错误。
2、(2023北京丰台高一检测)下列微粒中,既具有氧化性又具有还原性的是( )
A.Mg B.Cu2+ C.Cl- D.Fe2+
【答案】D
【解析】Mg只能失去电子变为Mg2+,表现还原性,A不符合题意;Cu2+只能得到电子变为Cu+或Cu,表现氧化性,B不符合题意;Cl元素最低化合价为-1价,只能失去电子变为Cl2或ClO-等,表现还原性,C不符合题意;Fe2+既可以失去电子变为Fe3+,表现还原性,也可以得到电子变为Fe单质,表现氧化性,因此Fe2+既具有氧化性又具有还原性,D符合题意。
3、(2023天津六校高一上学期期中联考)苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有
A. 氧化性 B. 还原性 C. 酸性 D. 碱性
【答案】B
【解析】榨苹果汁时加入维生素C,会可有效防止Fe2+转变为Fe3+离子这种现象的发生,这说明维生素C能把铁离子还原生成亚铁离子,因此维生素C具有还原性,B正确。
4、(2023山东青岛高一统考月考)ClO2气体是一种高效、环保的消毒剂,可代替氯气用于饮用水的消毒,工业制取方法为:。下列分析错误的是
A.该反应为氧化还原反应,只有氯元素化合价发生了变化
B.ClO2为氧化反应的产物
C.HCl在该反应中既表现还原性又表现酸性
D.氧化性:NaClO3>Cl2
【答案】B
【解析】根据同种元素化合价归中不交叉原则可知,中氯元素的化合价由+5价降到了当中的+4价,中氯元素化合价从-1价升到了中的0价,只有氯元素化合价发生了变化,A正确;中氯元素的化合价由+5价降到了当中的+4价,化合价降低,被还原,故ClO2为还原反应的产物,B错误;参与反应的HCl中,有一半中氯元素化合价从-1价升到了 中的0价,表现还原性,还有一半反应生成了盐和水,体现了酸性,故在该反应中既表现还原性又表现酸性,C正确;中氯元素的化合价由+5价降到了当中的+4价,是氧化剂,Cl2是氧化产物,故氧化性:NaClO3>Cl2,D正确。
5、(2023云南澄江第一中学高一开学考试)根据反应O2+2H2S===2S↓+2H2O,Na2S+I2===2NaI+S↓,4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O判断下列物质的氧化性强弱,正确的是( )
A.O2>I2>S B.H2S>NaI>H2O
C.S>I2>O2 D.H2O>NaI>H2S
【答案】A
【解析】在氧化还原反应中,氧化性:氧化剂>氧化产物,在反应O2+2H2S===2S↓+2H2O中,氧化性:O2>S;在反应Na2S+I2===2NaI+S↓中,氧化性:I2>S;在反应4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O中,氧化性:O2>I2,因此,氧化性:O2>I2>S。
6、(2023吉林省白城一中期期中)下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A. Fe、H2O、CO2 B. ClO-、Cl-、Ag+ C.Cl2、HClO、Mg D .Fe3+、MnO4-、NO3-
【答案】D
【解析】Fe只能做还原剂,A错误;Cl-化合价只能升高,只能做还原剂,B错误;Mg元素化合价只升高,只能做还原剂,C错误;Fe3+、MnO4-、NO3-化合价都能降低,能做氧化剂,D正确。
7、(2023湖北省沙市中学高一月考)水热法制Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+xOH- =Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2、S2O32-都是氧化剂
B.x=2
C.将纳米Fe3O4颗粒分散在水中会产生丁达尔效应
D.氧化产物只有S4O62-
【答案】C
【解析】在3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O中,铁元素的化合价变化:+2→+;硫元素的化合价变化为:+2→+;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-,结合离子方程式的电荷守恒判断x。由上述分析可知,还原剂是Fe2+、S2O32-,氧化剂是O2,A错误;由电荷守恒可知:2×3+2×(-2)-x=-2,x=4,B错误;纳米Fe3O4粒子直径介于1~100nm之间,将纳米Fe3O4分散在水中可形成胶体,具有丁达尔效应,C正确;由上述分析可知,还原剂是Fe2+、S2O32-,则氧化产物有Fe3O4和S4O62-,D错误。
8、(2023上海徐汇高一上海市第四中学校考期中)是常见的氧化剂,可氧化、、等离子,且已知还原性:。在和混合溶液中,通入一定量,溶液中存在的离子组不合理的是
A.、、 B.、、
C.、、 D.、、、
【答案】B
【解析】由题意知还原性顺序是:,则氧化性顺序是:Cl2>Br2>Fe3+>I2,根据氧化还原反应规律,氧化性强的先与还原性强的物质反应,则发生反应的先后顺序为:Cl2+2I-=I2+2Cl-,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-=Br2+2Cl-,所以在FeI2和FeBr2混合溶液中,通入一定量Cl2,由于溶液中同时存在Fe2+、I-、Br-:若溶液中存在Fe2+、Br-、Cl-,表明I-被完全氧化,符合反应发生的先后顺序,A正确;若溶液中存在Fe2+、Cl-、I-,表明Br-被完全氧化,不符合反应发生的先后顺序,B错误;若溶液中存在Fe3+、Br-、Cl-,表明I-、Fe2+被完全氧化,符合反应发生的先后顺序,C正确;若溶液中存在Fe2+、Br-、Cl-、I-,表明各种离子均没有被完全氧化,说明Cl2的量很少,符合反应发生的先后顺序,D正确。
9、(2023黑龙江省齐齐哈尔第八中学高一上学期中考试)已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
A.+2 B.+3 C.+4 D.+6
【答案】D
【解析】该反应是离子反应型的氧化还原反应,由电荷守恒可以得到式子:-x+3×(-2)+14=2×3,x=2,则M2O72-,假设M的化合价为y,则有-2×7+2y=-2,y=+6;D正确
10、(2023上海市第一中学校考期中)实验室常用稀硝酸和铜反应来制取少量的一氧化氮气体,反应的化学方程式为: (稀)。
(1)写出该反应的离子方程式并在离子方程式上用单线桥标电子转移的方向和数目:_______。
(2)该反应中的氧化剂是_______;被还原的元素是_______。
(3)当参加反应时,转移的电子数为_______,被还原的为_______。
(4)根据反应①,②判断、、氧化性由强到弱的顺序是_______。
【答案】(1)
(2)HNO3 N
(3)0.6NA 0.2
(4)
【解析】(1)由化学方程式改写离子方程式时,易电离的稀硝酸以及可溶性盐硝酸铜可拆成离子形式,其余均保留化学式,删去方程式两边不参加反应的离子,再检查一下是否满足原子守恒和电荷守恒,。反应中铜元素化合价由0价升高至+2价,失去2个电子,氮元素化合价由+5价降低至+2价,得到3个电子,化合价升降最小公倍数为6,根据氧化还原得失电子守恒可知反应中转移6个电子,用单线桥标出该反应转移电子数目情况:;
(2)中氮元素化合价由+5价降低至+2价,得到3个电子,做氧化剂,氧化剂被还原的元素是N元素;
(3)反应中铜元素化合价由0价升高至+2价,则0.3ml Cu参加反应时,转移的电子为2×0.3ml=0.6ml,转移的电子数为0.6NA,根据离子方程式的系数比,可知被还原的硝酸为0.2ml;
(4)标出各反应变价元素的化合价,可知反应①中氧化剂为FeCl3,还原产物为FeCl2,还原剂为Cu,氧化产物为CuCl2,反应②中氧化剂为Cl2,还原剂为FeCl2,还原产物和氧化产物均为FeCl3,根据氧化剂的氧化性大于氧化产物可判断氧化性,反应①中Fe3+的氧化性大于Cu2+,反应②中Cl2的氧化性大于Fe3+,综上氧化性由强到弱的顺序是。
1、(2023天津蓟州高一检测)下列对于NaH+H2O===H2↑+NaOH说法正确的是( )
A.该反应属于置换反应
B.若该反应中有2个电子转移,则生成1个H2
C.水是氧化剂
D.H2只是氧化产物
【答案】C
【解析】该反应的反应物中无单质参加,因此该反应不属于置换反应,A错误;该反应中每反应生成1个H2,转移1个电子,因此若该反应中有2个电子转移,则生成2个H2,B错误;在该反应中,H元素化合价由反应前H2O中的+1价降低到反应后H2中的0价,得到电子被还原,所以水是氧化剂,C正确;在该反应中,H2既是还原产物又是氧化产物,D错误。
2、(2023河南濮阳高一质检)根据你所学的知识分析物质的转化。下列转化过程必须加入还原剂才能实现的是( )
A.H2O2→O2 B.KI→I2
C.Cl2→NaCl D.FeCl3→FeCl2
【答案】D
【解析】H2O2可在催化剂MnO2的作用下分解生成氧气,不需要加入还原剂,A错误;KI→I2的过程I元素化合价升高,被氧化,需加入氧化剂才能实现,B错误;Cl2和NaOH反应可生成NaCl和NaClO,不需要加入还原剂,C错误;FeCl3→FeCl2的过程中,Fe元素化合价降低,被还原,需加入还原剂才能实现,D正确。
3、(2023新疆师范大学附属中学高一阶段检测)歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应说法不正确的是( )
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.铜的化合价升高,被氧化
D.碱式碳酸铜中铜元素的化合价是+1价
【答案】D
【解析】在该反应中,铜元素的化合价从0价升高到+2价,氧元素的化合价从0价降低到-2价,碳元素和氢元素的化合价没有发生变化,发生化合价变化的有两种元素,A正确;氧气中氧元素的化合价从0价降低到-2价,得到电子,发生还原反应,B正确;铜的化合价升高,被氧化,C正确;碱式碳酸铜中铜元素的化合价为+2价,D错误。
4、(2023湖南湘潭高一质检)在室温下,发生下列几种反应:
①14H++6Z-+X2Oeq \\al(2-,7)===2X3++3Z2+7H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,下列结论错误的是( )
A.氧化性强弱顺序为X2Oeq \\al(2-,7)>Z2>B2>A3+
B.X3+是X2Oeq \\al(2-,7)的还原产物,B2是B-的氧化产物
C.在溶液中可能发生反应:14H++6A2++X2Oeq \\al(2-,7)===2X3++6A3++7H2O
D.要将含有A2+、Z-和B-的混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入Z2
【解析】D
【解析】根据氧化剂的氧化性大于氧化产物,氧化性强弱顺序为X2Oeq \\al(2-,7)>Z2>B2>A3+,A正确;X2Oeq \\al(2-,7)→X3+,X元素的化合价降低,发生还原反应,X3+是X2Oeq \\al(2-,7)的还原产物,B-→B2,化合价升高,发生氧化反应,B2是B-的氧化产物,B正确;根据氧化性强弱顺序可知,在溶液中可能发生反应:14H++6A2++X2Oeq \\al(2-,7)===2X3++6A3++7H2O,C正确;要将含有A2+、Z-和B-的混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入B2,若加入Z2,将氧化B-,D错误。
5、(2023山东省济南市外国语学校月考)已知下列四组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③向FeCl2溶液中加入少量溴水,溶液变黄色;④分别取实验②和实验③中生成的溶液,分别滴在淀粉KI试纸上,试纸都变蓝色。则下列判断不正确的是
A. 实验①能够证明Cl-具有还原性
B. 上述实验能够证明氧化性:Cl2 >Br2
C. 上述实验能够证明氧化性:MnO4->Cl2 >Fe3+ >I2
D. 由上述实验不能判断氯气能使湿润的淀粉KI试纸变蓝
【答案】B
【解析】高锰酸钾能将浓盐酸氧化为氯气,高锰酸钾做氧化剂,HCl作还原剂,证明Cl-具有还原性,A正确;氯气能将亚铁离子氧化为三价铁,氯气做氧化剂,溴水将亚铁离子氧化为三价铁,溴单质做氧化剂,说明氧化性:Cl2>Fe3+,Br2>Fe3+,但是不能证明氧化性:Cl2 >Br2,B错误;高锰酸钾能将浓盐酸氧化为氯气,高锰酸钾做氧化剂,氯气是氧化产物,每个反应的氧化剂的氧化性大于氧化产物的氧化性,所以氧化性MnO4-> Cl2,氯气能将亚铁离子氧化为三价铁,氯气做氧化剂,所以氧化性Cl2>Fe3+,三价铁将碘离子氧化为单质碘,二价铁是还原产物,单质碘是氧化产物,所以氧化性Fe3+>I2,则能够证明氧化性:MnO4->Cl2 >Fe3+ >I2,C正确;向FeCl2溶液中通入少量氯气,溶液变黄色生成Fe3+,取实验②生成的溶液,滴在淀粉KI试纸上,试纸变蓝色,是因为Fe3+与碘离子反应生成I2,不能判断氯气能使湿润的淀粉KI试纸变蓝,D正确。
6、(2023云南澄江第一中学高一开学考试)科学家提出“硅是未来的石油”,制备粗硅的反应为SiO2+2CSi+nCO↑,下列说法正确的是( )
A.该化学方程式中n=1
B.反应中碳做还原剂
C.反应前后原子总数发生变化
D.2个碳原子反应时失去8个电子
【答案】B
【解析】依据元素守恒,该化学方程式中n=2,A错误;在反应中,碳元素由0价升高到+2价,失电子做还原剂,B正确;依据质量守恒,反应前后原子总数不变,C错误;碳元素由0价升高到+2价,2个碳原子反应时失去4个电子,D错误。
7、(2023新疆师范大学附属中学高一检测)反应3NO2+H2O===2HNO3+NO中,当有2e-转移时,被氧化的物质与被还原的物质的个数比是( )
A.1∶1 B.2∶1 C.1∶2 D.3∶1
【答案】B
【解析】在反应3NO2+H2O===2HNO3+NO中,NO2既做还原剂又做氧化剂,每3mlNO2发生反应,有2 ml NO2失去电子被氧化为HNO3,有1 ml NO2得到电子被还原成NO,反应过程中转移2 ml电子,则当有2e-转移时,被氧化的物质与被还原的物质的个数比是2∶1。
8、(2023广东普宁第二中学高一检测)稀硫酸中几种离子的转化关系如图所示。下列说法正确的是( )
A.反应1中氧化剂是Mn3+
B.氧化性:Mn3+>Ce4+>Fe3+>I2
C.能发生反应:2Mn3++2I-===I2+2Mn2+
D.反应2的还原产物为Fe3+
【答案】C
【解析】由图像可知,反应1为Ce4++Mn2+===Ce3++Mn3+,反应2为Mn3++Fe2+===Mn2++Fe3+,反应3为2Fe3++2I-===2Fe2++I2。反应1中的氧化剂为Ce4+,Mn3+是氧化产物,A错误;氧化剂的氧化性强于氧化产物的氧化性,由反应1可知氧化性:Ce4+>Mn3+,由反应2可知氧化性:Mn3+>Fe3+,由反应3可知氧化性:Fe3+>I2,故有氧化性:Ce4+>Mn3+>Fe3+>I2,B错误;氧化性:Mn3+>I2,因此可以发生反应:2Mn3++2I-===I2+2Mn2+,C正确;反应2为Mn3++Fe2+===Mn2++Fe3+,还原产物为Mn2+,D错误。
9、(2023上海高一华师大二附中校考期末)把图乙中的物质补充到图甲,可得到一个完整氧化还原反应的离子方程式(未配平)。
对于该氧化还原反应的离子方程式,下列说法不正确的是
A.IO作氧化剂,具有氧化性 B.氧化性:MnO<IO
C.Mn2+是还原剂,具有还原性 D.若有2个Mn2+参加反应,则转移14个电子
【答案】D
【详解】已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以IO是反应物,IO是生成物,根据元素守恒知,水是反应物,该反应方程式为:2Mn2++5IO+3H2O=2MnO+5IO+6H+。IO在反应中化合价降低,得电子,作氧化剂,具有氧化性,A正确;反应中IO是氧化剂,MnO是氧化产物,则氧化性:MnO<IO,B正确;反应中锰离子失电子作还原剂,则Mn2+是还原剂,具有还原性,C正确;反应方程式:2Mn2++5IO+3H2O=2MnO+5IO+6H+,Mn元素的化合价从+2价升高到+7价,则若有2个Mn2+参加反应,则转移10个电子,D错误。
10、(2023广东广州高一西关外国语学校校考期末)现有下列物质:①晶体②铜 ③稀硫酸④⑤熔融⑥溶液⑦红褐色的氢氧化铁胶体⑧氨水⑨稀硝酸 ⑩
(1)上述物质属于电解质的有_______(填编号,下同),属于非电解质的有_______,能导电的有_______。
(2)将③逐滴加入⑥中直至过量,写出反应的离子方程式_______。
(3)高铁酸钠是一种新型的净水剂,可以通过下述反应制取:
①该反应中氧化剂与还原剂的个数比为_______。
②用双线桥在方程式中标出电子转移的情况:_______。
③当反应中有1个离子生成时,转移的电子数是_______个。
【答案】(1)①⑤⑩ ④ ②③⑤⑥⑦⑧⑨
(2)
(3)3:2 3
【解析】(1)①晶体溶于水导电,属于电解质,本身不导电;②铜是金属单质,既不是电解质也不是非电解质,能导电;③稀硫酸是混合物,既不是电解质也不是非电解质,能导电;④CO2不能电离,属于非电解质,也不能导电;⑤熔融能导电,属于电解质;⑥Ba(OH)2溶液是混合物,既不是电解质也不是非电解质,能导电;⑦红褐色的氢氧化铁胶体是混合物,既不是电解质也不是非电解质,能导电;⑧氨水是混合物,既不是电解质也不是非电解质,能导电;⑨稀硝酸是混合物,既不是电解质也不是非电解质,能导电;⑩溶于水导电,属于电解质,本身不导电;上述物质属于电解质的是①⑤⑩;属于非电解质的是④;能导电的有②③⑤⑥⑦⑧⑨。
(2)将稀硫酸逐滴加入Ba(OH)2溶液中直至过量,反应的离子方程式。
(3)高铁酸钠是一种新型的净水剂,可以通过下述反应制取:
①该反应中Cl的化合价由+1价得电子化合价降低到-1价,被还原,发生还原反应,NaClO是氧化 剂,还原产物为NaCl,Fe元素化合价由+3价失电子化合价升高到+6价,Fe元素被氧化,发生氧化反应,Fe(OH)3是还原剂,Na2FeO4是氧化产物,则该反应中氧化剂与还原剂的个数比为3:2。
②Fe元素化合价由+3价升高为+6价,共升高3价,NaClO生成NaCl,Cl元素的化合价由+1价降低为-1价,降低2价,根据最小公倍法转移的电子数为6,用双线桥在方程式中标出电子转移的情况为:。
③Fe元素化合价由+3价失电子化合价升高到+6价,当反应中有1个离子生成时,转物质类别
实例
还原产物
活泼非金
属单质
X2(卤素单质)
X-
O2(H+)
H2O
高价化合
物或离子
氧化物
MnO2
Mn2+
含氧酸
浓硫酸
SO2
硝酸
NO或NO2
盐
KMnO4(H+)
Mn2+
Cr2Oeq \\al(2-,7)(H+)
Cr3+
FeCl3
Fe2+
物质类别
实例
氧化产物
活泼金属单质
Zn
Zn2+
非金属单质
H2
H2O
C
CO2
低价化合物
或离子
氧化物
CO
CO2
氢化物
H2S
S
盐
KI
I2
中间价态的微粒
Fe2+
SO2、H2SO3、SOeq \\al(2-,3)
H2O2
氧化产物
Fe3+
SOeq \\al(2-,4)
O2
还原产物
Fe
S
H2O
主要性质
还原性
还原性
氧化性
相关试卷
这是一份第16讲 化学键-【暑假衔接】新高一化学暑假讲义+习题(人教版2019必修第一册),文件包含第16讲化学键-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册原卷版docx、第16讲化学键-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份第12讲 金属材料-【暑假衔接】新高一化学暑假讲义+习题(人教版2019必修第一册),文件包含第12讲金属材料-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册原卷版docx、第12讲金属材料-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
这是一份第11讲 铁及其化合物-【暑假衔接】新高一化学暑假讲义+习题(人教版2019必修第一册),文件包含第11讲铁及其化合物-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册原卷版docx、第11讲铁及其化合物-暑假弯道超车新高一化学暑假讲义+习题人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。









