






化学鲁科版 (2019)微项目 补铁剂中铁元素的检验——应用配合物进行物质检验教课内容课件ppt
展开项目活动1 补铁药片中铁元素价态的检验
项目活动2 寻找更优的检验试剂
学以致用·随堂检测全达标
目 录 索 引
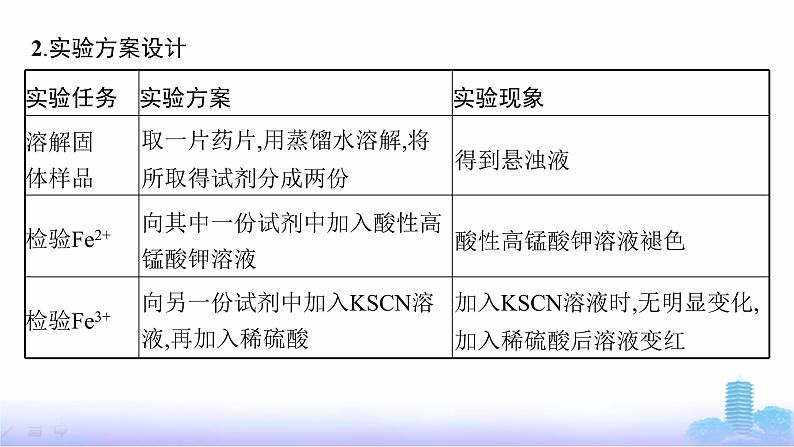
1.实验目的检验补铁药片中铁元素是否为 ,并检验该药片在保存过程中铁元素是否被部分氧化为 。
名师点拨左侧实验方案中向其中一份试剂中加入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色只能说明溶液中存在具有还原性的物质,补铁剂中可能存在其他还原性物质,因此无法说明溶液中一定存在Fe2+。深度思考为什么加入KSCN溶液时,无明显变化,加入稀硫酸后溶液变红?这说明了什么问题?
提示 SCN-与OH-在溶液中会竞争结合Fe3+,在pH<3时,SCN-可以竞争到Fe3+。说明用SCN-检验Fe3+须在酸性条件下进行。
正误判断(1)向某溶液中加入氢氧化钠溶液,产生红褐色沉淀,说明溶液中含有Fe3+。( )(2)向某溶液中加入KSCN溶液,无明显现象,说明溶液中不含Fe3+。( )提示 需要在酸性环境下用KSCN溶液检验Fe3+。(3)溶液中同时存在Fe2+和Fe3+时,可以用氢氧化钠溶液检验Fe2+。( )提示 Fe3+遇见氢氧化钠溶液会产生红褐色沉淀,对Fe2+的检验产生干扰。
探究角度 Fe2+、Fe3+的检验例题 选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂顺序能达到实验目的的是( )
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。溴水符合条件,实验现象是溴水颜色变浅,酸性KMnO4溶液也符合条件: 5Fe2++ +8H+══5Fe3++Mn2++4H2O,实验现象是溶液紫色变浅。乙组,在Fe2+存在的条件下检验Fe3+,用KSCN溶液检验Fe3+即可,Fe2+不会造成干扰。
名师点拨 审清题意,甲组在Fe3+存在的条件下检验Fe2+,言外之意溶液中不存在其他还原性的物质,可以通过高锰酸钾紫红色褪去的现象验证Fe2+的存在。若是未知溶液中,加入酸性高锰酸钾溶液,高锰酸钾溶液褪色,不能说明溶液中存在Fe2+。
[对点训练]实验小组探究某补铁口服液中铁元素的价态。查阅资料:KSCN中的硫元素为-2价,易被氧化为+6价。实验过程:
分析与解释:(1)由实验Ⅰ可得出的结论是 。 (2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为+2价,滴加H2O2溶液后Fe2+发生反应的离子方程式为 。 (3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是 ;小组同学为证实自己的猜想,设计如下对照实验:向1 mL 0.1 ml·L-1 KSCN溶液中加入足量5% H2O2溶液,再加入BaCl2溶液,观察到 ,证实了小组同学的猜想是正确的。
补铁口服液中不含Fe3+
2Fe2++H2O2+2H+══2Fe3++2H2O
SCN-中的硫元素为-2价,具有强还原性,被H2O2氧化
(4)该实验小组利用铁粉、锌粉、0.1 ml·L-1 FeCl3溶液、0.1 ml·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+的还原性、氧化性,用上述所给物质写出体现Fe2+具有还原性的化学方程式: 。(5)该实验小组为探究“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉的实验方案,该反应的离子方程式为 。
2FeCl2+Cl2══2FeCl3
Zn+Fe2+══Fe+Zn2+
解析 KSCN溶液和Fe3+发生反应,使溶液变红,实验Ⅰ向补铁口服液中加入1 mL稀硫酸,再滴入5滴0.1 ml·L-1 KSCN溶液,无明显现象,说明补铁口服液中不含Fe3+;实验Ⅱ,向实验Ⅰ中所得溶液加入1 mL 5% H2O2溶液,溶液变红,说明Fe2+被氧化成Fe3+。补铁口服液中铁元素的价态为+2价,滴加H2O2溶液,Fe2+被氧化成Fe3+,则滴加H2O2溶液后Fe2+发生反应的离子方程式为2Fe2++H2O2+2H+══2Fe3++2H2O。由题目信息可知,KSCN中的硫元素为-2价,易被氧化为+6价,所以一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是SCN-中的硫元素为-2价,具有强还原性,被H2O2氧化成硫酸根,则加入BaCl2溶液,生成白色沉淀BaSO4。(4)在反应中Fe2+做还原剂,体现其还原性,因此应选择氧化剂,可选用新制氯水,发生的反应为2FeCl2+Cl2══2FeCl3。(5)“Fe2+具有氧化性”,向FeCl2溶液中加入锌粉,该反应的离子方程式为Zn+Fe2+══Fe+Zn2+。
1.筛选检验试剂的方法许多金属配合物都有鲜艳的颜色,颜色越 ,越利于检验出金属离子;稳定性 ,受环境干扰越小。这是人们筛选检验试剂的思路。
2.探究配合物的形成(1)请预测下列物质能否与Fe2+、Fe3+形成配合物,若能形成,会是与哪个原子形成配位键?供选用的试剂:苯酚( )、硫氰酸钾(KSCN)、邻二氮菲( )、乙二胺四乙酸二钠盐(EDTA-2Na)。
(2)实验方案设计设计思路:生成配合物时大多数试剂会发生颜色的变化①检验邻二氮菲是否与Fe2+形成配位键实验方案:取少量FeCl2溶液于试管中,向试管中滴入几滴邻二氮菲。实验现象:溶液变为 色。 实验结论:Fe2+与邻二氮菲形成配合物。②检验苯酚溶液和EDTA-2Na溶液是否与Fe3+形成配位键实验方案:分别取少量FeCl3溶液于两支试管中,向其中一支试管中滴入几滴苯酚溶液,向另外一支试管中滴入几滴EDTA-2Na溶液。实验现象:滴入苯酚溶液的显 色,滴入EDTA-2Na溶液的呈 色。 实验结论:Fe3+与苯酚、EDTA-2Na均可形成配合物。
3.探究酸碱性对配合物显色的影响(1)探究酸碱性对邻二氮菲与Fe2+配位的影响实验方案:取少量FeCl2溶液于试管中,先滴入邻二氮菲试剂,然后逐滴加入盐酸调节pH至橙红色消失,记录此时的pH,再逐滴加入氢氧化钠溶液调节pH至橙红色消失,记录此时pH。实验现象:Fe2+与邻二氮菲形成橙红色的配合物后,加入盐酸,橙红色 ,再加入氢氧化钠溶液,橙红色 。 实验结论:当H+浓度高时,邻二氮菲中的N会优先与H+形成配位键,导致与金属离子的配位能力减弱。若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
(2)探究酸碱性对硫氰酸钾与Fe3+配位的影响实验方案:向FeCl3溶液中加入盐酸,再滴入硫氰酸钾溶液,然后逐滴加入氢氧化钠溶液。实验现象:盐酸存在时,滴入硫氰酸钾,溶液 ,然后随着氢氧化钠溶液的滴加,红色 。 实验结论: 。
SCN-与Fe3+须在酸性条件下才可以配位
4.探究配合物的稳定性(1)探究EDTA-2Na、KSCN与Fe3+配位的稳定性实验方案:向FeCl3溶液中滴入硫氰酸钾溶液,再滴入EDTA-2Na溶液。实验现象:滴入硫氰酸钾后,溶液变红,再滴入EDTA-2Na,溶液变黄。实验结论: 与Fe3+配位更稳定。 (2)探究EDTA-2Na、苯酚与Fe3+配位的稳定性实验方案:向FeCl3溶液中滴入苯酚溶液,再滴入EDTA-2Na溶液。实验现象:滴入苯酚后,溶液显紫色,再滴入EDTA-2Na溶液变为黄色。实验结论: 与Fe3+配位更稳定。
5.检验Fe2+、Fe3+的特效试剂与使用条件(1)Fe2+的检验:邻二氮菲是Fe2+检验的特效试剂,其显色与溶液的pH有关,适宜pH范围为2~9。(2)Fe3+的检验:硫氰酸钾是检验Fe3+的特效试剂,但检验过程受溶液pH的影响,其中检验时的pH<3。(3)检验Fe2+、Fe3+的另外特效试剂①Fe3+的检验:亚铁氰化钾K4[Fe(CN)6]可以检验,现象是有蓝色沉淀产生;②Fe2+的检验:铁氰化钾K3[Fe(CN)6]可以检验,现象是有蓝色沉淀产生。
名师点拨(1)螯合物是具有环状结构的配合物,是通过两个或多个配体与同一金属离子形成螯合环的螯合作用而得到。如EDTA-2Na溶液中,每个EDTA2-可以电离出2个H+,生成EDTA4-,然后与金属离子配位。EDTA4-中的2个N、4个O都可以与金属离子结合,这类配体称为多齿配体,形成的配合物称为螯合物,具有更高的稳定性。(2)螯合物比金属离子与其配体生成的类似配合物有更高的稳定性,由螯合作用得到的某些金属螯合剂用途很广。例如,EDTA为六齿螯合剂,可用于水的软化、食物的保存等;环状配体冠醚类螯合剂适用于碱金属、碱土金属(ⅡA族)的分离和分析。
归纳总结配合物在检验离子中的应用(1)配体结合中心离子的强弱关系:一般是配体中可配位的原子越多越稳定,稳定性弱的配合物在一定条件下可以转化成稳定性强的配合物。(2)影响因素:溶液的酸碱性、中心离子和配体浓度。
正误判断(1)向FeCl3溶液中滴入硫氰酸钾溶液,溶液变红,再滴入EDTA-2Na溶液,溶液变黄,说明EDTA-2Na与Fe3+配位更稳定。( )(2)可以用苯酚溶液检验Fe2+。( )提示 可以用苯酚溶液检验Fe3+。(3)铁氰化钾K3[Fe(CN)6]可以检验Fe3+,现象是有蓝色沉淀产生。( )提示 铁氰化钾K3[Fe(CN)6]可以检验Fe2+,现象是有蓝色沉淀产生。(4)用邻二氮菲检验Fe2+时H+浓度过大或者OH-浓度过大都不可以。( )
探究角度 配合物与离子检验例题 二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室可用邻二氮菲( )测定铁的含量,邻二氮菲能与Fe2+形成橙红色配离子,该配离子中Fe2+与氮原子形成的配位键共有( )A.6个B.4个C.2个D.8个
解析 铁与氮原子之间形成配位键,由题图可知,该配离子中亚铁离子与氮原子形成的配位键共有6个。
思路解析 邻二氮菲为稠环化合物,为平面分子,含有大π键。C、N为sp2杂化,每个N原子中的5个价电子,4个电子参与sp2杂化;1个电子未参与杂化,参与大π键的形成。N杂化形成的sp2轨道上有2个单电子与碳原子的单电子形成共价键,还有1个sp2轨道容纳1对孤电子对,Fe2+的价电子排布为3d6,电子重排,发生d2sp3杂化,提供6个空轨道,与N原子形成6个配位键。
[对点训练]Fe3+的配位化合物较稳定且应用广泛。Fe3+可与H2O、SCN-、F-等配体形成使溶液呈淡紫色的[Fe(H2O)6]3+、红色的[Fe(SCN)6]3-、无色的[FeF6]3-配离子。某同学按如下步骤完成实验:已知:向C2+的溶液中加入KSCN溶液生成蓝色的[C(SCN)4]2-配离子;C2+不能与F-形成配离子。下列说法不正确的是( )A.Fe第四电离能(I4)大于其第三电离能(I3)B.Ⅰ中溶液呈黄色可能是由Fe3+水解产物的颜色造成C.可用NaF和KSCN溶液检验FeCl3溶液中是否含有C2+D.[Fe(H2O)6]3+中H—O—H的键角与H2O分子中H—O—H的键角相等
解析 Fe3+的价电子排布式为3d5,3d轨道处于半满状态,电子的能量低,失电子困难,所以Fe的第四电离能(I4)大于其第三电离能(I3),A正确;Ⅰ中Fe(NO3)3溶于水后,Fe3+发生水解,未充分酸化的水溶液会由于有[Fe(OH)]2+存在而显黄色,B正确;先往溶液中加入足量的NaF溶液,再加入KSCN溶液,若溶液呈蓝色,则表明含有C2+,否则不含C2+,C正确;[Fe(H2O)6]3+中H2O分子内O原子最外层只存在一对孤电子对,对H—O—H中O—H键的排斥作用减小,所以键角比H2O分子中H—O—H的键角大,D不正确。
1.在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是( )A.该配离子中的配位原子只有NB.该配离子中铜离子的配位数是4C.基态Cu原子的价电子排布式是3d104s1D.该配离子中非金属元素的电负性大小顺序为O>N>C>H
解析 由该配离子的结构可知,该配离子中铜离子的配位数是4,B项正确;Cu原子的核外电子数为29,Cu位于元素周期表中第4周期ⅠB族,其基态原子的价电子排布式为3d104s1,C项正确;元素非金属性越强,其电负性越大,同一周期主族元素的电负性从左到右逐渐增大,故该配离子中非金属元素的电负性大小顺序为O>N>C>H,D项正确。
2.已知某紫色配合物的组成为CCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,同时产生C2O3沉淀;向一定量该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,待沉淀完全后过滤,再加过量AgNO3溶液于滤液中,无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一。则该配合物的化学式最可能为( )A.[CCl2(NH3)4]Cl·NH3·H2OB.[C(NH3)5(H2O)]Cl3C.[CCl(NH3)3(H2O)]Cl2·2NH3D.[CCl(NH3)5]Cl2·H2O
解析 CCl3·5NH3·H2O的水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,说明NH3均在内界,向该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,说明该配合物外界有Cl-,过滤后再加过量AgNO3溶液于滤液中无变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一,说明该配合物内界也含有Cl-,且外界的Cl-与内界的Cl-个数之比为2∶1。综上分析,D项最有可能。
3.回答下列问题:(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是 。 (2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在 (填字母,下同)。 a.离子键 b.配位键 c.共价键
(3)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是 。A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.[Cu(NH3)4]2+的立体结构为正四面体形D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道(4)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有 和 。
解析 (1)BCl3分子中的B原子的1个2s轨道和2个2p轨道进行sp2杂化形成3个sp2杂化轨道。B原子还有1个空轨道(未杂化的2p轨道),所以B原子与X形成配位键时,X应提供孤电子对。
(4)Cu2+中存在空轨道,NH3中N原子上有孤电子对,N与Cu2+之间以配位键结合、[Cu(NH3)4]2+与Cl-间以离子键结合。
4.丁二酮肟可用于镍的检验和测定,其结构如图:
(1)Ni元素基态原子电子排布式为 ,价电子轨道表示式为 ,其中未成对电子数为 。C、N、O第一电离能由大到小的顺序是 。
1s22s22p63s23p63d84s2
(2)1 ml丁二酮肟含有的σ键数目是 ,已知CN-与N2互为等电子体。推算HCN分子中σ键和π键数目之比为 。 (3)与氮原子同族的P的最简单氢化物,它的空间结构是 ,它是含有 键的 分子。 (4) 的杂化方式是 ,它的空间结构是 。 (5)丁二酮肟镍分子内含有的作用力有 (填字母)。 a.配位键b.离子键c.氢键d.范德华力
解析 (1)Ni元素为28号元素,基态原子电子排布式为1s22s22p63s23p63d84s2,价电子轨道表示式为 ,其中未成对电子数为2。同一周期元素随着原子序数增大,第一电离能呈增大趋势,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故C、N、O的第一电离能大小: N>O>C。(2)单键均为σ键,双键中含有1个σ键和1个π键,由结构可知,1 ml丁二酮肟含有σ键的数目是15NA,1个N2中含有1个σ键和2个π键,已知CN-与N2互为等电子体,则1分子HCN中σ键和π键数目分别为2、2,两者之比为1∶1。
高中化学鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质微项目 补铁剂中铁元素的检验——应用配合物进行物质检验课文内容ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002605_t3/?tag_id=26" target="_blank">第2章 微粒间相互作用与物质性质微项目 补铁剂中铁元素的检验——应用配合物进行物质检验课文内容ppt课件</a>,共43页。PPT课件主要包含了实验方案设计,产生白色沉淀,逐渐变浅,先逐渐加深后又变浅,EDTA-2Na,abc,离子键,配位键,NOC,三角锥形等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2微项目 补铁剂中铁元素的检验——应用配合物进行物质检验教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 补铁剂中铁元素的检验——应用配合物进行物质检验教课内容课件ppt,共50页。
化学选择性必修2第2章 微粒间相互作用与物质性质微项目 补铁剂中铁元素的检验——应用配合物进行物质检验说课ppt课件: 这是一份化学选择性必修2第2章 微粒间相互作用与物质性质微项目 补铁剂中铁元素的检验——应用配合物进行物质检验说课ppt课件,共51页。PPT课件主要包含了课前自主学习,课堂合作探究,课堂素养达标等内容,欢迎下载使用。













