






鲁科版 (2019)选择性必修2微项目 补铁剂中铁元素的检验——应用配合物进行物质检验备课课件ppt
展开【归纳整合】1.原子结构与元素周期表和元素周期律
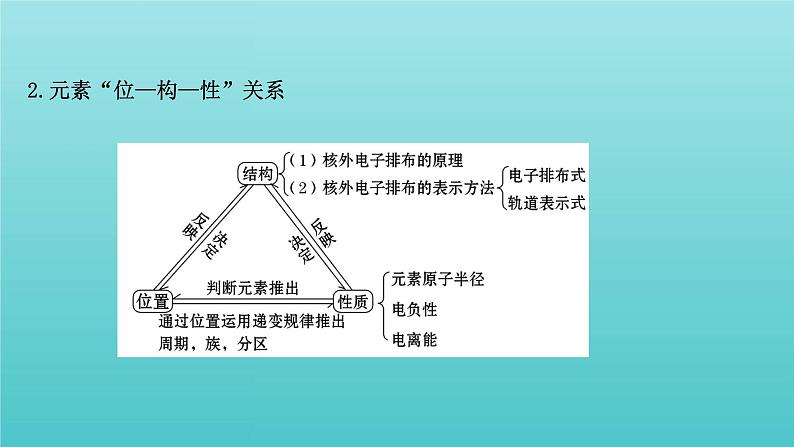
2.元素“位—构—性”关系
【典例示范】【典例】(2020·平顶山高二检测)有四种短周期元素,它们的结构、性质等信息如表所述。
请根据表中信息填写: (1)A原子的核外电子排布式:________。 (2)B元素在周期表中的位置:________; 离子半径:B________A(填“大于”或“小于”)。 (3)C原子的核外电子轨道表示式是____________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子。 (4)D原子的核外电子排布式为________,D-的结构示意图是____________。
【思维建模】解答本题需要注意以下三点:(1)根据元素的特殊性质推测元素在周期表中的位置;(2)根据元素在周期表中的位置推测元素的性质或者结构;(3)根据元素的结构推测元素在周期表中的位置或元素的性质。
【解析】根据题中信息可推出:A为Na,B为Al,C为N,D为Cl。(1)Na核外电子排布式为1s22s22p63s1或[Ne]3s1。(2)B为Al,其在元素周期表中的位置为第三周期ⅢA族,Na+与Al3+核外电子排布相同,核电荷数后者大于前者,故r(Al3+)
【母题追问】(1)指出A元素与B元素的电离能高低。提示:由于钠元素与铝元素是同一周期元素,同周期元素第一电离能呈增大趋势,因此钠的第一电离能小于铝的。(2)指出C元素与D元素的电负性高低。提示:由于氮元素的非金属性不如氯强,因此电负性数值氮元素小于氯元素。
【素养训练】1.(2020·山东等级考)短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )A.第一电离能:W>X>Y>ZB.简单离子的还原性:Y>X>WC.简单离子的半径:W>X>Y>ZD.氢化物水溶液的酸性:Y>W
【解析】选C。四种短周期主族元素,基态X原子的电子总数是其最高能级电子数的2倍,若X为第二周期元素原子,则X可能为Be或O,若X为第三周期元素原子,则均不满足题意,Z与X能形成Z2X2的淡黄色化合物,该淡黄色化合物为Na2O2,则X为O元素,Z为Na元素;Y与W的最外层电子数相同,则Y为F元素,W为Cl元素。同一周期从左向右第一电离能总趋势为逐渐增大,同一主族从上到下第一电离能逐渐减小,故四种元素中第一电离能从大到小的顺序为F>O>Cl>Na,A错误;O、F、Cl三种元素的简单离子中,F-还原性最弱,B错误;电子层数越多简单离子半径越大,相同结构的离子,原子序数越大半径越小,故四种元素中离子半径从大到小的顺序为Cl->O2->F->Na+,C正确;F元素的非金属性强于Cl元素,则形成氢化物后F原子束缚H原子的能力强于Cl原子,在水溶液中HF不容易发生电离,故HCl的酸性强于HF,D错误。
2.(双选)(2020·蚌埠高二检测)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物是离子化合物D.Y和Z两者最高价氧化物对应的水化物能相互反应【解析】选B、D。非金属性越强,对应气态氢化物就越稳定,所以HCl比H2S稳定,即B项正确;Y和Z的最高价氧化物对应的水化物分别是NaOH和Al(OH)3,因Al(OH)3为两性氢氧化物,既能与酸反应又能与强碱溶液反应,所以D项正确;A项中应该是Y>Z>X,所以不正确;C项中硫酸为共价化合物,所以不正确。
【补偿训练】已知M元素原子的价电子排布式为3s23p1,N元素位于元素周期表中第3周期,其原子最外层p轨道为半充满状态,下列叙述错误的是( )A.M为金属元素,N为非金属元素B.M与N为同周期元素C.N的电负性大于MD.M的第一电离能大于N【解析】选D。由题意可得M为Al元素,N为P元素,故A、B、C均正确。P的第一电离能比Al大,D错误。
3.下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.W元素的第一电离能小于Y元素的第一电离能B.Y、Z的阴离子电子层结构都与R原子的相同C.p能级未成对电子最多的是Z元素D.X元素是电负性最大的元素【解析】选D。由题干信息知:X为F、W为P、Y为S、Z为Br、R为Ar,第一电离能P>S,A项错误;Br-比Ar多一个电子层,B项错误;p能级未成对电子最多的是P,有3个,C项错误;F元素是电负性最大的元素,D正确。
【补偿训练】如图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
把与元素有关性质相符的曲线的标号填入相应横线上:(1)ⅡA族元素原子的价电子数____________。 (2)第3周期元素的最高正化合价____________。 (3)F-、Na+、Mg2+、Al3+四种离子的离子半径______________________。 (4)第2周期元素的原子半径(不包括稀有气体)____________________。 (5)第2周期元素的第一电离能________________________________。
【解析】(1)ⅡA族元素原子的价电子数均为2,B符合。(2)第3周期元素的最高正价由+1~+7~0,C符合。(3)F-、Na+、Mg2+、Al3+的离子半径依次减小,A符合。(4)第2周期元素的原子半径从左到右依次减小,D符合。(5)第2周期元素的第一电离能由小到大的顺序为E(Li)
“ ”(nǐ)、“镆”(mò)、“ ”(tián)、“ ”(à),这4个生僻字成为113号、115号、117号、118号元素的中文名称。
【素养探究】【探究一】未知元素的结构与性质探究2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。
(1)49In元素的价电子排布式如何书写?原子中未成对电子的个数是多少?提示:根据核外电子排布规律可以判断该元素的价电子排布式为5s25p1,原子中有一个未成对电子。(2)该元素在周期表的哪个位置?属于哪个分区?提示:根据该元素原子的价电子排布式判断该元素为第五周期第ⅢA族元素,由于最后一个电子落在p轨道上,因此该元素属于p区元素。(3)试比较该元素与铷(37Rb)的原子半径及简单离子半径大小。提示:由于这两种元素属于同一周期元素,从左往右元素的原子半径逐渐减小,因此原子半径Rb大于In;形成离子时,由于两种元素均为金属元素,均失电子形成金属阳离子,因此离子半径与原子半径顺序相同。
(4)试比较两者的第一电离能大小。提示:两元素属于同一周期的主族元素,从左往右元素的第一电离能呈增大趋势。(5)试比较两者所形成的最高价氧化物对应水化物的碱性强弱。提示:In是第五周期第ⅢA族元素,Rb为第五周期第ⅠA族元素,金属性In
(3)“镆”(mò)为115号元素,试比较两元素的电负性大小。提示:同周期元素的电负性从左往右逐渐增大,Ts位于镆右侧,电负性比镆大。(4)比较Ts与Br的原子半径大小。提示:同主族元素的原子半径从上到下逐渐增大,Ts位于同族最下端,它的原子半径大于溴元素。
【素养解读】1.核心素养:(1)宏观辨识与微观探析:能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念。(2)证据推理与模型认知:具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设。2.素养目标:通过课题的探究学习,建立原子结构与元素在周期表中的位置及元素性质之间的联系。
高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表复习课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表复习课件ppt,共16页。PPT课件主要包含了网络体系构建,2元素周期律,素养应用提升等内容,欢迎下载使用。
化学第2节 原子结构与元素周期表复习课件ppt: 这是一份化学第2节 原子结构与元素周期表复习课件ppt,共6页。PPT课件主要包含了核心整合·思维导图,情境探究·素养提升等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质示范课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质示范课ppt课件,共42页。PPT课件主要包含了必备知识·素养奠基,加成反应,取代反应,正找负负找正,关键能力·素养形成,蓝色絮状沉淀,红色沉淀,②银镜反应,光亮的银镜,3碳碳双键的检验等内容,欢迎下载使用。













