山东省青岛第二中学2023-2024学年高二下学期期末考试化学试题
展开1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,1ml硝酸铵溶于稀氨水使溶液呈中性,则NH4+数目为NA
B.在过氧化钠与水的反应中,每生成0.1ml O2,转移电子的数目为0.4NA
C.1ml乙二酸(H2C2O4)分子中П键的数目为3NA
D.室温下,pH=12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA
2.金属的冶炼体现了人类文明的发展历程,下列关于金属冶炼的说法不正确的是( )
A.不活泼金属如铂、金等,在自然界中可以以单质的形态存在,可以采用物理方法提纯
B.高炉炼铁原料为石灰石、焦炭和赤铁矿,是利用碳单质还原Fe2O3的反应产生纯铁
C.冶炼金属铝时要加入冰晶石,其目的是降低氧化铝的熔点
D.电解熔融的NaCl获得金属Na
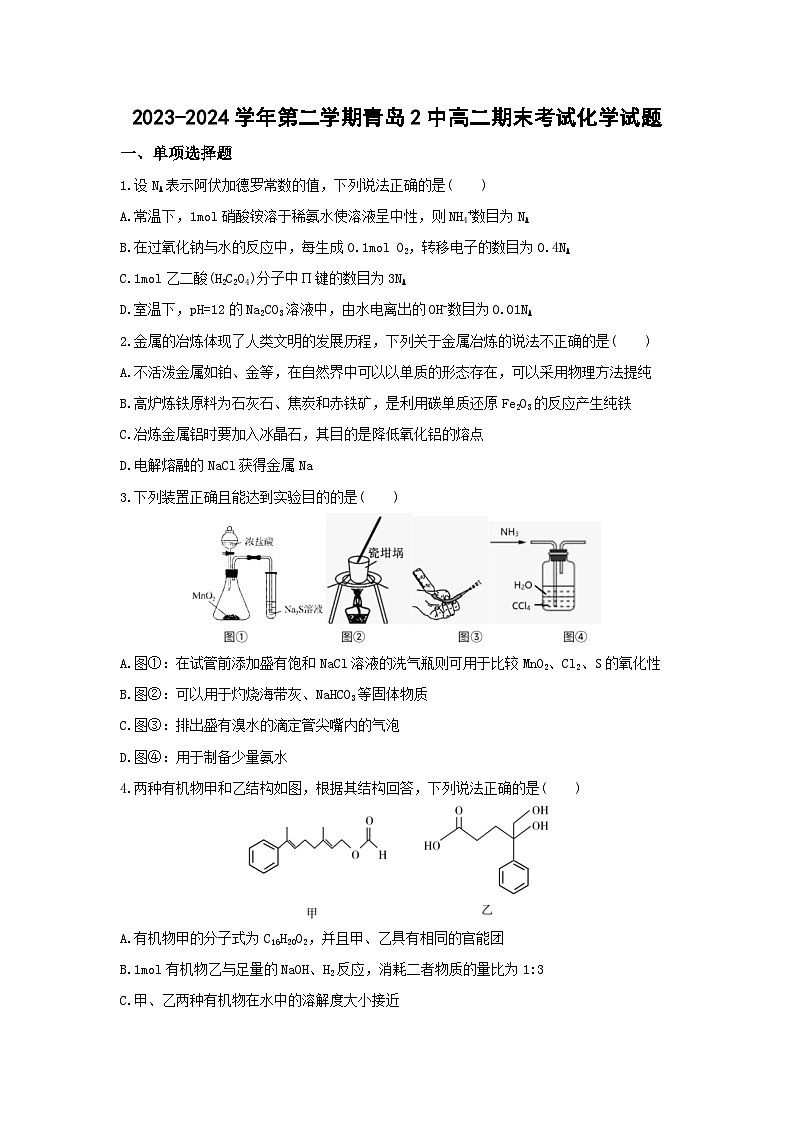
3.下列装置正确且能达到实验目的的是( )
A.图①:在试管前添加盛有饱和NaCl溶液的洗气瓶则可用于比较MnO2、Cl2、S的氧化性
B.图②:可以用于灼烧海带灰、NaHCO3等固体物质
C.图③:排出盛有溴水的滴定管尖嘴内的气泡
D.图④:用于制备少量氨水
4.两种有机物甲和乙结构如图,根据其结构回答,下列说法正确的是( )
A.有机物甲的分子式为C16H20O2,并且甲、乙具有相同的官能团
B.1ml有机物乙与足量的NaOH、H2反应,消耗二者物质的量比为1:3
C.甲、乙两种有机物在水中的溶解度大小接近
D.可用酸性KMnO4溶液检验甲中的碳碳双键和乙中的羟基
5.有关物质的分离除杂,下列说法正确的是( )
A.可用溴的四氯化碳溶液除去甲烷中的乙烯
B.向2mL 10%的CuSO4溶液中滴入2%的NaOH溶液4至6滴,得到新制的Cu(OH)2悬浊液,然后加入甲酸甲酯溶液0.5mL,振荡后加热,产生砖红色沉淀,证明甲酸甲酯具有还原性
C.只用水不能用来鉴别苯和溴苯
D.用溴的四氯化碳溶液和酸性高锰酸钾溶液可以鉴别已烷、1-己烯和邻二甲苯
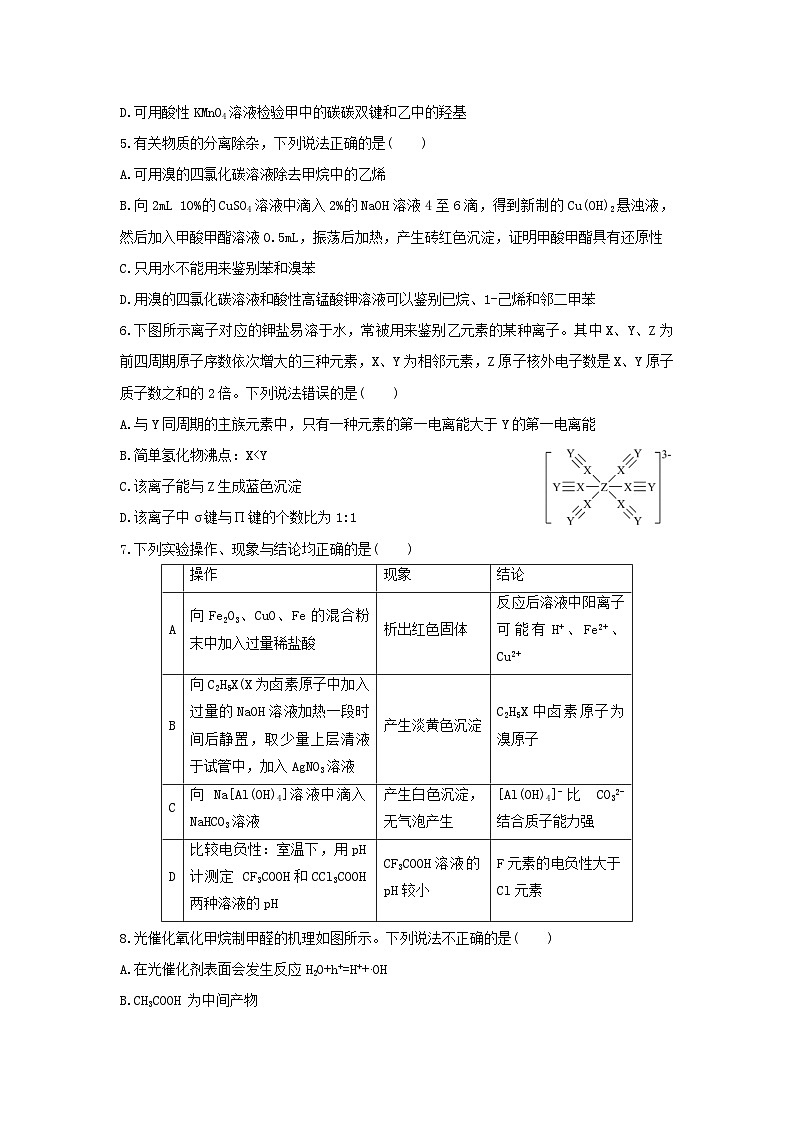
6.下图所示离子对应的钾盐易溶于水,常被用来鉴别乙元素的某种离子。其中X、Y、Z为前四周期原子序数依次增大的三种元素,X、Y为相邻元素,Z原子核外电子数是X、Y原子质子数之和的2倍。下列说法错误的是( )
A.与Y同周期的主族元素中,只有一种元素的第一电离能大于Y的第一电离能
B.简单氢化物沸点:X
D.该离子中σ键与П键的个数比为1:1
7.下列实验操作、现象与结论均正确的是( )
8.光催化氧化甲烷制甲醛的机理如图所示。下列说法不正确的是( )
A.在光催化剂表面会发生反应H2O+h+=H++·OH
B.CH3COOH 为中间产物
C.上述过程中有非极性键的断裂与生成
D.含O分子参与的反应一定有电子转移
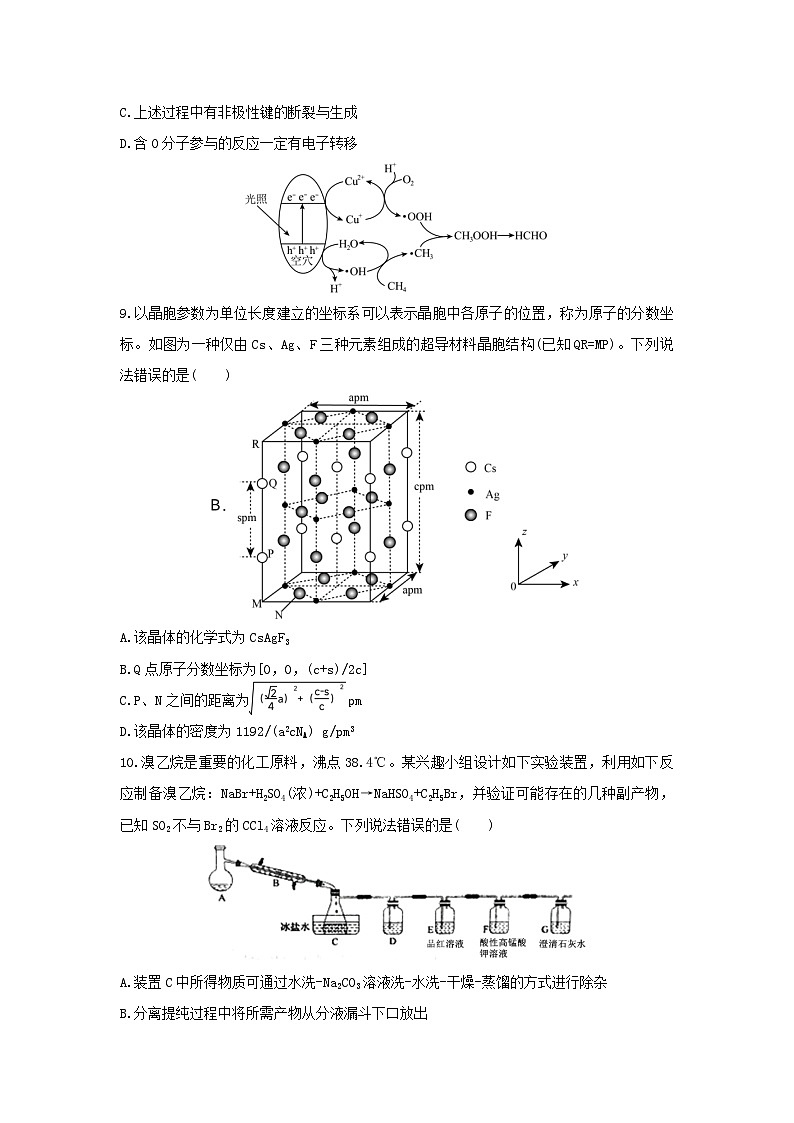
9.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。如图为一种仅由Cs、Ag、F三种元素组成的超导材料晶胞结构(已知QR=MP)。下列说法错误的是( )
A.该晶体的化学式为CsAgF3
B.Q点原子分数坐标为[0,0,(c+s)/2c]
C.P、N之间的距离为 pm
D.该晶体的密度为1192/(a2cNA) g/pm3
10.溴乙烷是重要的化工原料,沸点38.4℃。某兴趣小组设计如下实验装置,利用如下反应制备溴乙烷:NaBr+H2SO4(浓)+C2H5OH→NaHSO4+C2H5Br,并验证可能存在的几种副产物,已知SO2不与Br2的CCl4溶液反应。下列说法错误的是( )
A.装置C中所得物质可通过水洗-Na2CO3溶液洗-水洗-干燥-蒸馏的方式进行除杂
B.分离提纯过程中将所需产物从分液漏斗下口放出
C.装置D 中盛有Br2的CCl4溶液,用于检验存在副产物乙烯
D.装置G中有白色沉淀的产生即可证明一定有CO2的生成
二、不定项选择题
11.锂-空气电池的结构如下图,已知两极的电解质溶液分别为水性电解液和有机电解质。下列说法正确的是( )
A.隔膜中转移的是锂离子
B.左侧为水性电解液,右侧为有机电解质
C.正极电极反应方程式为4Li++O2+4e-=2Li2O
D.用此电池为铅酸蓄电池充电,消耗7g锂时,铅酸蓄电池消耗9g水
12.实验室常用分析试剂与氧化剂硝酸铈铵(NH4)2Ce(NO3)6,易溶于水和乙醇,几乎不溶于浓硝酸,实验室利用如下步骤制备。在如下图装置中制备NH4HCO3并与CeCl3反应,制备难溶于水的Ce2(CO3)3,再加硝酸溶解,加入氨水调节pH,生成Ce(OH)4沉淀,过滤后在滤渣中加入浓HNO3和NH4NO3得到(NH4)2Ce(NO3)6晶体。下列说法错误的是( )
A.装置A中制备NH3,实验过程中旋塞打开顺序为c→a→b
B.装置B中冷水作用为降低Ce2(CO3)3的溶解度
C.Ce(OH)4制备方程式为3Ce2(CO3)3+2NO3-+16NH3·H2O+18H+=6Ce(OH)4↓+16NH4++2NO↑+9CO2+5H2O
D.制得(NH4)2Ce(NO3)6晶体应洗涤后及时放入烘箱高温烘干
13.关于制备有机物E的反应过程如下,下列说法正确的是( )
A.有机物A与B可以发生缩聚反应
B.有机物C可以发生水解反应生成A和B
C.与有机物D具有相同官能团的芳香族化合物的同分异构体有3种
D.以上两步生成有机物E的反应类型均为取代反应。
14.马日夫盐[Mn(H2PO4)2·2H2O]常用于机械设备的磷化处理,可起到防锈效果。以水锰矿[主要成分为MnO(OH),还含有少量的Fe2O3、Al2O3、SiO2及微量的CaO]为原料制备马日夫盐的一种工艺流程如下图所示。
已知:Ksp(CaF2)=3.6×10-12,当溶液中剩余的某金属离子浓度≤1×10-5ml/L时,通常认为该金属离子已沉淀完全。下列说法错误的是( )
A.步骤Ⅰ、Ⅱ、Ⅲ均涉及氧化还原反应
B.滤渣2的主要成分为 Fe(OH)3、Al(OH)3
C.“低温沉锰”时,将NH4HCO3换成Na2CO3效果更好
D.“除钙”步骤中控制c(F-)≥6×10-4ml/L可使Ca2+完全沉淀
15.用CO2和H2可以合成甲醇。其主要反应为:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-58kJ/ml
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41kJ/ml
在恒容密闭容器内,充入1ml CO2和3ml H2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图所示{选择性=[n(CO)或n(CH3OH)]/[n(CH3OH)+n(CO)]×100%}。下列说法正确的是( )
A.270℃时主要发生反应Ⅱ
B.230℃时缩小容器的体积,n(CO)不变
C.250℃达平衡时,n(H2O)=0.12ml
D.其他条件不变,210℃比230℃平衡时生成的CH3OH多
三、非选择题
16.过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态V的价电子排布式为________,第四周期中基态原子与基态V原子具有相同未成对电子数的元素名称是________。
(2)含有多个配位原子的配位体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图1所示,1ml EDTA通过螯合作用形成了5ml五元环。键角1____(填“>”、“<”或“=”)键角2。EDTA中非金属元素电负性由大到小排序为________。
(3)C2+在水溶液中以[C(H2O)6]2+存在。向含C2+的溶液中加入过量氨水可生成更稳定的[C(NH3)6]2+,其原因是_________________________________。
(4)铁、铜与砷、钠可形成一种绝缘体材料,其晶胞结构图和钠原子沿z轴投影如图2所示,已知m原子的分数坐标为(0.25,0.75,0.20),晶胞参数为a≠c,α=β=γ=90°。n 原子的分数坐标是________,铜周围距离最近的钠原子的个数是_____________________。
17.三元锂电池在新能源汽车中广泛使用,废旧三元锂电池的正极材料主要成分为Li(NixCyMnz)O2(其中含有Fe、Al的氧化物杂质),对各元素进行回收处理的某种工艺流程如图所示:
已知:①丁二酮肟与Ni2+络合生成丁二酮肟镍沉淀;
②金属活动性顺序:Li>Al>Mn>Fe>C>Ni>(H);
③氧化性:C3+>H2O2;高温条件下还原性:C>Mn;
④金属离子开始沉淀和完全沉淀的pH值如下表所示:
请从预处理、浸出和分离提纯的角度分析上述工艺流程中各步的原理,并回答下列问题:
(1)“含锂废液”中含锂元素的主要成分为__________(填化学式)。
(2)试剂a的加入目的是去除________;试剂a可选择____(填字母);“除杂”过程需调节pH范围为________。
A.氨水 B.NaOH C.Fe2O3 D.MnO2 E.CO
(3)Ni2+与丁二酮肟生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验Ni2+。
“沉镍”过程的最佳pH为5,pH不能过低的原因是_______________________。
(4)“沉钴”过程除发生C2++C2O42-=CC2O4外,还可能发生的离子方程式为___________。
18.以邻氨基苯酚、邻硝基苯酚、无水甘油和浓硫酸为原料合成8-羟基喹啉,该物质有一定苯酚的性质,反应过程与实验装置如下。
①在圆底烧瓶中称取19g无水甘油,并加入2.78g邻硝基苯酚、8.72g邻氨基苯酚,使混合均匀。然后缓缓加入9mL浓硫酸。装上回流冷凝装管,在石棉网上用小火加热。当溶液微沸时,立即移去火源。待作用缓和后,继续加热,保持反应物微沸2小时。
②稍冷后,进行第一次水蒸气蒸馏调节溶液呈酸性,除去未反应的邻硝基苯酚。瓶内液体冷却后,加入试剂调节溶液pH,再进行第二次水蒸气蒸馏,蒸出8-羟基喹啉(约收集馏液400mL)。馏出液充分冷却后,抽滤收集析出物洗涤,干燥。
③粗产物用乙醇-水混合溶剂重结晶得8-羟基喹啉6.5g。
(1)仪器A是________(填名称);图2装置中导管1的作用是________。
(2)产物提纯过程中有两次水蒸气蒸馏,第一次水蒸气蒸馏证明杂质被除尽的现象为_____。
(3)两次水蒸气蒸馏应控制pH值不同,第二次水蒸气蒸馏前应调节溶液呈____(填“酸”、“碱”、“中”)性,使其在该条件下,在水中的溶解度最小。
(4)图中虚线框内最合适的装置为____________(填序号)。
(5)8-羟基喹啉的熔点明显低于7-羟基喹啉( )和 6-羟基喹啉( )的原因是________________。
(6)该反应的产率为________。
19.2024年4月29日,2024碳达峰碳中和绿色发展论坛在北京举行。习近平总书记曾指出:“推进碳达峰碳中和是党中央经过深思熟虑作出的重大战略决策。”因此碳氧化物的综合利用成为近年研究热点。已知下列反应的ΔH:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH1=41kJ/ml
CO(g)+H2(g)=HCHO(g) ΔH2=6kJ/ml
HCHO(g)+H2(g)=CH3OH(g) ΔH3=121kJ/ml
(1)H2捕捉空气中CO2,可以合成加入汽油中的燃料甲醇。反应3H2+CO2(g)=CH3OH(g)+H2O(g)的ΔH=____(保留三位有效数字)
(2)1L容器通入3ml H2与1ml CO2,在一定温度下发生反应:3H2+CO2(g)=CH3OH(g)+H20(g)。一段时间后,反应达到平衡,测得反应后的容器中的总压强为反应前的75%,则平衡时甲醇的浓度为_______,若平衡时,向容器中通入1ml H2(g)和1ml H2O(g),则平衡____(填“向左”、“向右”或“不”)移动。
(3)氢气和一氧化碳反应也可以生成甲醇,涉及反应的过程如下:
H2(g)→H2*①
2H2*+CO(g)→CH3OH(g)②
(已知:基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应。基元反应aA+bB→dD+eE的速率方程可表示为v=kca(A)cb(B),k为速率常数)
上面的反应的各个步骤均可视为基元反应,式中H2*代表H2的状态为与催化剂的结合态。改变初始条件,对反应中某一时刻的反应速率做观测,得到的数据如下
则表中的空白处应填入的数据是________;反应①和反应②相比,反应①为___(填“快”或“慢”)反应,符合反应历程的势能图可以表示为____(填“A”、“B”、“C”或“D”)。
20.柔性显示技术的快速发展促进了柔性基板材料的革新,具有高光学透明性和耐高温性的聚酰亚胺(PI)是一种被认为最有前景的柔性显示用透明基板材料,其中PI-3(3FTMDT/TA-TFMB)合成路线如图所示:
(1)A是一种芳香烃,其名称为________;反应条件a为________。
(2)C→D的反应方程式为_________________________________。
(3)E到F的反应类型为________。
(4)下列关于E的说法正确的是____(填序号)。
①与D互为同系物;
②能够发生取代、加成、氧化反应;
③与氢气完全加成的产物中有3个手性碳原子;
④核磁共振氢谱峰面积之比为2:1:1:1;
(5)由n ml D与n ml F合成PI-3反应中,每生成1ml PI-3同时生成____ml H2O。
(6)由H经过转化可以合成PMDA-ODA型聚酰亚胺,如下图所示:
H PMDA-ODA型聚酰亚胺
写出高聚物I的结构简式_________________________。
操作
现象
结论
A
向Fe2O3、CuO、Fe的混合粉末中加入过量稀盐酸
析出红色固体
反应后溶液中阳离子可能有H+、Fe2+、Cu2+
B
向C2H5X(X为卤素原子中加入过量的NaOH溶液加热一段时间后静置,取少量上层清液于试管中,加入AgNO3溶液
产生淡黄色沉淀
C2H5X中卤素原子为溴原子
C
向 Na[Al(OH)4]溶液中滴入NaHCO3溶液
产生白色沉淀,无气泡产生
[Al(OH)4]-比 CO32-结合质子能力强
D
比较电负性:室温下,用pH计测定 CF3COOH和CCl3COOH两种溶液的pH
CF3COOH溶液的pH较小
F元素的电负性大于Cl元素
金属离子
Fe2+
Fe3+
Al3+
C2+
Ni2+
Mn2+
开始沉淀的pH
7.0
1.9
3.4
6.6
7.8
6.7
沉淀完全的pH
9.0
3.2
4.7
9.2
10.4
9.5
物质
颜色状态
摩尔质量
(g/ml)
熔点
(℃)
沸点
(℃)
溶解性
水
乙醇
丙三醇(甘油)
无色液体
92
17.4
290
易溶
易溶
邻氨基苯酚
白色结晶性粉末
109
177
易升华
微溶
微溶
邻硝基苯酚
淡黄色结晶性粉末
139
43-45
214-216
微溶
易溶
8-羟基喹啉
白色或淡黄色粉末
145
70-73
267
不溶
易溶
c(H2)/ml/L
c(CO)/ml/L
v/ml/L/min
0.010
0.010
0.0024
0.020
0.010
0.0096
0.030
0.040
0.0216
0.040
0.040
高二化学期末考试参考答案
一、单选题
1-5:ABDBD 6-10:CC BC(均给分) CD
二、不定项选择
11-15:A AD CD AC C
三、非选择题
16.(12分)
(1)3d34s2(1分)钴、砷(2分)
(2)>(1分);O>N>C>H(2分)
(3)N的电负性小于O,更易提供孤对电子形成配位键(2分)
(4)(0.25,0.25,0.80)(2分)4(2分)
17.(12分)
(1)LiHCO3(2分)
(2)Fe3+、Al3+(2分) ABE(2分) [4.7,6.6)(2分)
(3)酸性过强时H+浓度较大,丁二酮肟中N上的孤对电子容易与H+配位,导
致难以与Ni2+配位起到沉淀Ni2+的作用(2分)
(4)5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O(2分)
18. (12分)
(1)球形冷凝管(1分);平衡气压(1分)
(2)馏出液无颜色(2分)
(3)中(2分)
(4)A(2分)
(5)8-羟基喹啉中形成分子内氢键导致其熔点降低(2分)
(6)74.7%(2分)
19. (12分)
(1)168 kJ/ml(2分)
(2)0.5ml/L(2分);向右(2分)
(3)0.0384(2分);慢(2分);B(2分)
20.(12分)
(1)间二乙苯(1分);浓硫酸、浓硝酸、加热(1分)
(2)
(3)取代反应(2分)
(4)②④(2分)
(5)2n
(6)
山东省青岛第九中学2023-2024学年高二下学期期末考试化学试题: 这是一份山东省青岛第九中学2023-2024学年高二下学期期末考试化学试题,共9页。试卷主要包含了单项选择题,不定项选择题,非选择题等内容,欢迎下载使用。
山东省青岛第五十八中学2023-2024学年高二下学期第二次月考化学试题: 这是一份山东省青岛第五十八中学2023-2024学年高二下学期第二次月考化学试题,共13页。
山东省青岛第五十八中学2023-2024学年高二下学期第二次月考化学试题: 这是一份山东省青岛第五十八中学2023-2024学年高二下学期第二次月考化学试题,共13页。












