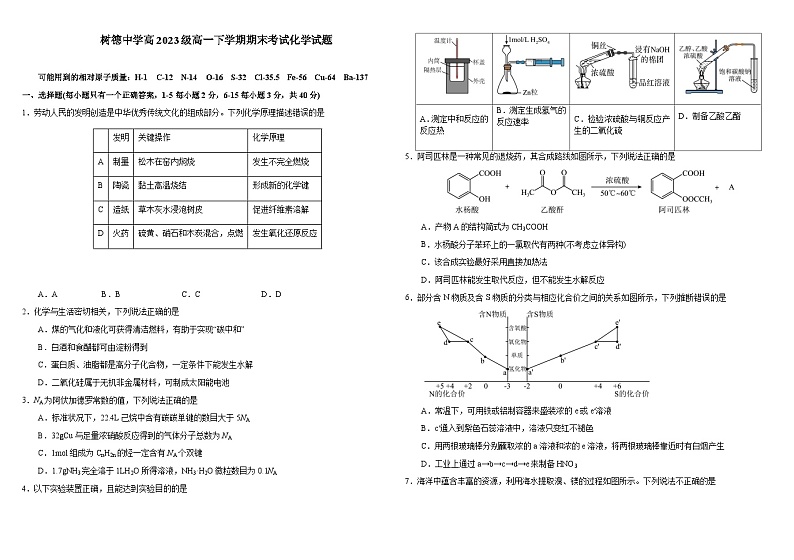

四川省成都市树德中学2023-2024学年高一下学期7月期末考试化学试题(含答案)
展开可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Cu-64 Ba-137
一、选择题(每小题只有一个正确答案,1-5每小题2分,6-15每小题3分,共40分)
1.劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是
A.AB.BC.CD.D
2.化学与生活密切相关,下列说法正确的是
A.煤的气化和液化可获得清洁燃料,有助于实现“碳中和”
B.白酒和食醋都可由淀粉得到
C.蛋白质、油脂都是高分子化合物,一定条件下能发生水解
D.二氧化硅属于无机非金属材料,可制成太阳能电池
3.NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L己烷中含有碳碳单键的数目大于5NA
B.32gCu与足量浓硝酸反应得到的气体分子总数为NA
C.1ml组成为CnH2n的烃一定含有NA个双键
D.1.7gNH3完全溶于1LH2O所得溶液,NH3·H2O微粒数目为0.1NA
4.以下实验装置正确,且能达到实验目的的是
5.阿司匹林是一种常见的退烧药,其合成路线如图所示,下列说法正确的是
A.产物A的结构简式为CH3COOH
B.水杨酸分子苯环上的一氯取代有两种(不考虑立体异构)
C.该合成实验最好采用直接加热法
D.阿司匹林能发生取代反应,但不能发生水解反应
6.部分含N物质及含S物质的分类与相应化合价之间的关系如图所示,下列推断错误的是
A.常温下,可用铁或铝制容器来盛装浓的e或e′溶液
B.c′通入到紫色石蕊溶液中,溶液只变红不褪色
C.用两根玻璃棒分别蘸取浓的a溶液和浓的e溶液,将两根玻璃棒靠近时有白烟产生
D.工业上通过a→b→c→d→e来制备HNO3
7.海洋中蕴含丰富的资源,利用海水提取溴、镁的过程如图所示。下列说法不正确的是
A.通入空气将溴蒸气带出,使Br2(aq)Br2(g)平衡向右移动
B.加热无水氯化镁所得的镁蒸气可在的环境里冷却为固体镁
C.从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.海水提溴工艺中“吹出”和“吸收”两环节的目的是富集溴
8.工业生产中产生的、NO直接排放将对大气造成严重污染,利用化学原理吸收和NO,同时获得连二亚硫酸钠(Na2S2O4)和产品的工艺流程图如下(Ce为铈元素):
下列说法正确的是
A.装置Ⅰ中发生的离子反应为:
B.装置Ⅱ中每消耗1ml Ce4+装置Ⅱ中可吸收22.4LNO
C.装置Ⅲ中生成1mlNa2S2O4同时生成2mlCe4+
D.向装置Ⅳ所得溶液中滴加稀的NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则未生成
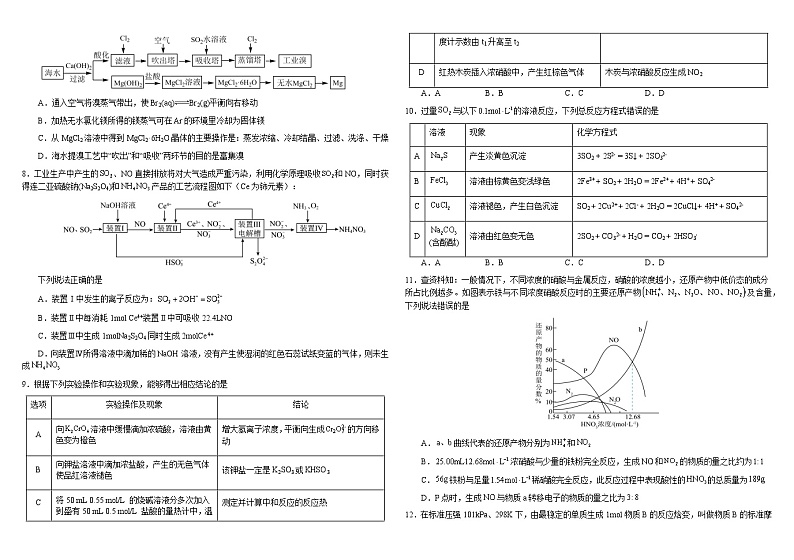
9.根据下列实验操作和实验现象,能够得出相应结论的是
A.AB.BC.CD.D
10.过量与以下的溶液反应,下列总反应方程式错误的是
A.AB.BC.CD.D
11.查资料知:一般情况下,不同浓度的硝酸与金属反应,硝酸的浓度越小,还原产物中低价态的成分所占比例越多。如图表示铁与不同浓度硝酸反应时的主要还原产物及含量,下列说法错误的是
A.曲线代表的还原产物分别为和
B.浓硝酸与少量的铁粉完全反应,生成和的物质的量之比约为
C.铁粉与足量稀硝酸完全反应,此反应过程中表现酸性的的总质量为
D.P点时,生成与物质a转移电子的物质的量之比为
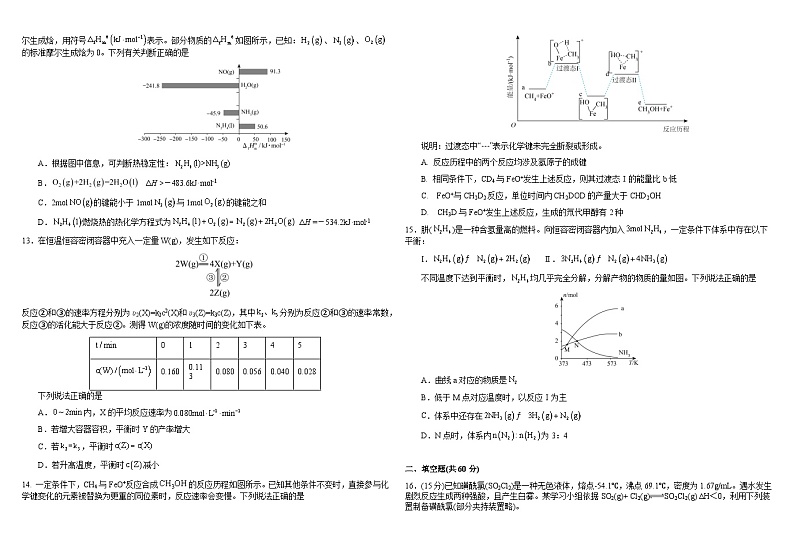
12.在标准压强101kPa、298K下,由最稳定的单质生成1ml物质B的反应焓变,叫做物质B的标准摩尔生成焓,用符号表示。部分物质的如图所示,已知:、、的标准摩尔生成焓为0。下列有关判断正确的是
A.根据图中信息,可判断热稳定性:
B. ΔH >-483.6kJ·ml-1
C.2ml的键能小于1ml与1ml的键能之和
D.燃烧热的热化学方程式为 ΔH =-534.2kJ·ml-1
13.在恒温恒容密闭容器中充入一定量W(g),发生如下反应:
反应②和③的速率方程分别为υ2(X)=k2c2(X)和υ3(Z)=k3c(Z),其中分别为反应②和③的速率常数,反应③的活化能大于反应②。测得W(g)的浓度随时间的变化如下表。
下列说法正确的是
A.内,X的平均反应速率为
B.若增大容器容积,平衡时Y的产率增大
C.若,平衡时
D.若升高温度,平衡时减小
14. 一定条件下,CH4与FeO+反应合成的反应历程如图所示。已知其他条件不变时,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
说明:过渡态中“---”表示化学键未完全断裂或形成。
A. 反应历程中的两个反应均涉及氢原子的成键
B. 相同条件下,CD4与FeO+发生上述反应,则其过渡态Ⅰ的能量比b低
C. FeO+与CH2D2反应,单位时间内CH2DOD的产量大于CHD2OH
D. CH3D与FeO+发生上述反应,生成的氘代甲醇有2种
15.肼()是一种含氢量高的燃料。向恒容密闭容器内加入,一定条件下体系中存在以下平衡:
I. Ⅱ.
不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是
A.曲线a对应的物质是
B.低于M点对应温度时,以反应Ⅰ为主
C.体系中还存在
D.N点时,体系内为3:4
二、填空题(共60分)
16.(15分)已知磺酰氯(SO2Cl2)是一种无色液体,熔点-54.1℃,沸点69.1℃,密度为1.67g/mL。遇水发生剧烈反应生成两种强酸,且产生白雾。某学习小组依据SO2(g)+ Cl2(g)SO2Cl2(g) ∆H<0,利用下列装置制备磺酰氯(部分夹持装置略)。
回答下列问题。
(1)装置A中发生反应的离子方程式是 。
(2)利用E装置制取SO2宜选用的试剂是_______。(填序号)
A.69%的硝酸和Na2SO3固体 B.70%的硫酸和Na2SO3固体 C.70%的硫酸溶液和亚硫酸钙固体
(3)为了使Cl2和SO2在D中混合反应,用仪器接口的小写字母和箭头表示上述装置的合理连接顺序:_______→f,g ←_______(箭头方向要与气流方向一致,部分装置可重复使用)。
(4)仪器甲的名称为_______,水应从 口进入(选填“m”或“n”)。
(5)仪器乙的作用是 。
(6)制备时,D中的三颈烧瓶宜浸入冰水浴中的原因是 。
(7)实验结束后,需从三颈烧瓶中分离出高纯SO2Cl2,最佳分离操作的名称是 。
(8)设计如下实验,以检验SO2Cl2产品中是否溶有杂质。
①组装仪器,检查气密性;②添加试剂抽取7.0mL液体产品,组装仪器;③打开止水夹,缓慢推动注射器活塞将液体产品全部推入锥形瓶中;④充分反应后,过滤、洗涤、干燥、称量固体质量为23.3g,表明液体产品中溶有 ,其理由是 。
7.0ml SO2Cl2
.
(16分)氧化镓(Ga2O3)是一种常用的无机催化剂。某兴趣小组设计以砷化镓废料(主要成分为GaAs、、)为原料生产Ga2O3的工业流程如图所示:
已知:ⅰ.Ga和Al的化学性质相似;ⅱ.对硝酸参与的氧化还原反应有催化作用。
回答下列问题:
(1)Ga元素位于周期表第 周期 族。
(2)滤渣1的主要成分为 。“粉碎”的目的是 。
(3)①“浸取”时GaAs发生反应的化学方程式 。
②若取A、B两组样品分别进行“浸取”实验,向A所在溶液中不断通入,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
前10min内,浸出速率A B(填“>”“<”或“=”),其可能原因是 。
“沉镓”时的离子方程式为 ,需要控制硝酸用量的原因
。
(5)查阅资料后发现,实际工业生产中,在“浸取”步骤除了加硝酸外,还需要加入,从绿色化学角度分析加入的优点 。
18.(13分)现代煤化工产生大量H2S废气,其回收利用有重要意义。
I.热解H2S制H2。
(1)已知下列反应的热化学方程式:
①2H2S(g) + 3O2(g)2SO2(g) + 2H2O(g) ΔH1=-1036kJ·ml-1
②4H2S(g) + 2SO2(g)3S2(g) + 4H2O(g) ΔH2=+94kJ·ml-1
③2H2(g) + O2(g)2H2O(g) ΔH3=-484kJ·ml-1
写出H2S热分解反应的热化学反应方程式 。
在一定温度和压强下,将的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________。(分压=总压×物质的量分数)
(3)在1373K、100kPa反应条件下,对于分别为4:1、1:1、1:4、1:9、1:19的混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
越大,H2S平衡转化率 (填“越大”“越小”或“不变”),理由是
。
II.H2S可转化成羰基硫(COS):。
(4)绝热恒压条件下,密闭容器中充入H2S(g)与CO(g)进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
A.混合气体的平均相对分子质量不再改变 B.生成,同时形成键
C.化学平衡常数不再改变 D.混合气体的密度不再改变
(5)T℃下,将2mlH2S(g)与1mlCO(g)充入恒容密闭容器中进行上述反应,测得平衡时COS(g)的体积分数为10%。则此时该反应的平衡常数K= (保留2位有效数字),保持温度不变,在上述平衡体系中再通入0.1mlH2S(g)、0.1mlCO(g)、0.1mlCOS(g)、0.1mlH2(g),则平衡 移动。(填“向正反应方向”“向逆反应方向”或“不”)
19.(16分)聚甲基丙烯酸甲酯(PMMA)俗称有机玻璃,其合成路线如图所示:
回答下列问题:
(1)X分子的空间结构呈 形, F分子中含氧官能团的名称 , C→D的反应类型是 反应。
(2)B→C的化学反应方程式是 。
(3)E的结构简式是 。
(4)由G合成PMMA的化学反应方程式是 。
(5)下列有关说法正确的是_______。
①等物质的量的A和B完全燃烧消耗等量的氧气
②B能与金属钠反应,且比水与金属钠反应要剧烈的多
③E在浓硫酸作用下可以形成环状酯
④F与油酸、亚油酸互为同系物
⑤1mlPMMA与足量NaOH溶液反应需消耗1ml的NaOH
(6)H与G互为同分异构体,且满足下列条件:①能使溴的CCl4褪色;②与碳酸氢钠溶液反应产生气体。则H的结构有 种(不包括立体异构)。写出其中含有两个甲基的同分异构体的结构简式 。
(7)已知: RCOOR1+ R2OHRCOOR2+ R1OH,G与HOCH2CH2OH发生反应,可得到结构含-OH的高分子材料单体,写出该化学反应方程式 。
发明
关键操作
化学原理
A
制墨
松木在窑内焖烧
发生不完全燃烧
B
陶瓷
黏土高温烧结
形成新的化学键
C
造纸
草木灰水浸泡树皮
促进纤维素溶解
D
火药
硫黄、硝石和木炭混合,点燃
发生氧化还原反应
A.测定中和反应的反应热
B.测定生成氢气的反应速率
C.检验浓硫酸与铜反应产生的二氧化硫
D.制备乙酸乙酯
选项
实验操作及现象
结论
A
向溶液中缓慢滴加浓硫酸,溶液由黄色变为橙色
增大氢离子浓度,平衡向生成的方向移动
B
向钾盐溶液中滴加浓盐酸,产生的无色气体使品红溶液褪色
该钾盐一定是K2SO3或KHSO3
C
将50 mL 0.55 ml/L 的烧碱溶液分多次加入到盛有50 mL 0.5 ml/L 盐酸的量热计中,温度计示数由t1升高至t2
测定并计算中和反应的反应热
D
红热木炭插入浓硝酸中,产生红棕色气体
木炭与浓硝酸反应生成NO2
溶液
现象
化学方程式
A
产生淡黄色沉淀
3SO2 + 2S2- = 3S↓ + 2SO32-
B
溶液由棕黄色变浅绿色
2Fe3+ + SO2 + 2H2O = 2Fe2+ + 4H+ + SO42-
C
溶液褪色,产生白色沉淀
SO2 + 2Cu2+ + 2Cl- + 2H2O = 2CuCl↓+ 4H+ + SO42-
D
(含酚酞)
溶液由红色变无色
2SO2 + CO32- + H2O = CO2 + 2HSO3-
0
1
2
3
4
5
0.160
0.113
0.080
0.056
0.040
0.028
四川省成都市树德中学2023-2024学年高一下学期5月期中考试化学试题: 这是一份四川省成都市树德中学2023-2024学年高一下学期5月期中考试化学试题,共10页。
四川省成都市树德中学2023-2024学年高一下学期期中考试化学试题(PDF版附答案): 这是一份四川省成都市树德中学2023-2024学年高一下学期期中考试化学试题(PDF版附答案),共5页。
四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题(含答案): 这是一份四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题(含答案),共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












