





高考化学一轮复习第4章金属及其化合物第12讲钠及其氧化物课件
展开第12讲 钠及其氧化物
1.了解钠的单质和氧化物的性质及用途。2.掌握钠与氧气、水、酸、盐溶液反应的特点。3.了解氧化钠与过氧化钠的区别,掌握过氧化钠与水、二氧化碳反应的规律。
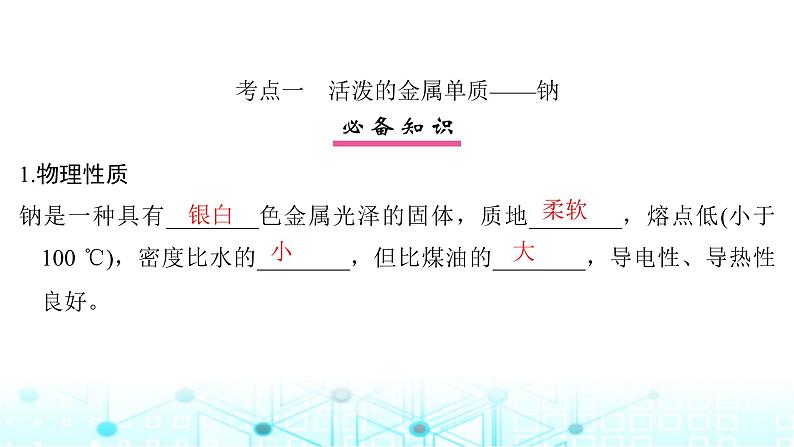
考点一 活泼的金属单质——钠 1.物理性质钠是一种具有________色金属光泽的固体,质地________,熔点低(小于100 ℃),密度比水的________,但比煤油的________,导电性、导热性良好。
4Na+O2===2Na2O
2Na+S===Na2S
(2)与水、酸、盐和醇反应。
2Na+2H2O===2Na++2OH-+H2↑
2Na+2H+===2Na++H2↑
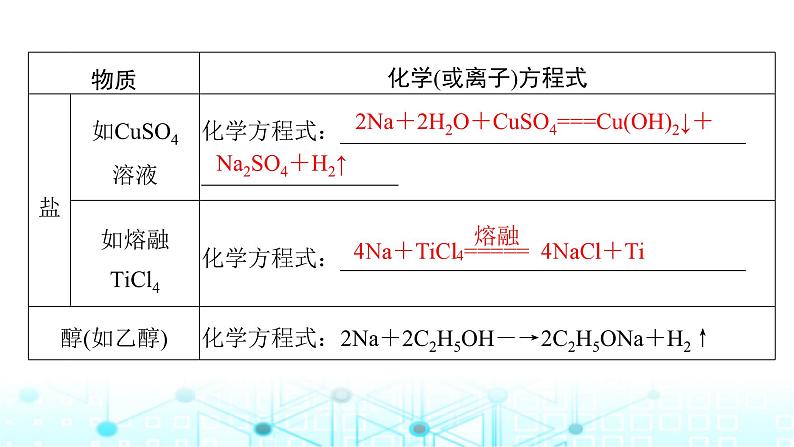
2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑
答案:(1)√ (2)× (3)× (4)× (5)× (6)×
一、钠的性质的实验探究1.某同学对钠与水的反应进行了如下探究,下述实验操作或现象分别体现了钠的什么性质?
答案:(1)钠的密度比煤油的大 (2)钠很软,为银白色固体,易被O2氧化
答案:(3)钠的密度比水的小,与水剧烈反应,生成碱 (4)钠的密度比苯的大,但比水的小,与水剧烈反应产生气体
二、钠与水溶液反应的分析2.将金属钠放入盛有下列溶液的小烧杯中,既有气体放出又有白色沉淀产生的是_________(填序号)。①MgSO4溶液 ②BaCl2溶液③饱和澄清石灰水 ④Ca(HCO3)2溶液⑤CuCl2溶液 ⑥NH4NO3溶液
考点二 氧化钠和过氧化钠 1.氧化钠和过氧化钠的比较
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
2.过氧化钠的强氧化性
[注意] (1)遇KMnO4等强氧化剂时,Na2O2表现出还原性,氧化产物为O2。(2)遇H2O、H+时,Na2O2发生自身的氧化还原反应。
3.Na2O2与CO2、H2O的反应规律
答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)√
一、过氧化钠的性质的实验探究1.Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。
(1)Na2O2中的化学键类型为_____________,氧元素的化合价为________。(2)根据实验分析:使酚酞溶液变红的原因是________________________(用化学方程式解释);除了上述反应外,还存在另一反应,该反应的化学方程式是____________________;轻轻振荡后,酚酞溶液红色褪去的原因是_____________________。(3)用离子方程式解释酸性高锰酸钾溶液褪色的原因:__________________。
二、Na2O2与CO2、H2O反应的分析与计算2. 在200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6 g,原混合气体的总物质的量是________。
3.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5 g,原混合气体中O2的质量分数是________(保留1位小数)。
4.密闭容器中盛有1 ml NaHCO3和0.8 ml Na2O2,加热充分反应后,容器内残留的固体及其物质的量是___________________。
答案:1.0 ml Na2CO3和0.6 ml NaOH
B.H2O中氧原子的成键电子对数是2,孤电子对数是2,价层电子对数为4,根据价层电子对互斥模型,H2O的空间结构为V形,B错误;C.H2O2 中H元素的化合价为+1价,根据化合物中各元素正负化合价代数和为0,可计算出O元素的化合价为-1价,C正确;D.NaOH中O和H之间是共价键,D错误。
2.(2023·新高考北京卷)离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O===4NaOH+O2↑;②CaH2+2H2O===Ca(OH)2+2H2↑。下列说法正确的是( )A.Na2O2、CaH2中均有非极性共价键B.反应①中H2O发生氧化反应,反应②中H2O发生还原反应C.Na2O2中阴、阳离子个数比为1∶2,CaH2中阴、阳离子个数比为2∶1D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
解析:Na2O2中既有离子键又有非极性共价键,CaH2中只有离子键,A错误;反应①中H2O中氢、氧元素的化合价均未发生变化,H2O既不是氧化剂也不是还原剂,反应②中H2O发生还原反应,B错误;
反应①中每生成1 ml 氧气转移2 ml电子,反应②中每生成1 ml氢气转移1 ml电子,故反应①和②中转移的电子数相同时,产生的氧气和氢气的物质的量之比为1∶2,D错误。
3.(2022·新高考天津卷)金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)基态Na原子的价层电子轨道表示式为______________________。(2)NaCl的熔点为800.8 ℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:加入CaCl2的目的是____________________________________。
备战2025届新高考化学一轮总复习第3章金属及其化合物第8讲钠及其氧化物课件: 这是一份备战2025届新高考化学一轮总复习第3章金属及其化合物第8讲钠及其氧化物课件,共43页。PPT课件主要包含了课标指引,考点二钠的氧化物,目录索引,素养发展进阶,必备知识•梳理,物理性质,石蜡油或煤油,高压钠灯,传热介质,还原剂等内容,欢迎下载使用。
第12讲 钠及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第12讲 钠及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合,钠的化学性质等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第4章 第12讲 钠及其氧化物 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第12讲 钠及其氧化物 (含解析),共60页。PPT课件主要包含了内容索引,钠的性质及用途,必备知识,NaCl+Ti,+H2↑,石蜡油或煤油,关键能力,cab,钠与上述三种,①③④⑥等内容,欢迎下载使用。












