











高中化学人教版 (2019)选择性必修1第一节 反应热教课课件ppt
展开化学反应的特征:有物质变化,还伴随能量变化
当能量变化以热能的形式表现时:
如何定量描述化学反应中释放或吸收的热量呢?
1、体系与环境-----以盐酸与NaOH溶液的反应为例
体系与环境之间存在_______交换 _______交换
与体系相互影响的其他部分
盐酸、 NaOH溶液、发生的反应
在等温条件下①,化学反应体系向环境_______或从环境_______的_______,称为化学反应的热效应,简称反应热。
①注:等温条件下,指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
何测定反应放出的热量?如何测定反应放出的热量?
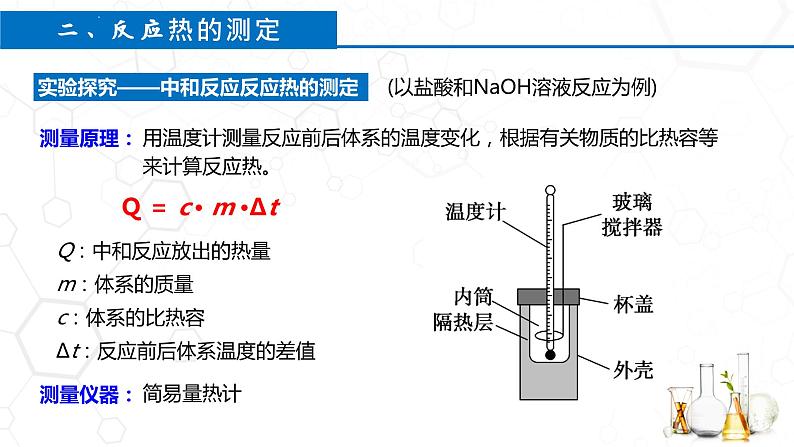
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热。
Q:中和反应放出的热量 m:体系的质量c:体系的比热容 Δt:反应前后体系温度的差值
Q = c · m ·Δt
(以盐酸和NaOH溶液反应为例)
实验探究——中和反应反应热的测定
热容和比热在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高1 K时所吸收的热量称为该物质的热容。热容用符号c表示,其单位为J·K-1。纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热。比热的单位为kJ·K-1·kg-1。常温下,液态水的比热为4.18 kJ·K-1·kg-1 。
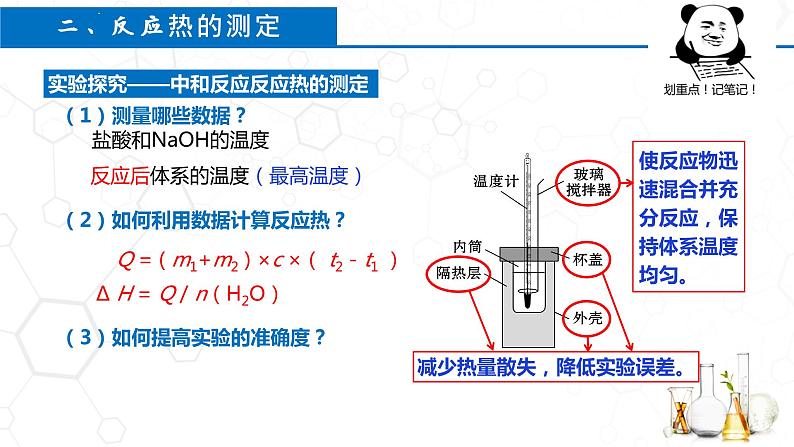
(2)如何利用数据计算反应热?
(3)如何提高实验的准确度?
反应后体系的温度(最高温度)
Q = ( m1+m2 ) ×c ×( t2 - t1 )
∆ H = Q / n(H2O)
【实验操作】(1)反应物温度的测量t1。①用量筒量取50mL 0.50ml/L盐酸, 打开杯盖, 倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL 0.55ml/L NaOH溶液, 用温度计测量并记录NaOH溶液的温度(数据填入下表)。
【实验操作】(2)反应后体系温度的测量t2。打开杯盖, 将量筒中的NaOH溶液迅速倒入量热计的内筒, 立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将________温度记为反应后体系的温度。(3)重复上述步骤(1)至步骤(2)两次。
【数据处理】(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
(t2 - t1若异常要舍去)
(2)取三次温度差的平均值作为计算依据。
(3)根据温度差和比热容计算反应热。
【数据处理】为了计算简便,可以近似认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL 盐酸的质量m1=50g, 50mL NaOH溶液质量m2=50g;②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 ml/L盐酸与 50 mL 0.55 ml/LNaOH溶液发生中和反应时放出的热量为:(m1+m2)·c·(t2-t1)=________
0.418(t2-t1) kJ
③生成1ml水时放出的热量为 。
HCl(aq) + NaOH (aq) = H2O(l) + NaCl (aq) 1 1 1 Q1 0.025ml 0.025ml 0.025ml Q = 0.418(t2-t1) kJ
【注意事项】(1)为了保证0.50ml· L-1的盐酸完全被NaOH中和,采用0.55ml·L-1NaOH溶液,使碱稍稍过量,过量的碱并不参加中和反应。(酸稍微过量也可以)(2)先后测量酸、碱及混合液温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。(3)操作时动作要快,尽量减少热量的散失。(4)实验时亦可选用浓度体积都不相同的酸碱溶液进行中和热的测定,但在计算时,应取二者中量少的一种,因为过量的酸/碱并不参加中和反应。(5)异常数据应直接舍去。
①测定中和热使用的若是强酸、强碱的稀溶液(即反应满足H+(aq) + OH-(aq) =H2O(l)),则生成1mlH2O放出的热量为57.3kJ。
中和热☆(1)定义:在稀溶液中,酸与碱发生中和反应生成1ml 液态水和可溶性盐时所释放的热量。
②测定中和热使用的若是弱酸、弱碱的稀溶液,由于弱酸、弱碱在电离时会吸热,所以生成1mlH2O放热小于57.3kJ。
③测定中和热使用的若是酸、碱的浓溶液,由于酸、碱的浓溶液在稀释时会放热,所以生成1mlH2O放热大于57.3kJ。
2. 在测定中和反应反应热的实验中,下列说法正确的是( )
为描述等压条件下的反应热,科学上引入了一个与内能有关的物理量—焓(符号为H)。
1、内能(符号为 U): 体系内物质的各种能量的总和,受_____ 和 等影响。
2、焓(符号为 H):与内能有关的物理量。3、焓变:在______ 条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,符号∶___,单位____________(或____________)
3、焓变—— 生成物的总焓与反应物的总焓之差,符号为∆H
(1)表达式:ΔH = H(生成物) - H(反应物)
(3)规定:①当反应体系放热时其焓减小,ΔH为“-”,即ΔH < 0;②当反应体系吸热时其焓增大,ΔH为“+”,即ΔH > 0。
(2)单位:kJ/ml(或kJ·ml-1)
4、反应热与焓变的关系(从生成物和反应物的总能量角度分析)
生成物总能量-反应物总能量
∆H= E生成物- E反应物
5、从微观角度认识反应热的本质
以H2(g)+Cl2(g)=2HCl(g)(25℃,101KPa下)的能量变化为例。
化学反应的本质是旧键的断裂(吸收能量)和新键的生成(释放能量)
∆H=∑E (反应物键能)-∑E (生成物键能)
-183kJ·ml-1
归纳提升:计算反应热的三种方法
E(生成物的总能量)- E(反应物的总能量)
E(反应物分子化学键断裂时所吸收的总能量)- E(生成物分子化学键形成时所释放的总能量)
E(反应物的总键能)- E(生成物的总键能)
1、C (石墨,s) = C (金刚石,s) ΔH = +1.9 kJ/ml,石墨、金刚石哪个更稳定?试分析物质稳定性与物质能量和键能的关系。
(1)物质总能量越低,物质越稳定;
(2)键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定。
∆H > 0,吸热反应,石墨键能大,总能量低,更稳定。
2、已知 2O(g)=O2(g) ∆H = - 496 kJ ∙ml -1,结合能量变化示意图。下列说法正确的是( )A.拆开 1 ml H2(g) 中的化学键需要吸收 932 kJ能量B.拆开 1 ml H2O(g) 中所有化学键需要吸收 926 kJ能量C.1 ml H2O(l) 转变为 1ml H2O(g)需要吸收 88 kJ能量D.2 ml H2(g) 和 1ml O2(g) 反应生成 2 ml H2O(l),共放热 1940 kJ
3、断开 1ml H-H键、1ml N-H键、1ml N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1 ml N2生成NH3的反应热为 ,则1ml H2生成NH3的反应热为 。
-92.0 kJ/ml
-30.67 kJ/ml
高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt,共35页。PPT课件主要包含了学习目标,课前导入,知识点一,反应热及其测定,体系与环境之间,1定义,2分类,敞开体系系统,封闭体系系统,孤立体系系统等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热完美版ppt课件,文件包含新人教版化学选择性必修一111反应热焓变课件pptx、新人教版化学选择性必修一111反应热焓变针对练习含解析docx、新人教版化学选择性必修一111反应热焓变教案doc等3份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热优秀ppt课件,文件包含111反应热焓变练习解析版docx、111反应热焓变练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













