





2024届新高三开学摸底考试卷 化学试题(北京专用)
展开(考试时间:120分钟 试卷满分:150分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Mn -55
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.化学与生活、科技等密切相关,下列说法错误的是
A.通过红外光谱仪可检测核酸结构中是否存在氨基官能团
B.量子通信材料螺旋碳纳米管与石墨烯为同位素
C.无磁镍铬钛合金钢常用于舰体材料,其强度高于纯铁
D.“天和号”推进器上的氮化硼陶瓷属于新型无机非金属材料
2.下列图示或化学用语错误的是
A.羟基的电子式:
B.H2O的VSEPR模型:
C.Mn2+的价电子的轨道表示式:
D.顺-2-丁烯的球棍模型为
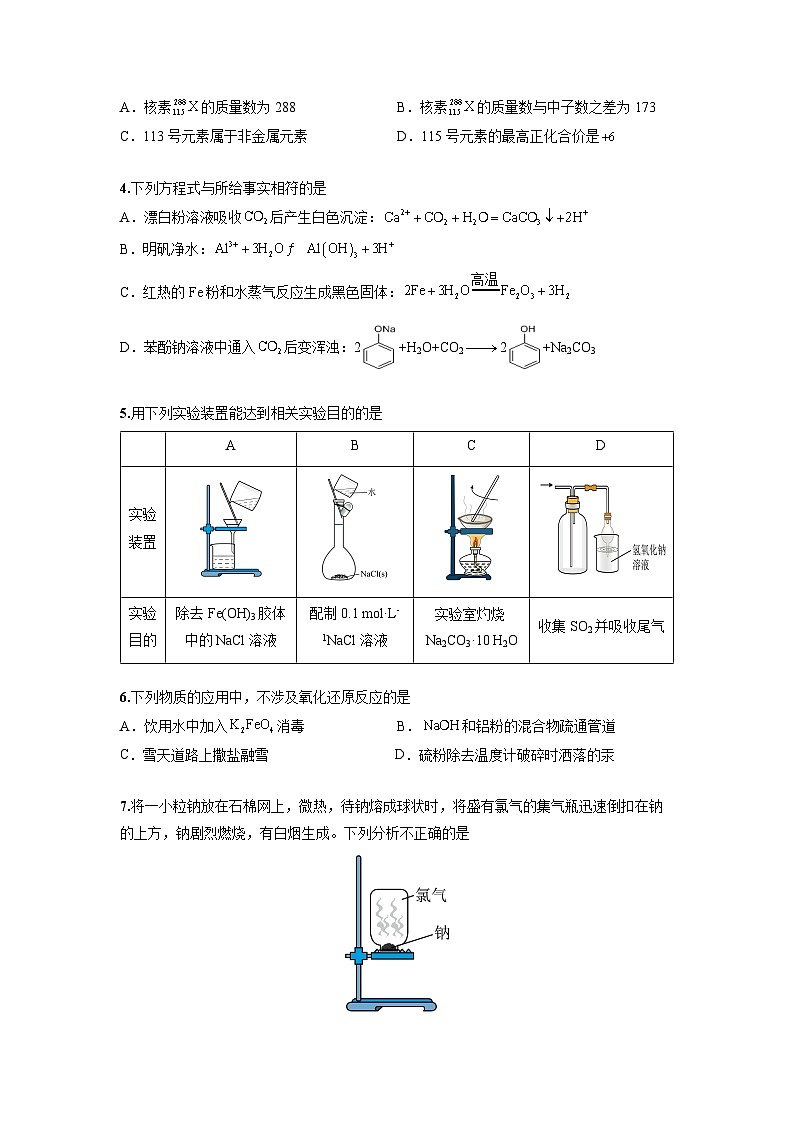
3.科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为。下列有关叙述正确的是
A.核素的质量数为288B.核素的质量数与中子数之差为173
C.113号元素属于非金属元素D.115号元素的最高正化合价是
4.下列方程式与所给事实相符的是
A.漂白粉溶液吸收后产生白色沉淀:
B.明矾净水:
C.红热的Fe粉和水蒸气反应生成黑色固体:
D.苯酚钠溶液中通入后变浑浊:2+H2O+CO22+Na2CO3
5.用下列实验装置能达到相关实验目的的是
6.下列物质的应用中,不涉及氧化还原反应的是
A.饮用水中加入消毒B.和铝粉的混合物疏通管道
C.雪天道路上撒盐融雪 D.硫粉除去温度计破碎时洒落的汞
7.将一小粒钠放在石棉网上,微热,待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方,钠剧烈燃烧,有白烟生成。下列分析不正确的是
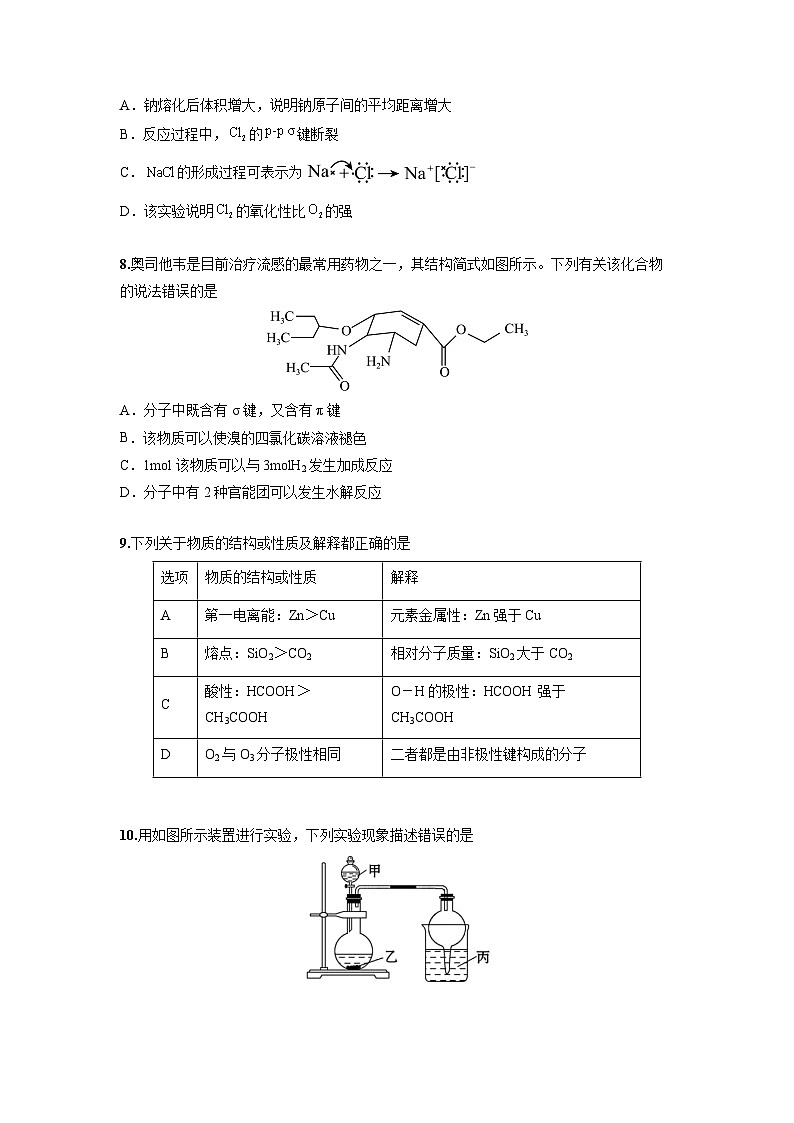
A.钠熔化后体积增大,说明钠原子间的平均距离增大
B.反应过程中,的键断裂
C.的形成过程可表示为
D.该实验说明的氧化性比的强
8.奥司他韦是目前治疗流感的最常用药物之一,其结构简式如图所示。下列有关该化合物的说法错误的是
A.分子中既含有σ键,又含有π键
B.该物质可以使溴的四氯化碳溶液褪色
C.1ml该物质可以与3mlH2发生加成反应
D.分子中有2种官能团可以发生水解反应
9.下列关于物质的结构或性质及解释都正确的是
10.用如图所示装置进行实验,下列实验现象描述错误的是
11.高分子树脂X的合成路线如下。
下列说法不正确的是
A.高分子X中存在氢键 B.甲的结构简式为
C.①的反应中有水生成 D.高分子X水解可得到乙
12.有氧条件下,在Fe基催化剂表面,还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法不正确的是
A.在酸性配位点上,与通过配位键形成
B.增大压强有利于NO与吸附在配位点上形成
C.在反应过程中,Fe基可以提高NO的转化率
D.该反应的总方程式为:
13.某小组研究SCN-分别与Cu2+和Fe3+的反应:
下列说法不正确的是
A.实验1中发生了氧化还原反应,KSCN为还原剂
B.实验2中“溶液变红”是Fe3+与SCN-结合形成了配合物
C.若将实验3中Fe2(SO4)3溶液替换为0.25 ml/LCuSO4溶液,接通电路后,可推测出电压表指针会发生偏转
D.综合实验1~3,微粒的氧化性与还原产物的价态和状态有关
14.中国科学家首次用改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
①
②
③
其他条件相同时,相同时间内温度对产物选择性的影响结果如图。
已知:i.
ii.450~500K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确的是
A.制乙二醇适宜的温度范围是470~480K
B.实验条件下反应③的活化的最高,升温更有利于反应③
C.减压可提高乙二醇的平衡产率
D.铜基催化剂用改性后反应速率增大,可以降低反应所需的压强
第二部分
本题共5题,共58分。
15.(9分)NH3具有易液化、含氢密度高、应用广泛等优点,NH3是最基本的化工原料之一,NH3的合成及应用一直是科学研究的重要课题。
(1)NH3的中心原子的杂化轨道类型为______。
(2)工业上以H2、N2为原料合成NH3的化学方程式为_____。
(3)在合成氨工业中,原料气(H2、N2及少量CO、NH3的混合气)在进入合成塔前,需要经过铜氨液处理,目的是除去其中的CO,其化学反应为:[Cu(NH3)2]++CO+NH3=[Cu(NH3)3CO]+ △H<0。
①[Cu(NH3)3CO]+配离子中的配体是______。
②铜氨液吸收CO适宜的生产条件是______。
(4)合成氨中Fe或铁的化合物是常用的催化剂。
①Fe3+比Fe2+稳定,从原子结构的角度解释Fe3+性质更稳定的原因______。
②实际生产中催化剂采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如图:
则两种晶胞所含铁原子个数比为a:b=______。
(5)科学家侯德榜利用NaCl、NH3、CO2为原料,通过下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①已知:1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3。NH3极易溶于水的原因是______(至少答两点)。
②NaHCO3分解得Na2CO3。Na2CO3中CO空间结构为______。
16.(11分)三氯化六氨合钴(III)在工业上用途广泛。
已知:①具有较强还原性,溶液呈棕色。性质稳定。
②[C(NH3)6]Cl3在水中的溶解度曲线如下图所示。
实验室制备的实验步骤:
I.检查装置气密性并将、和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色,充分反应后缓慢滴加双氧水,水浴加热20 min,实验装置下图所示。
II.将所得浊液趁热过滤,向滤液中逐滴加入少量浓盐酸。
III.冷却结晶后过滤,用少量冷水和无水乙醇分别洗涤晶体2~3次。
(1)图中仪器b的名称为___________。
(2)写出步骤I中棕色溶液与双氧水反应的离子方程式:___________。
(3)步骤II向滤液中加入浓盐酸的作用是___________。
(4)步骤III中用冷水洗涤的目的是___________。
(5)用如图装置测定产品中的含量(部分装置已省略):
①蒸氨:取xg样品加入过量试剂后,加热三颈烧瓶,蒸出的通入盛有 mL ml/L 标准溶液的锥形瓶中。液封装置2的作用是___________。
②滴定:将液封装置2中的水倒入锥形瓶后,用 ml/L NaOH溶液滴定剩余的,消耗 mL NaOH溶液。滴定时选用的指示剂为___________,的质量分数为___________;若NaOH溶液使用前敞口放置于空气中一段时间,测得的含量___________(填“偏高”、“偏低”或“无影响”)。
17.(10分)化合物I合成相关流程如图所示。
已知:①已知A为芳香化合物。
②
③RCHO
回答下列问题:
(1)A所含官能团的名称是_______。
(2)C→D反应方程式_______。
(3)E的名称为_______,由F生成G的反应类型是_______。
(4)已知I的分子中:①含有三个六元环;②不含甲基;③含有两个羰基。I的结构简式为_______。
(5)同时满足以下条件的C的同分异构体有_______种。
①含有苯环,且苯环上有三个取代基;②能发生银镜反应;
其中核磁共振氢谱有5组峰,且峰面积之比为6∶2∶2∶1∶1的同分异构体的结构简式为_______。(写一种)
(6)结合信息,设计用甲苯和乙醛为原料制备的合成路线,其他无机试剂任选_______。
格式如:AB……目标产物
18.(14分)工业以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰()。其工业流程如下:
(1)浸锰过程中与反应的离子方程式为,该反应是经历以下两步反应实现的。
i.
ii.……
写出ii的离子方程式:_______。
(2)氧化过程中被氧化的物质主要有(写化学式):_______。
(3)“浸锰”反应中往往有副产物生成,温度对“浸锰”反应的影响如图所示:
为减少的生成,“浸锰”的适宜温度是_______,向过滤II所得的滤液中加入溶液时温度不宜太高的原因是_______。
(4)加入溶液后,生成沉淀,同时还有气体生成,写出反应的离子方程式:_____。
(5)滴定法测产品纯度
I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:;
II.加入过量KI溶液和适量稀,沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000ml/L 溶液进行滴定,发生反应:,滴定终点时消耗溶液20.00mL。
①写出II中反应的离子方程式_______;
②判断滴定终点的方法是_______;
③假设杂质不参与反应,则产品纯度为_______。(保留四位有效数字)
19.(14分)学习小组探究、(棕黑色固体,难溶于水)对氯水漂白性的影响。实验记录如下:
(1)结合离子方程式解释ⅰ中品红溶液褪色的原因:_________________________________。
(2)经检验,ⅱ中的白色沉淀a是,产生的化学方程式是__________________。
(3)ⅰ是ⅲ的对比实验,目的是排除ⅲ中___________________________的影响。
(4)研究白色沉淀b的成分、进行实验ⅳ(按实验ⅲ的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
①设计对比实验证实白色沉淀b不只含有,实验方案和现象是_________。
②溶液的作用是________。由此判断,白色沉淀b可能含有。
(5)进一步研究白色沉淀b和实验ⅲ品红溶液褪色慢的原因,进行实验ⅴ:
①用离子方程式解释加入饱和溶液的目的:_________________________。
②实验结果表明,实验ⅲ的漂白速率比实验ⅴ慢,结合的作用解释其原因________A
B
C
D
实验装置
实验目的
除去Fe(OH)3胶体中的NaCl溶液
配制0.1 ml·L-1NaCl溶液
实验室灼烧Na2CO3·10 H2O
收集SO2并吸收尾气
选项
物质的结构或性质
解释
A
第一电离能:Zn>Cu
元素金属性:Zn强于Cu
B
熔点:SiO2>CO2
相对分子质量:SiO2大于CO2
C
酸性:HCOOH>CH3COOH
O-H的极性:HCOOH强于CH3COOH
D
O2与O3分子极性相同
二者都是由非极性键构成的分子
选项
试剂甲
试剂乙
试剂丙
丙中的现象
A
浓氨水
CaO
AlCl3溶液
有白色沉淀生成
B
浓硫酸
Na2SO3
BaCl2溶液
有白色沉淀生成
C
过氧化氢
MnO2
酸性KI—淀粉溶液
溶液变为蓝色
D
浓盐酸
KMnO4
Na2S溶液
有淡黄色沉淀生成
编号
1
2
3
实验
现象
溶液变为黄绿色,产生白色沉淀(白色沉淀为CuSCN)
溶液变红,向反应后的溶液中加⼊K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多
接通电路后,电压表指针不偏转。⼀段时间后,取出左侧烧杯中少量溶液,滴加K3[Fe(CN)6]溶液,没有观察到蓝色沉淀
2mL氯水
实验
方案和现象
ⅰ
加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色
ⅱ
加入少量固体,产生白色沉淀a;再ii加入1mL蒸馏水和1滴品红溶液,品红溶液褪色比ⅰ快
ⅲ
加入1mL较浓溶液,产生白色沉淀b;再滴加1滴品红溶液,品红溶液褪色比ⅰ慢
【新高三摸底】2024届新高三-化学开学摸底考试卷(辽宁专用): 这是一份【新高三摸底】2024届新高三-化学开学摸底考试卷(辽宁专用),文件包含新高三摸底2024届新高三-化学开学摸底考试卷辽宁专用解析版docx、新高三摸底2024届新高三-化学开学摸底考试卷辽宁专用考试版docx、新高三摸底2024届新高三-化学开学摸底考试卷辽宁专用参考答案docx、新高三摸底2024届新高三-化学开学摸底考试卷辽宁专用答题卡docx等4份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。
【新高三摸底】2024届新高三-化学开学摸底考试卷(湖南专用): 这是一份【新高三摸底】2024届新高三-化学开学摸底考试卷(湖南专用),文件包含新高三摸底2024届新高三-化学开学摸底考试卷湖南专用解析版docx、新高三摸底2024届新高三-化学开学摸底考试卷湖南专用原卷版docx、新高三摸底2024届新高三-化学开学摸底考试卷湖南专用参考答案及评分标准docx、新高三摸底2024届新高三-化学开学摸底考试卷湖南专用答题卡docx等4份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
【新高三摸底】2024届新高三-化学开学摸底考试卷(江苏专用): 这是一份【新高三摸底】2024届新高三-化学开学摸底考试卷(江苏专用),文件包含新高三摸底2024届新高三-化学开学摸底考试卷江苏专用解析版docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用考试版docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用答案及评分标准docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用答题卡docx等4份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。












