



北京市第四中学2023-2024学年高三下学期开学摸底测验化学试题(原卷版+解析版)
展开(试卷满分为100分,考试时间为90分钟)
相对原子质量:
一、单项选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项正确)
1. 中国“天宫”空间站使用了很多高新技术材料。下列对涉及材料的说法不正确的是
A. 核心舱的离子推进器使用氙气作为推进剂,氙位于元素周期表0族
B. 被誉为“百变金刚”的太空机械臂主要成分为铝合金,其强度大于纯铝
C. “问天”实验舱使用砷化镓()太阳能电池,砷和镓位于元素周期表第四周期
D. 太阳能电池翼基板采用碳纤维框架和玻璃纤维网,两者均属于有机高分子材料
【答案】D
【解析】
【详解】A.氙位于元素周期表0族,故A正确;
B.铝合金强度大于纯铝,故B正确;
C.砷和镓位于元素周期表第四周期,故C正确;
D.碳纤维框架和玻璃纤维网均属于无机非金属材料,故D错误;
故选D。
2. 下列化学用语或图示不正确的是
A. 1-丁烯的实验式:CH2
B. 的VSEPR模型:
C. 基态Cr原子的价层电子排布式:3d54s1
D. HCl分子中σ键的形成:
【答案】B
【解析】
【详解】A.1-丁烯的结构简式:CH2═CH-CH2CH3,其实验式为CH2,选项A正确;
B.的中心原子价层电子对数为,故其VSEPR模型为四面体形,选项B不正确;
C.基态 Cr 原子为24号元素,价电子排布式为3d54s1,选项C正确;
D.HCl分子中σ键的形成:,选项D正确;
答案选B。
3. 下列说法不正确的是
A. 纤维素能够发生酯化反应,不能被银氨溶液等弱氧化剂氧化
B. 核苷与磷酸通过醚键结合形成核苷酸,如
C. 攀登高山时佩戴护目镜,防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤
D. 丙醛糖()分子中含有手性碳原子,存在对映异构体
【答案】B
【解析】
【详解】A.纤维素分子中葡萄糖单元存在醇羟基,能够发生酯化反应,纤维素属于非还原糖不能被银氨溶液等弱氧化剂氧化,A项正确;
B.核苷与磷酸通过磷酸酯键结合形成核苷酸,B项错误;
C.紫外线能够使蛋白质发生变性,因此攀登高山时佩戴护目镜,防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤,C项正确;
D. 把与四个不同原子或基团相连的碳原子称为手性碳原子,因此丙醛糖中含有手性碳原子(中间碳),存在对映异构体,D项正确;
答案选B。
4. 下列产生固体的实验中,与物质溶解度无关的是
A. 向饱和溶液中依次通入过量、,析出沉淀
B. 向饱和溶液中滴加几滴浓盐酸,析出沉淀
C. 冷却苯甲酸的热饱和溶液,析出晶体
D. 冷却熔融态的硫黄,析出晶体
【答案】D
【解析】
【详解】A.向饱和溶液中依次通入过量、,生成铵离子、碳酸氢根离子,由于碳酸氢钠在该条件下溶解度最小,故形成过饱和溶液而结晶析出,与物质溶解度有关,A不符合题意;
B.向饱和溶液中滴加几滴浓盐酸,氯离子浓度增大,使氯化钠结晶析出,减小了氯化钠的溶解,与物质溶解度有关,B不符合题意;
C.苯甲酸的溶解度随温度下降而减小,则冷却苯甲酸的热饱和溶液可析出苯甲酸晶体,与物质溶解度有关,C不符合题意;
D.冷却熔融态的硫黄,析出晶体,发生物理变化,有液态转变为固态,与物质溶解度无关,D符合题意;
故选D。
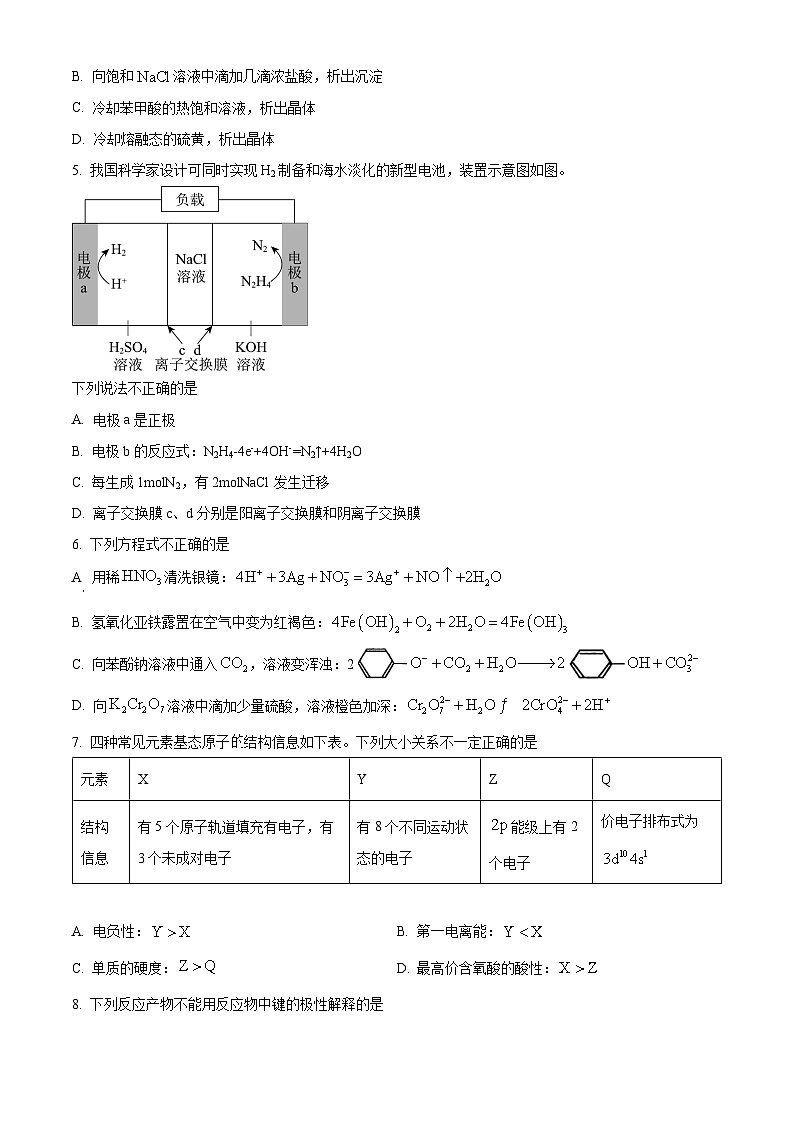
5. 我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如图。
下列说法不正确的是
A. 电极a是正极
B. 电极b的反应式:N2H4-4e-+4OH-=N2↑+4H2O
C. 每生成1mlN2,有2mlNaCl发生迁移
D. 离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
【答案】C
【解析】
【分析】该装置为原电池,电极a上氢离子得电子生成氢气,则a为正极,电极反应为2H++2e-=H2↑,电极b上,N2H4在碱性条件下失去电子生成N2,b为负极,电极反应为N2H4-4e-+4OH-=N2↑+4H2O,根据电解池中,阳离子移向正极,阴离子移向负极,则钠离子经c移向左侧(a),氯离子经d移向右侧(b),c、d分别是阳离子交换膜和阴离子交换膜,据此解答。
【详解】A.根据分析,电极a是正极,A正确;
B.根据分析,电极b的反应式:N2H4-4e-+4OH-=N2↑+4H2O,B正确;
C.根据N2H4-4e-+4OH-=N2↑+4H2O,每生成1mlN2,转移4ml电子,根据电荷守恒,有4mlNaCl发生迁移,C错误;
D.根据分析,离子交换膜c、d分别是阳离子交换膜和阴离子交换膜,D正确;
故选C。
6. 下列方程式不正确的是
A. 用稀清洗银镜:
B. 氢氧化亚铁露置在空气中变为红褐色:
C. 向苯酚钠溶液中通入,溶液变浑浊:2
D. 向溶液中滴加少量硫酸,溶液橙色加深:
【答案】C
【解析】
【详解】A.稀硝酸和银反应生成硝酸银、一氧化氮和水,离子方程式为:,A正确;
B.氢氧化亚铁在空气中容易被氧化为氢氧化铁,相应的方程式为:,B正确;
C.向苯酚钠溶液中通入溶液变浑浊,生成的是苯酚和碳酸氢钠,得不到碳酸钠,离子方程式为:,C错误;
D.向溶液中滴加少量硫酸,溶液橙色加深,说明平衡逆向移动,D正确;
故选C。
7. 四种常见元素基态原子的结构信息如下表。下列大小关系不一定正确的是
A. 电负性:B. 第一电离能:
C. 单质的硬度:D. 最高价含氧酸的酸性:
【答案】C
【解析】
【分析】X由有5个原子轨道填充有电子,有3个未成对电子,可知X的核外电子排布式为1s22s22p3,X为N;Y有8个不同运动状态的电子,则Y有8个核外电子,Y为O;Z的核外电子排布式为1s22s22p2,则Z为C;Q的价电子排布式为 3d104s1,则Q为Cu。
【详解】A.同周期从左到右电负性依次增大,则电负性O>N,A项正确;
B.N为半充满状态,比较稳定,第一电离能大于O,B项正确;
C.C有多种同素异形体,比如金刚石、石墨等,石墨的硬度小于Cu,而金刚石的硬度大于Cu,C项不一定正确;
D.N的最高价含氧酸为HNO3,C的最高价含氧酸为H2CO3,酸性HNO3>H2CO3,D项正确。
答案选C。
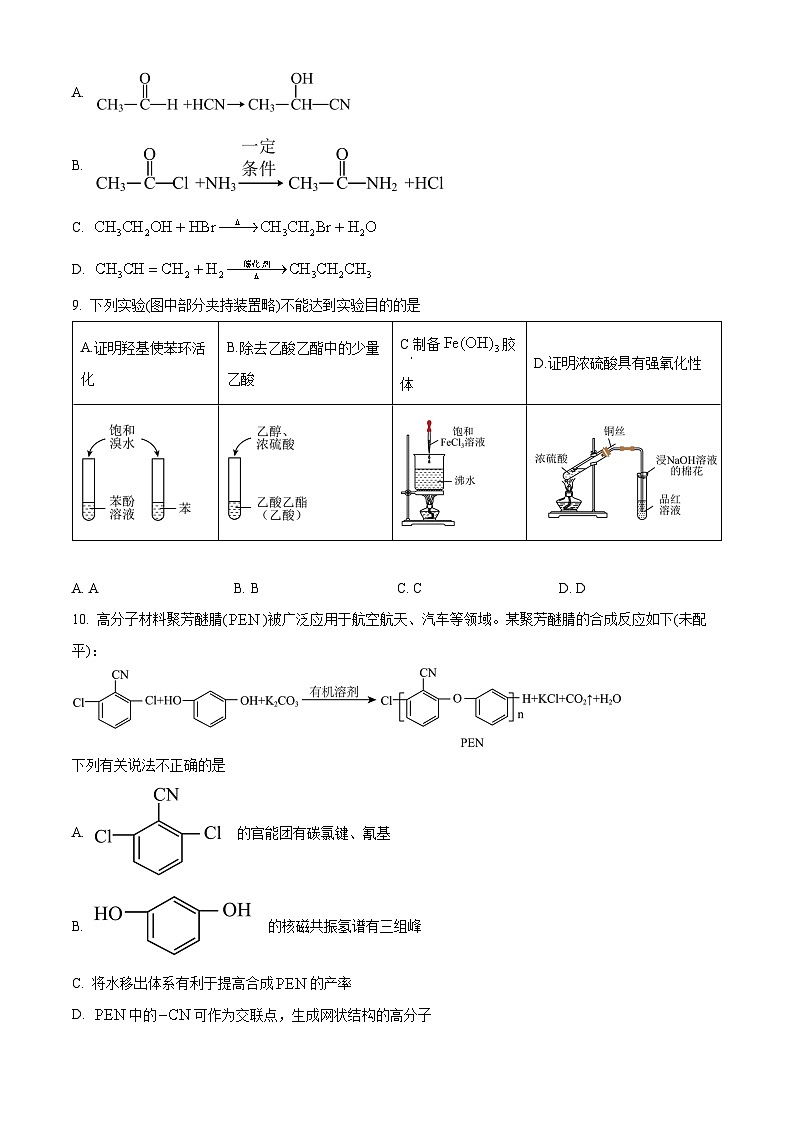
8. 下列反应产物不能用反应物中键的极性解释的是
A.
B.
C.
D.
【答案】D
【解析】
【分析】反应物中化学键的极性越强,在化学反应中越容易断裂。
【详解】A.乙醛分子中的C=O双键是极性共价键,极性较强,反应中容易断裂,反应与反应物中键的极性有关,A不符合;
B.乙酰氯中的C―Cl是极性共价键,极性较强,反应中容易断裂,反应与反应物中键的极性有关,B不符合;
C.乙醇中C―O键是极性共价键,极性较强,反应中容易断裂,反应与反应物中键的极性有关,C不符合;
D.丙烯中的C=C双键是非极性共价键,双键上有一个σ键,较稳定,一个π键,不稳定,反应与反应物中键的极性没有关系,D符合;
故答案为:D。
9. 下列实验(图中部分夹持装置略)不能达到实验目的的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.苯酚和溴水反应时是苯环上的氢被溴取代,苯不能和溴水发生反应,故该实验能证明羟基是苯环活泼,A不符合题意;
B.乙醇和乙酸的酯化反应为可逆反应,不能用此法除去乙酸,B符合题意;
C.氯化铁溶液在加热时促进水解生成氢氧化铁胶体,C不符合题意;
D.铜和浓硫酸加热生成二氧化硫,二氧化硫能使品红褪色,剩余的二氧化硫被氢氧化钠溶液吸收,D不符合题意;
故选B。
10. 高分子材料聚芳醚腈()被广泛应用于航空航天、汽车等领域。某聚芳醚腈的合成反应如下(未配平):
下列有关说法不正确的是
A. 的官能团有碳氯键、氰基
B. 的核磁共振氢谱有三组峰
C. 将水移出体系有利于提高合成的产率
D. 中的可作为交联点,生成网状结构的高分子
【答案】B
【解析】
【详解】A.根据结构简式 可知其官能团有氯原子,氰基,故A正确;
B. 是对称结构,则分子中有4种氢原子,核磁共振氢谱有4组峰,故B错误;
C.将水移出体系,水的浓度降低,则平衡正向移动,有利于提高合成PEN的产率,故C正确;
D.中的中含有碳氮三键,碳氮三键可以打开π键形成交联点,生成网状结构的高分子,故D正确;
故选B。
11. 探究Cu与溶液的反应,进行如下实验。
实验①:向10mL0.2ml/L溶液(pH≈1)中加入0.1gCu粉,振荡后静置,取上层清液,滴加溶液,有蓝色沉淀产生。6h后,溶液由棕黄色变为蓝绿色。实验过程中未见有气泡产生,溶液的pH几乎不变。
实验②:在密闭容器中向10mL0.6ml/L溶液中加入0.1gCu粉,10h后溶液变为淡蓝色。
实验③:在密闭容器中向10mL0.6ml/L溶液中分别加入0.1gCu粉和0.1g固体,0.5h溶液变黄,3h溶液变为黄绿色。下列说法不正确的是
A. 实验①中发生了反应:
B. 推测实验②的离子方程式是:
C. 对比实验①和②,①中溶解Cu的主是
D. 对比实验②和③,与反应的速率大于与Cu反应的速率
【答案】C
【解析】
【详解】A.实验①中取上层清液,滴加溶液,有蓝色沉淀产生,说明产生了亚铁离子。6h后,溶液由棕黄色变为蓝绿色,说明有铜离子生成,故发生了反应:,A正确;
B.实验②溶液变为淡蓝色,说明生成了铜离子,则推测实验②的离子方程式是:,B正确;
C.对比实验①和②,①中溶解Cu的主是铁离子,不是硝酸根离子,C错误;
D.对比实验②和③,③中显生成铁离子,后生成铜离子,说明与反应的速率大于与Cu反应的速率,D正确;
故选C。
12. 常温下,向新制氯水中滴加溶液,溶液中水电离出的浓度与溶液体积之间的关系如图所示。下列推断正确的是。
A. E、H点溶液的分别为3和7
B. F点对应的溶液中:
C. G点对应的溶液中:
D. E~H点对应的溶液中,为定值
【答案】B
【解析】
【分析】通过图像分析,E点位新制的氯水,溶液为盐酸和次氯酸的混合溶液,对水的电离有抑制作用,F点溶液为中性,G点促进水的电离,为氯化钠、次氯酸钠的混合溶液,次氯酸钠水解,使溶液呈碱性,H点溶液呈碱性;据此作答。
【详解】A.E点新制氯水溶液,溶液显酸性,由水电离出的,溶液中OH−完全是由水电离出来的,所以c(OH−)=,则溶液中,则溶液pH=3;H点NaOH过量,溶液为碱性溶液,溶质为NaCl、NaClO和NaOH,pH>7,A错误;
B.F溶液为中性,c(OH-)=c(H+),根据溶液呈电中性,c(Na+) +c(H+)=c(Cl-)+c(ClO-)+c(OH-),可得c(Na+)=c(Cl-)+c(ClO-),B正确;
C.G点促进水的电离,为氯化钠、次氯酸钠的混合溶液,且物质的量相等,次氯酸钠水解,使溶液呈碱性,溶液中的次氯酸根离子浓度减小,则c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),C错误;
D.根据Cl元素守恒,E~H点对应的溶液中,为定值,但由于溶体体积不断增大,因此逐渐减小,D错误;
故选B。
13. 精炼铜工业中阳极泥的综合利用具有重要意义。从阳极泥中回收多种金属的流程如下。
已知:分金液中含;分金渣的主要成分为;在反应中被氧化为。
下列说法不正确的是
A. “分铜”时加入的目的是降低银的浸出率
B. 得到分金液的反应为:
C. 得到分银液的反应为:
D. “滤液2”中含有大量的氨,可直接循环利用
【答案】D
【解析】
【分析】阳极泥加入硫酸、过氧化氢和氯化钠使铜溶解,使氯化银尽量不溶解,在分铜渣中加入氯化氢和氯酸钠分金,分金液中加入二氧化硫将金还原成单质金,分渣金中加入氨水分银,分银液中加入,还原银成为银单质,据此分析。
【详解】A.“分铜”时加入,使氯离子浓度增大,利用同离子效应,使氯化银几乎不溶解,降低银的浸出率, A正确;
B.利用的氧化性,同时大量氯离子存在,可以使金形成配合离子,反应的离子方程式为:,B正确;
C.氯化银可以溶解在氨水中,形成,反应的化学方程式为:,C正确;
D.由已知被氧化成,不会生成氨气,故“滤液2”中不会含有大量的氨,D错误;
故本题选D。
14. 中国科学家首次用改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
①
②
③
其他条件相同时,相同时间内温度对产物选择性影响结果如图。
已知:i.
ii.450~500K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确的是
A. 制乙二醇适宜的温度范围是470~480K
B. 实验条件下反应③活化的最高,升温更有利于反应③
C. 减压可提高乙二醇的平衡产率
D. 铜基催化剂用改性后反应速率增大,可以降低反应所需的压强
【答案】C
【解析】
【详解】A.由图可知,温度为470~480K时,生成乙二醇的选择性最高,A正确;
B.由图可知,升高温度有利于生成乙醇,实验条件下反应③的活化能最高,所以升温有利于反应③,B正确;
C.反应②为气体分子数减小的反应,则增大压强可以提高乙二醇的平衡产率,C错误;
D.铜基催化剂用改性后,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压,则催化剂可以使反应速率增大,D正确;
故选C。
二、非选择题(本大题共5小题,共58分)
15. 氨基锂()为白色固体,广泛用于有机合成。
(1)金属锂与液氨反应生成和一种气体。该气体是___________。
(2)液氨中也存在类似水的微弱电离:。
①的空间结构为___________。
②已知键角。从结构角度解释其原因:___________。
(3)的晶胞如图所示(晶胞体积为)。
①该晶体的密度为___________(用含字母的代数式表示)。
②与结构相似。从结构角度解释熔点()高于熔点()的原因:___________。
(4)测定产品的纯度(主要杂质为),实验步骤如下。
ⅰ.准确称量产品,与过量稀盐酸充分反应,将全部转化为。
ii.向i所得溶液中滴加溶液至。再加入甲醛溶液,发生反应:
iii.以酚酞为指示剂,用溶液滴定ii中生成的,消耗溶液。
①步骤ⅰ反应的化学方程式为___________。
②样品中的质量分数为___________(用含字母的代数式表示)。
③若i中未用溶液调节,则测定结果___________(填“偏低”或“偏高”)。
【答案】(1)氢气 (2) ①. V形 ②. N均为sp3杂化,孤电子对数,孤电子对有较大斥力
(3) ①. ②. 二者均为离子晶体,锂离子半径小于钠离子半径,离子键更强
(4) ①. ②. ③. 偏高
【解析】
【小问1详解】
金属锂与液氨反应生成和一种气体,氨气中氮原子和氢原子个数比为1:3,中氮原子和氢原子个数比为1:2,则另一种产物气体为氢气;
【小问2详解】
液氨中也存在类似水的微弱电离:。
①的价层电子对数为,孤电子对数为2,空间结构为V形;
②N均为sp3杂化,孤电子对数,孤电子对有较大斥力;
【小问3详解】
①该晶胞Li个数为,N个数为8,H个数为,含有八个,晶胞的质量为,体积,密度为;
②与结构相似。从结构角度解释熔点()高于熔点()的原因二者均为离子晶体,锂离子半径小于钠离子半径,离子键更强;
【小问4详解】
①步骤ⅰ反应的化学方程式为;
②设样品中物质的量为n。
样品中的质量分数为;
③若i中未用溶液调节,原来盐酸有剩余,造成氢氧化钠消耗过多,则测定结果偏高。
16. 从低品位铜镍矿(主要组成为铜氧化物、镍氧化物,含有、、等杂质)资源中提取镍和铜的一种工艺流程如下:
资料:一些物质的(25℃)如下。
(1)上述流程中,加快反应速率的措施是__________。
(2)浸出过程中通入的目的是__________。
(3)萃取时发生反应:(HR、在有机层,、在水层)。
①某种HR的结构简式为,该分子中可能与形成配位键的原子有__________。
②解释反萃取时的作用:__________。
(4)黄钠铁矾比更易形成沉淀。反应终点pH与、沉淀率的关系如下表。
①生成黄钠铁矾的离子方程式是__________。
②沉淀时最适宜选用的反应终点pH是__________。
(5)第二次使用调节pH使沉淀完全,宜将pH调节至__________。
【答案】(1)研磨 (2)将Fe2+氧化为Fe3+,便于转化为沉淀除去
(3) ①. O、N ②. 加入,使逆向进行,进入水层
(4) ①. 或 ②. 2.5
(5)10>pH>9
【解析】
【分析】由题给流程可知,铜镍矿研磨后,在氧气和稀硫酸作用下浸出,将铜镍矿中的金属氧化物转化为可溶性硫酸盐,其中通入氧气的目的是将FeO溶于稀硫酸得到的Fe2+氧化为Fe3+,过滤得到浸出液;向浸出液中加入萃取剂HR萃取,分液得到有机相和水层;向有机相中加入稀硫酸反萃取,分液得到含有Cu2+的水溶液,水溶液经处理得到金属Cu;向水层中加入Na2SO4和MgO,在溶液pH为2.5的条件下将Fe3+转化为黄钠铁矾沉淀,过滤得到黄钠铁矾和滤液;向滤液中加入MgO调节溶液pH,使溶液中得Ni2+转化为Ni(OH)2沉淀,过滤得到Ni(OH)2;Ni(OH)2经多步处理制得金属Ni。
【小问1详解】
铜镍矿研磨后可以增大反应物的接触面积,加快反应速率,则题给流程中,加速反应速率的措施是研磨;
【小问2详解】
由分析可知,浸出过程中通入氧气的目的是将FeO溶于稀硫酸得到的Fe2+氧化为Fe3+,故答案为:将Fe2+氧化为Fe3+,便于转化为沉淀除去;
【小问3详解】
① 分子中,若要与形成配位键,则分子需提供孤电子对,分子中存在孤电子对的原子为N原子和O原子;
②反萃取时,加入稀硫酸,增大水层中浓度,使平衡逆向移动,使水层中浓度增大,即铜离子进入水层;
【小问4详解】
①根据题目信息,水层中含有、、、等阳离子,加入硫酸钠和MgO后,转化为黄钠铁矾固体,对应的离子方程式为或;
②根据题目信息,pH为1.5时沉淀率不高,沉淀不充分;pH为3.8时沉淀率稍高,在固体中混有的杂质较多,故最适宜的pH为2.5;
【小问5详解】
第二次使用MgO调节pH使沉淀完全,即溶液中≤,根据的=,恰好完全沉淀时,=≈,=≈7.14,pH=-lg=-lg(7.14),故10>pH>9。
17. 导电高分子材料PEDOT的一种合成路线如下:
资料:
i.
ii.R5-OH+R6-ClR5-O-R6+HCl
(1)A分子中含有的官能团有_______。
(2)A→B的化学方程式是_______。
(3)B→D的反应类型是_______。
(4)D→E的反应方程式是_______。
(5)F的结构简式是_______。
(6)下列有关J的说法正确的是_______(填字母)。
a.核磁共振氢谱有2组峰
b.能与H2发生加成反应
c.不存在含苯环的同分异构体
d.合成PEDOT的反应属于加聚反应
(7)推测J→PEDOT的过程中,反应物(NH4)2S2O8的作用是_______。
(8)溶剂a为环己烷,若用水代替环己烷,则D的产率下降,分析可能的原因:
①B在水中的溶解度较小,与Na2S的反应不充分;
②_______。
【答案】(1)羧基、碳氯键
(2)ClCH2COOH+C2H5OHClCH2COOC2H5+H2O
(3)取代 (4)++2C2H5OH
(5) (6)ab
(7)作氧化剂(或脱氢)
(8)Na2S水溶液碱性较强导致B(或D)发生水解
【解析】
【分析】A是ClCH2COOH,分子中含有-COOH,能够与C2H5OH在浓硫酸催化下加热发生酯化反应产生B:ClCH2COOC2H5和H2O,B与Na2S环己烷溶液中发生取代反应产生D:和C2H5OH;D与在C2H5ONa作用下发生取代反应产生E:,E与K2CO3、ClCH2-CH2Cl反应产生F:;F与NaOH水溶液共热发生酯的水解反应然后酸化,反应产生G:,经脱羧反应产生J,J与(NH4)2S2O8及催化剂作用反应产生高聚物PEDOT。
【小问1详解】
有机物A分子结构简式是ClCH2COOH,其中含有的官能团是羧基、碳氯键;
【小问2详解】
A是ClCH2COOH,A与C2H5OH在浓硫酸催化下加热,发生酯化反应产生ClCH2COOC2H5和H2O,反应为可逆反应,反应的化学方程式为:ClCH2COOH+C2H5OHClCH2COOC2H5+H2O;
【小问3详解】
B是ClCH2COOC2H5,B与Na2S在环己烷溶液中发生取代反应产生D和NaCl,故B→D的反应类型是取代反应;
【小问4详解】
D是,D与在C2H5ONa作用下发生取代反应产生E:和C2H5OH,则D→E的反应方程式是:++2C2H5OH;
【小问5详解】
根据上述分析可知化合物F结构简式是;
【小问6详解】
a.根据有机物J结构简式可知:该物质分子结构对称,分子中含有2种不同位置H原子,因此其核磁共振氢谱有2组峰,a正确;
b.J分子中含有不饱和的碳碳双键,能够与H2在一定条件下发生加成反应,b正确;
c.该物质分子式是C6H6SO2,可能存在含有苯环的同分异构体,如,c错误;
d.根据有机物J及PEDOT结构的不同,可知J变为PEDOT发生缩聚反应;
【小问7详解】
在有机物J变为PEDOT的过程中,反应物(NH4)2S2O8的作用是作氧化剂(或脱氢);
【小问8详解】
溶剂a为环己烷,若用水代替环己烷,会导致D的产率下降,原因可能是①B在水中的溶解度较小,与Na2S的反应不充分;②是Na2S水溶液碱性较强导致B(或D)发生水解。
18. 对石油开采和炼制过程中产生的含硫废水(其中硫元素的主要化合价是﹣2价)进行处理,防止污染环境。
已知:i.﹣2价硫元素易被氧化为S或
ii.在25℃时,1体积水可溶解约2.6体积的气体
iii.、、在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)沉淀法处理含硫废水
向pH≈10的含硫废水中加入适量溶液,产生黑色沉淀且溶液的pH降低。
①pH≈10的含硫废水中含﹣2价硫元素的主要微粒是___________。
②用化学平衡移动原理解释pH降低的原因:___________。
③初始pH=10时,除硫效果好。初始pH<4,硫的沉淀率很低,原因是___________。
(2)氧化法处理含硫废水
向含硫废水中加入稀调节溶液的pH为6。
①根据电离常数计算溶液中___________:1。
②再加入0.15ml/L溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:___________。
(3)处理后废水中残留﹣2价硫元素含量的测定
已知:、
①处理后的废水中﹣2价硫元素的含量是___________mg/L。
②加入溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为,使测得的﹣2价硫元素含量___________(填“偏大”或“偏小”)。
【答案】(1) ①. ②. 存在平衡,向该废水中加入含Fe2+溶液,发生反应,使平衡正向移动,增大,降低 ③. ,体系中-2价硫元素以H2S的形态出现,H2S可能逸出,c(S2-)降低,Q(FeS)
(3) ①. ②. 偏大
【解析】
【小问1详解】
①根据图中信息,当溶液的的含硫废水中含﹣2价硫元素的主要微粒是:;
②存在平衡,向该废水中加入含Fe2+溶液,发生反应,使平衡正向移动,增大,降低;
③,体系中-2价硫元素以H2S的形态出现,H2S可能逸出,c(S2-)降低,Q(FeS)
①根据如图,,,;
②向溶液中加入,10min后发生反应:S+3H2O2=SO+2H2O+2H+,生成了H+,增大,降低;
【小问3详解】
①根据反应:、,﹣2价硫元素的物质的量为:,硫元素的含量为:;
②若溶液呈中性时,部分﹣2价硫元素被氧化为,发生反应:,则I2氧化-2价硫过程中消耗I2物质的量增大,用溶液滴定过量I2时消耗溶液的体积V2减小,由可知,S2-的物质的量偏大,使测得的﹣2价硫元素含量偏大。
19. 探究溶液中与单质S的反应。
资料:不溶于盐酸,和在盐酸中均发生沉淀的转化
实验Ⅰ 将10mL 溶液与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有_______性,推测b中可能含有、Ag、或。
②检验黑色固体b的成分
实验Ⅱ 具体操作如图所示
ⅰ.取少量滤液c,先加入足量稀盐酸,再滴加溶液,未出现白色沉淀,判断黑色固体b中不含_______。
ⅱ.用滤液c继续实验证明了黑色固体b中不含,可选择的试剂是_______(填序号)。
a.酸性溶液 b.和的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有,写出同时生成Ag和的离子方程式:_______。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在或,依据是_______。
实验Ⅲ 具体操作如图所示
①说明溶液a中不含的实验证据是_______。
②加入足量稀盐酸的作用是_______。
(3)在注射器中进行实验Ⅳ,探究溶液与S的反应,所得产物与实验Ⅰ相同。
①向注射器中加入的物质是_______。
②改用溶液的目的是_______。
(4)用溶液与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中与S反应的离子方程式并简要说明的作用:_______。
【答案】(1) ①. 氧化性和还原 ②. ③. bc ④.
(2) ①. S转化为发生了还原反应,反应必然同时发生氧化反应,能发生氧化反应的只有S,故在pH≈1的溶液中可能存在或 ②. 向溶液a中加入足量稀盐酸后,再加入碘水和淀粉溶液,蓝色不褪去 ③. 排除对和检验的干扰
(3) ①. 10mL 溶液与0.01g S粉 ②. 排除(H+)对反应的影响
(4),形成难溶物,降低,提高S的氧化性,利于反应发生
【解析】
【小问1详解】
①由转化为、Ag、或可见Ag的化合价有上升也有下降,表现了根据S具有氧化还原性;
ⅰ.取少量滤液c,先加入足量稀盐酸,再滴加溶液,未出现白色沉淀,判断黑色固体b中不含,若含有硫酸根则会生成硫酸钡沉淀;
ⅱ.用滤液c继续实验证明了黑色固体b中不含,可选择的试剂是和的混合溶液,因为双氧水将亚硫酸根氧化为硫酸根与氯化钡生成硫酸钡白色沉淀;溴水具有氧化性将亚硫酸根氧化为硫酸根产生白色沉淀,且溴水褪色,酸性高锰酸钾溶液中可能会含有硫酸根影响检验;
ⅲ.沉淀e含有Ag、气体含有,与Fe在酸性环境下同时生成Ag和,离子方程式:;
【小问2详解】
溶液a中可能存在或,依据是S转化为发生了还原反应,反应必然同时发生氧化反应,能发生氧化反应的只有S,故在pH≈1的溶液中可能存在或;
①说明溶液a中不含的实验证据是:向溶液a中加入足量稀盐酸酸化后,再加入碘水和淀粉溶液,蓝色不褪去,说明碘单质没有被还原;
②加入足量稀盐酸的作用是:对溶液进行酸化,排除对和检验的干扰;
【小问3详解】
①向注射器中加入的物质是:10mL 溶液与0.01g S粉;
②改用溶液的目的是:排除(H+)对反应的影响
【小问4详解】
与S反应的离子方程式并简要说明的作用:,形成难溶物,降低,提高S的氧化性,利于反应发生。元素
X
Y
Z
Q
结构信息
有5个原子轨道填充有电子,有3个未成对电子
有8个不同运动状态的电子
能级上有2个电子
价电子排布式为
A.证明羟基使苯环活化
B.除去乙酸乙酯中的少量乙酸
C.制备胶体
D.证明浓硫酸具有强氧化性
物质
反应终点pH
沉淀率/%
1.5
94.04
0.19
2.5
99.21
0.56
3.8
99.91
3.31
北京市第一六一中学2023-2024学年高三下学期开学考化学试题: 这是一份北京市第一六一中学2023-2024学年高三下学期开学考化学试题,共12页。
北京市第十三中学2023-2024学年高三下学期开学测试化学试题+: 这是一份北京市第十三中学2023-2024学年高三下学期开学测试化学试题+,共13页。
安徽省滁州市定远中学2023-2024学年高一下学期开学摸底检测卷+化学试题: 这是一份安徽省滁州市定远中学2023-2024学年高一下学期开学摸底检测卷+化学试题,文件包含参考答案docx、2023~2024学年第二学期开学摸底检测卷docx等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。












