




还剩8页未读,
继续阅读
所属成套资源:2025年高中化学新人教版选择性必修1课件(38份)
成套系列资料,整套一键下载
2025年高中化学第2章微专题1三种平衡常数及计算课件新人教版选择性必修1
展开
这是一份2025年高中化学第2章微专题1三种平衡常数及计算课件新人教版选择性必修1,共15页。
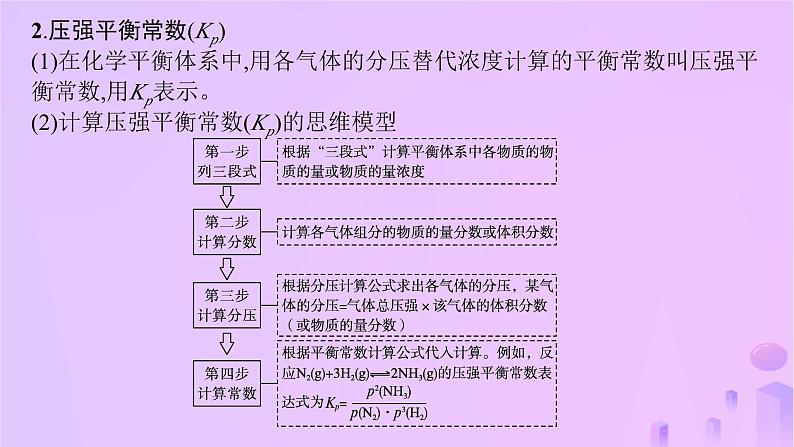
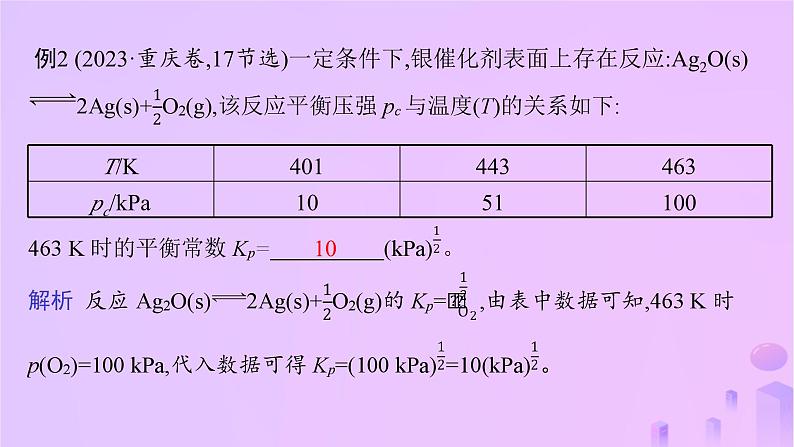
第二章 微专题1 三种平衡常数及计算专题阐释1.化学平衡常数(K)(1)在化学平衡体系中,用各物质的浓度计算的平衡常数叫化学平衡常数,c(B)、c(C)、c(D)分别代表四种物质的平衡浓度。(2)根据题中数据,列出“三段式”并结合某些元素守恒计算化学平衡常数(K)及转化率。例1 (2022·浙江6月选考,29节选)主要成分为H2S的工业废气的回收利用有重要意义。将三分之一的H2S燃烧,产生的SO2与其余H2S混合后反应: 中各组分的浓度分别为c(H2S)=2.0×10-5 mol·L-1、c(SO2)=5.0×10-5 mol·L-1、c(H2O)=4.0×10-3 mol·L-1,则该温度下的平衡常数K= 。 8×108 2.压强平衡常数(Kp)(1)在化学平衡体系中,用各气体的分压替代浓度计算的平衡常数叫压强平衡常数,用Kp表示。(2)计算压强平衡常数(Kp)的思维模型例2 (2023·重庆卷,17节选)一定条件下,银催化剂表面上存在反应:Ag2O(s)10 3.物质的量分数平衡常数(Kx)(1)在化学平衡体系中,用各气体的物质的量分数替代浓度计算的平衡常数叫做物质的量分数平衡常数,用Kx表示。例3 (2022·河北卷,17节选)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。(2)其他条件不变,H2O(g)起始量增加到5 mol,达平衡时,α=0.90,b=0.65,平衡体系中H2(g)的物质的量分数为 (结果保留两位有效数字)。 解析 (1)恒温恒压条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为α,CO2(g)的物质的量为b mol,则转化的CH4(g)为α mol,剩余的CH4(g)为(1-α) mol。根据C元素守恒可知,CO(g)的物质的量为(α-b) mol;根据H和O元素守恒可知,H2O(g)的物质的量为(1-α-b) mol,H2(g)的物质的量为(3α+b) mol,则反应混合物的总物质的量为(2α+2) mol,平衡混合物中, (2)其他条件不变,H2O(g)起始量增加到5 mol,达平衡时,α=0.90,b=0.65,则平衡时,CH4(g)为0.1 mol;根据C元素守恒可知,CO(g)的物质的量为0.25 mol;根据H和O元素守恒可知,H2O(g)的物质的量为(5-0.90-0.65) mol=3.45 mol,H2(g)的物质的量为(3α+b) mol=3.35 mol,平衡混合物的总物质的量为(2α+6) mol=7.8 mol,故平衡体系中H2(g)的物质的量分数为 ≈0.43。专题精练1.(2023·全国乙卷,28节选)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ),平衡时 的关系如图所示。660 K时,该反应的平衡总压p总= kPa,平衡常数Kp(Ⅰ)= (kPa)2。 3.0 2.252.(2023·湖北卷,19节选)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 解析 设起始时C40H12的物质的量为1 mol,平衡转化率为α,则有: C40H12(g) C40H10(g) + H2(g)起始/mol 1 0 0转化/mol α α α平衡/mol 1-α α α
第二章 微专题1 三种平衡常数及计算专题阐释1.化学平衡常数(K)(1)在化学平衡体系中,用各物质的浓度计算的平衡常数叫化学平衡常数,c(B)、c(C)、c(D)分别代表四种物质的平衡浓度。(2)根据题中数据,列出“三段式”并结合某些元素守恒计算化学平衡常数(K)及转化率。例1 (2022·浙江6月选考,29节选)主要成分为H2S的工业废气的回收利用有重要意义。将三分之一的H2S燃烧,产生的SO2与其余H2S混合后反应: 中各组分的浓度分别为c(H2S)=2.0×10-5 mol·L-1、c(SO2)=5.0×10-5 mol·L-1、c(H2O)=4.0×10-3 mol·L-1,则该温度下的平衡常数K= 。 8×108 2.压强平衡常数(Kp)(1)在化学平衡体系中,用各气体的分压替代浓度计算的平衡常数叫压强平衡常数,用Kp表示。(2)计算压强平衡常数(Kp)的思维模型例2 (2023·重庆卷,17节选)一定条件下,银催化剂表面上存在反应:Ag2O(s)10 3.物质的量分数平衡常数(Kx)(1)在化学平衡体系中,用各气体的物质的量分数替代浓度计算的平衡常数叫做物质的量分数平衡常数,用Kx表示。例3 (2022·河北卷,17节选)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。(2)其他条件不变,H2O(g)起始量增加到5 mol,达平衡时,α=0.90,b=0.65,平衡体系中H2(g)的物质的量分数为 (结果保留两位有效数字)。 解析 (1)恒温恒压条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为α,CO2(g)的物质的量为b mol,则转化的CH4(g)为α mol,剩余的CH4(g)为(1-α) mol。根据C元素守恒可知,CO(g)的物质的量为(α-b) mol;根据H和O元素守恒可知,H2O(g)的物质的量为(1-α-b) mol,H2(g)的物质的量为(3α+b) mol,则反应混合物的总物质的量为(2α+2) mol,平衡混合物中, (2)其他条件不变,H2O(g)起始量增加到5 mol,达平衡时,α=0.90,b=0.65,则平衡时,CH4(g)为0.1 mol;根据C元素守恒可知,CO(g)的物质的量为0.25 mol;根据H和O元素守恒可知,H2O(g)的物质的量为(5-0.90-0.65) mol=3.45 mol,H2(g)的物质的量为(3α+b) mol=3.35 mol,平衡混合物的总物质的量为(2α+6) mol=7.8 mol,故平衡体系中H2(g)的物质的量分数为 ≈0.43。专题精练1.(2023·全国乙卷,28节选)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ),平衡时 的关系如图所示。660 K时,该反应的平衡总压p总= kPa,平衡常数Kp(Ⅰ)= (kPa)2。 3.0 2.252.(2023·湖北卷,19节选)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 解析 设起始时C40H12的物质的量为1 mol,平衡转化率为α,则有: C40H12(g) C40H10(g) + H2(g)起始/mol 1 0 0转化/mol α α α平衡/mol 1-α α α
相关资料
更多










