
18,甘肃省武威市天祝一中、民勤一中联考2023-2024学年高一下学期3月月考化学试题
展开全卷满分100分,考试时间75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
5.本卷主要考查内容:必修第二册第五章~第六章第一节。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 Zn 65
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注。下列说法正确的是
A. 汽车尾气中的NO,主要来源于汽油、柴油的燃烧
B. 二氧化碳氮氧化物是形成酸雨的罪魁祸首
C. 葡萄酒中加入适量二氧化硫,能起到杀菌消毒、抗氧化的作用
D. 工业废气中的和CO均可采用石灰法进行脱除
【答案】C
【解析】
【详解】A.汽车尾气中NO主要来源于汽车气缸中的氮气和氧气在高温下反应生成的,与汽油、柴油的燃烧无关,A错误;
B.二氧化硫、氮氧化物以及它们在大气中发生反应后的生成物溶于水会形成酸雨,B错误;
C.葡萄酒中加入适量二氧化硫,可以起到杀菌消毒﹑抗氧化的作用,C正确;
D.生石灰的主要成分是CaO,能与反应生成,再被氧气氧化为硫酸钙,工业废气中的可采用石灰法进行脱除,但CO不与CaO反应,D错误;
故选C。
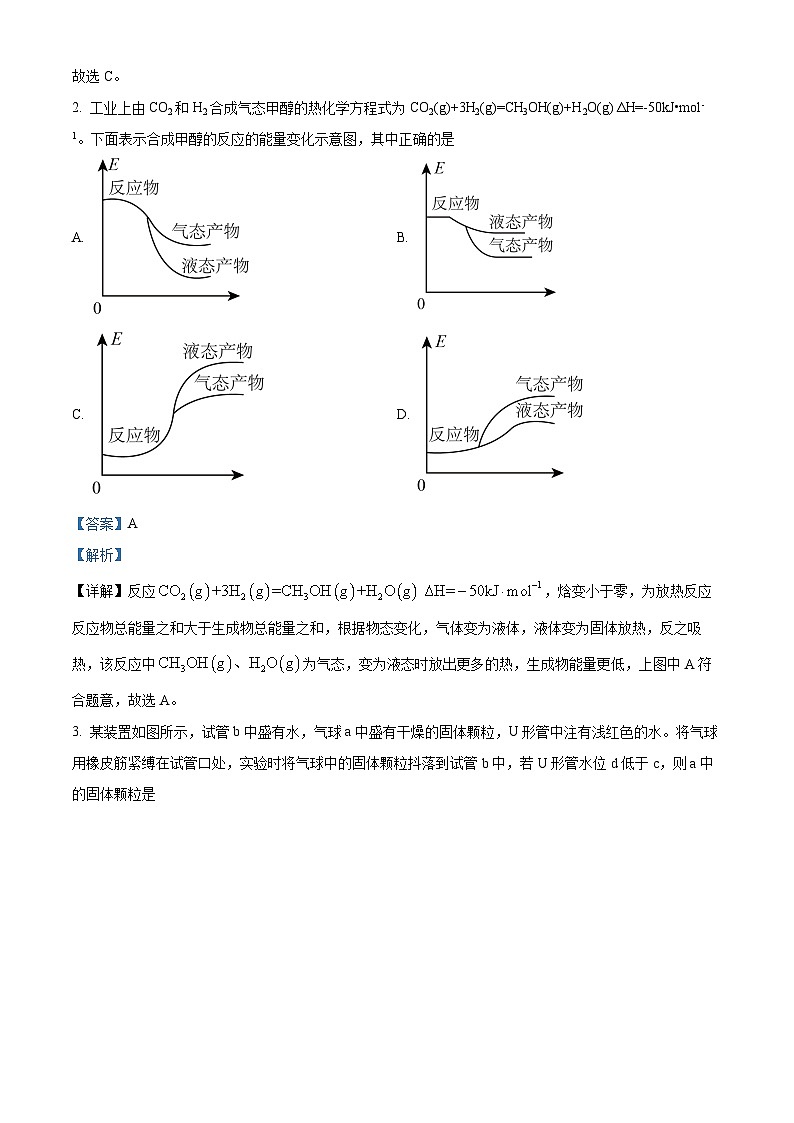
2. 工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ•ml-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是
A. B.
C. D.
【答案】A
【解析】
【详解】反应,焓变小于零,为放热反应反应物总能量之和大于生成物总能量之和,根据物态变化,气体变为液体,液体变为固体放热,反之吸热,该反应中为气态,变为液态时放出更多的热,生成物能量更低,上图中A符合题意,故选A。
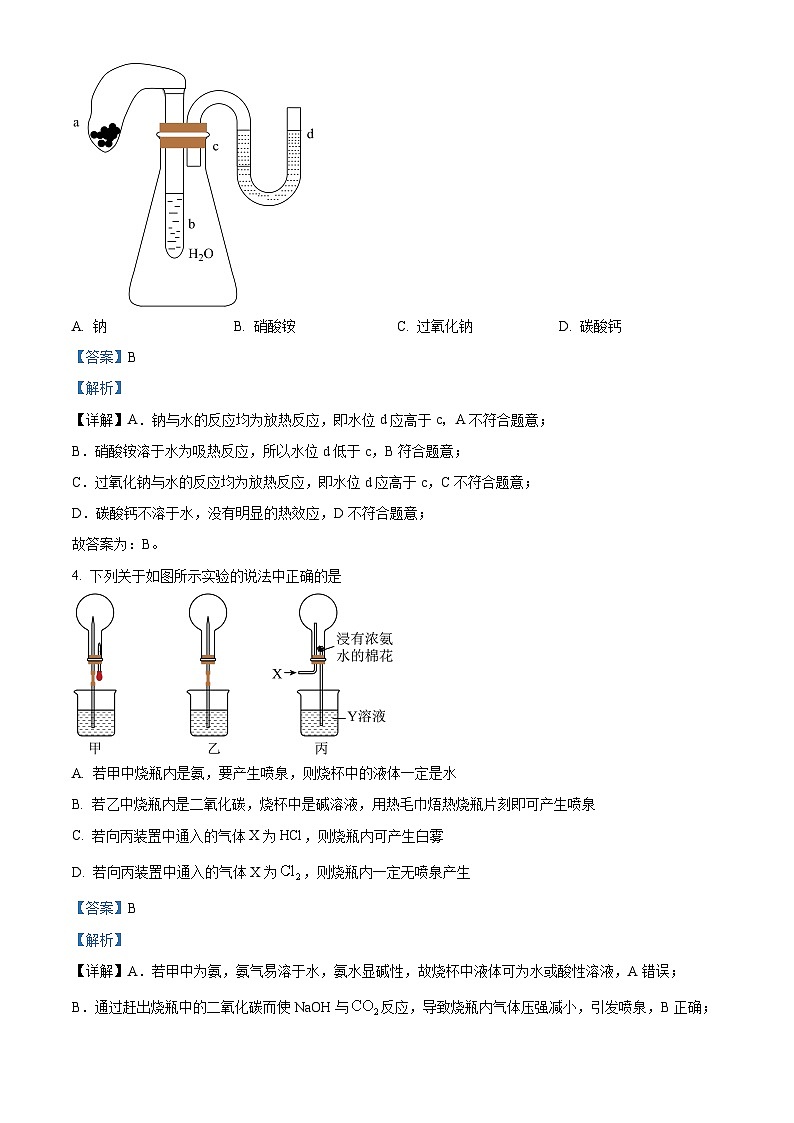
3. 某装置如图所示,试管b中盛有水,气球a中盛有干燥的固体颗粒,U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口处,实验时将气球中的固体颗粒抖落到试管b中,若U形管水位d低于c,则a中的固体颗粒是
A. 钠B. 硝酸铵C. 过氧化钠D. 碳酸钙
【答案】B
【解析】
【详解】A.钠与水的反应均为放热反应,即水位d应高于c,A不符合题意;
B.硝酸铵溶于水为吸热反应,所以水位d低于c,B符合题意;
C.过氧化钠与水的反应均为放热反应,即水位d应高于c,C不符合题意;
D.碳酸钙不溶于水,没有明显的热效应,D不符合题意;
故答案为:B。
4. 下列关于如图所示实验的说法中正确的是
A. 若甲中烧瓶内是氨,要产生喷泉,则烧杯中的液体一定是水
B. 若乙中烧瓶内是二氧化碳,烧杯中是碱溶液,用热毛巾焐热烧瓶片刻即可产生喷泉
C. 若向丙装置中通入的气体X为HCl,则烧瓶内可产生白雾
D. 若向丙装置中通入的气体X为,则烧瓶内一定无喷泉产生
【答案】B
【解析】
【详解】A.若甲中为氨,氨气易溶于水,氨水显碱性,故烧杯中液体可为水或酸性溶液,A错误;
B.通过赶出烧瓶中的二氧化碳而使NaOH与反应,导致烧瓶内气体压强减小,引发喷泉,B正确;
C.若向丙装置中通入的气体X为HCl,会发生反应:产生的是白烟而非白雾,C错误;
D.若向丙中通入的气体X为,可发生反应,生成固体,气体体积减小,压强减小,烧瓶内可能产生喷泉,D错误;
故答案为:B。
5. 下列有关物质性质和用途具有对应关系的是
A. 二氧化硅熔点高,可用于制光导纤维B. 浓硫酸具有脱水性,可用于干燥气体
C. 二氧化硫有还原性,可用于漂白纸浆D. 稀硫酸具有酸性,可用于除去铁锈
【答案】D
【解析】
【详解】A.二氧化硅晶体能对光产生全反射,能传递光信号,所以二氧化硅晶体可用于制光导纤维,与其熔点无关,A错误;
B.浓硫酸具有吸水性,可用作干燥剂,B错误;
C.二氧化硫有漂白性,可用于漂白纸浆,与其还原性无关,C错误;
D.铁锈的主要成分是,可用稀硫酸除去,D正确;
故选D。
6. 在给定条件下,下列物质间所示的转化可以实现的是
A.
B.
C.
D.
【答案】C
【解析】
【详解】A.NO与不反应,A错误;
B.S与在点燃条件下反应生成,不能直接生成,B错误;
C.铜在空气中受热与氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜和水,故转化可以实现,C正确;
D.与过量反应生成,D错误;
选C。
7. 设为阿伏加德罗常数值。下列叙述正确的是
A. 1ml硫与足量铁反应,转移3个电子
B. 1ml炭和足量热浓硫酸反应可生成个CO分子
C. 标准状况下,2.24L 和的混合气体中分子数为0.2
D. 标准状况下,6.72L 与水充分反应转移的电子数目为0.2
【答案】D
【解析】
【详解】A.1ml硫与足量铁反应生成FeS,转移个电子,A错误;
B.1ml炭和足量热浓硫酸反应生成的是而不是CO,B错误;
C.标准状况下,2.24L 和混合气体为0.1ml,其分子数为0.1,C错误;
D.反应中,若有3ml 与水反应转移2ml电子,标准状况下6.72L 为0.3ml,转移电子数为0.2,D正确;
选D。
8. 高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料。它的发现和使用曾引起计算机的一场“革命”。可以按下列两种方法制备:
下列说法错误的是
A. 反应①中氧化剂和还原剂的物质的量之比为1∶2
B. 流程中HCl、和均可以循环利用
C. ③中发生反应的化学方程式为
D. 反应①、②、③、④、⑤均为氧化还原反应
【答案】B
【解析】
【分析】由图知,与C在1800~2000℃下发生反应①,化学反应方程式为,粗硅和Cl2发生反应②,化学反应方程式为,四氯化硅和氢气发生反应④,化学反应方程式为;粗硅和HCl在300℃下发生反应③,化学反应方程式为,在1100℃下与氢气发生反应⑤,化学反应方程式为,据此回答。
【详解】A.二氧化硅高温下与C反应生成硅和CO气体,即反应①的化学方程式为,反应①中氧化剂和还原剂的物质的量之比为1∶2 ,A正确;
B.根据流程和节约成本可知,流程中HCl和可以循环利用。只有消耗,没有生成,故不可以循环利用,B错误;
C.③中发生反应的化学方程式为,C正确;
D.反应①、②、③、④、⑤中元素的化合价均发生改变,故反应①、②、③、④、⑤均为氧化还原反应,D正确;
故选B。
9. 下列装置不能形成原电池的是
A. ①⑤⑥⑦B. ①②③⑤C. ②④⑥⑦D. ①②③④
【答案】A
【解析】
【详解】形成原电池的条件为有两个活性不同的电极、电解质溶液、闭合回路和自发进行的氧化还原反应。
①没有形成闭合回路,不能形成原电池,故选;
②Zn的活泼性比Cu强,Zn和硫酸铜能自发进行氧化还原反应生成Cu和硫酸锌,有闭合回路,能形成原电池,故不选;
③Zn中含Fe杂质构成闭合回路,两者活泼性不同,稀硫酸电解质,能发生氧化还原反应,能形成原电池,故不选;
④Zn和醋酸能发生氧化还原反应,Zn和Pd金属活泼性不同,形成闭合回路,能形成原电池,故不选;
⑤两个电极都是Zn,没有活泼性差异,不能形成原电池,故选;
⑥蔗糖溶液不能导电,不是电解质溶液,不能形成原电池,故选;
⑦缺少盐桥,不能形成闭合回路,不能形成原电池,故选;
故选:A。
10. 汽车尾气管中安装有尾气处理装置,以降低汽车使用过程中对环境的污染,其工作原理如图所示,下列说法正确的是
A. 反应中NO还原剂,为还原产物
B. 汽车尾气的主要污染成分为CO、NO和
C. 催化转化总反应为
D. NO和必须在催化剂表面才能反应
【答案】A
【解析】
【详解】A.根据图示,NO与反应生成,NO为还原剂;和CO反应生成,为还原产物,A正确;
B.汽车尾气的主要污染成分为CO、NO,不是污染物,B错误;
C.根据图示,催化转化总反应为,C错误;
D.NO和可在常温下直接反应生成,不需要催化剂,D错误;
选A。
11. 下列指定反应的离子方程式正确的是
A. 向溶液中滴加稀盐酸:
B. 将稀硝酸滴到锌粒上:
C. 向酸性溶液中通入:
D. 向溶液中滴加溶液,至溶液呈中性:
【答案】D
【解析】
【详解】A.在写离子方程式时应拆开,正确离子方程式应为,A错误;
B.锌与稀硝酸反应不产生氢气,可以生成硝酸锌、一氧化氮和水,B错误;
C.酸性溶液中不可能存在,正确的离子方程式为,C错误;
D.向溶液中滴加溶液,至溶液呈中性,生成硫酸钡沉淀、硫酸钠和水:,D正确;
答案选D。
12. 某化学兴趣小组利用反应,设计了如图所示的原电池装置,下列说法正确的是
A. a极为负极,发生氧化反应
B. b极的电极反应式为
C. 电子流动方向:a电极→溶液→b电极
D. 该装置能实现电能与化学能的相互转换
【答案】B
【解析】
【详解】A.由的移动方向可知,b极为负极,发生氧化反应,根据电池反应式可知,Cu发生失电子的氧化反应,即b极的电极反应式为,A错误,
B.结合A选项可知,B正确;
C.电子不经过溶液,电子的流动方向:b电极→导线→a电极,C错误;
D.该装置是原电池,只能将化学能转换为电能,D错误;
选B。
13. 氨催化氧化法是工业生产中制取硝酸的主要途径,某同学用该原理设计实验探究硝酸的制备和性质,装置如图所示(装置内空气均已排尽)。下列说法错误的是
A. 甲装置中的固体也可以是或
B. 装置丁可以起到防倒吸作用
C. 理论上装置丙中通入的氨气和氧气物质的量之比为时可以完全被吸收生成
D. 装置乙中的干燥剂可以为碱石灰
【答案】A
【解析】
【分析】甲中浓氨水与过氧化钠反应制备氨气和氧气,经过干燥后在丙中发生氨气的催化氧化生成一氧化氮,一氧化氮可生成二氧化氮,过量的氧气与二氧化氮在戊中可生成硝酸,己为尾气吸收装置,据此分析解答;
【详解】A.甲装置需要提供氨气和氧气,如果甲装置中的固体是NaOH或CaO ,只能提供氨气,不能提供氧气,A错误;
B.若发生倒吸,水先进入丁试管中,所以装置丁可以起到防倒吸作用,B正确;
C.根据反应:、可知,装置丙中通入的氨气和氧气物质的量之比为时可以完全被吸收生成,C正确;
D.乙用于干燥氨气、氧气,可用碱石灰干燥,D正确;
答案选A。
14. 向2L的和的混合稀溶液中逐渐加入铁粉,产生无色气体,该气体遇到空气变为红棕色,溶液中的物质的量和加入Fe粉的物质的量之间的关系如图所示,下列叙述错误的是
A. 开始时加入铁粉反应的离子方程式为
B. 加入4ml铁粉时,溶液中有2ml ,3ml
C. 加入5ml铁粉后的溶液中加入盐酸,会有NO气体产生
D. 原溶液中和的物质的量分别为6ml和1ml
【答案】C
【解析】
【详解】A.由实验现象和图像可知开始加入铁粉产生NO和,故开始时加入铁粉发生的离子方程式为,A正确;
B.加入4ml铁粉时,其中1ml铁粉消耗2ml ,产生3ml ,此时溶液中,,B正确;
C.加入铁粉3ml时,硝酸根离子恰好反应完全,加入5ml铁粉后的溶液中溶质的主要成分为硫酸亚铁,加入盐酸后不发生反应,不会放出NO气体,C错误;
D.加入3ml铁粉时发生的离子方程式,消耗3ml 和12ml 生成3ml ,加入铁粉3ml至5ml时,发生的离子反应为,则2ml的铁消耗4ml ,加入3ml铁粉时生成3ml ,故原溶液中含1ml [即含1ml ],5ml后加入铁粉不再产生,则原溶液中仅含12ml (即含6ml ),故原溶液中和的物质的量分别为6ml和1ml,D正确;
故选C。
二、非选择题:本题共4小题,共58分。
15. 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量的变化。回答下列问题:
(1)下列反应中,属于放热反应的是___________(填字母)。
A. 盐酸与B. 晶体和晶体反应
C. Zn和稀硫酸反应D. KOH溶液和稀硝酸反应
(2)由下图的能量转化关系可知生成16g (l)需要___________(填“吸收”或“放出”)___________kJ能量。
(3)下图为1ml (g)和1ml (g)充分反应生成2ml NO(g)的能量变化图。若断裂1ml NO分子中的化学键,需要吸收___________能量。该反应中反应物所具有的总能量___________(填“高于”“低于”或“等于”)生成物所具有的总能量。
(4)某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置:
①某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入了适量溶液与稀硫酸,U形管中可观察到的现象是___________。
②上述3个装置中,能探究“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是___________(填装置序号)。
【答案】(1)CD (2) ①. 放出 ②. 45.5
(3) ①. 632kJ ②. 低于
(4) ①. 左端液面降低,右端液面升高 ②. I、Ⅱ
【解析】
【分析】(4)想要证明某个反应是放热还是吸热,可利用一定量的气体能产生热胀冷缩现象予以证明。装置Ⅰ中,乙是一个密闭体系,存有一定量的空气,会随着甲中反应产生热胀冷缩现象,装置Ⅱ中,丁是一个密闭体系,存有一定量的空气,会随着丙中反应产生热胀冷缩现象,装置Ⅲ是敞开体系,故装置Ⅰ、Ⅱ能证明某个反应是放热还是吸热。
【小问1详解】
常见的放热反应有:所有的燃烧,所有的中和反应,金属和酸的反应,金属和水的反应,大多数的化合反应等。
A. 盐酸与的反应是吸热反应,A不符合;
B. 晶体和晶体反应是吸热反应,B不符合;
C. Zn和稀硫酸反应是放热反应,C符合;
D. KOH溶液和稀硝酸反应是放热反应,D符合;
选CD。
【小问2详解】
由图知,生成物的总能量低于反应物的总能量,因此该反应是放热反应,生成2ml (l)需要放出(510-419)kJ= 91kJ能量,则生成16g 即1ml (l)需要放出45.5kJ能量。
【小问3详解】
破坏化学键需要吸收能量,由图知,若断裂1ml NO分子中的化学键,需要吸收632kJ能量。破坏1ml (g)和1ml (g)需要吸收的总能量为946kJ +498kJ =1444kJ,生成2ml NO释放能量为2×632kJ=1264kJ,吸收的能量大于放出的能量,因此氮气和氧气生成一氧化氮的反应是个吸热反应。则该反应中反应物所具有的总能量低于生成物所具有的总能量。
【小问4详解】
①装置I中,甲试管溶液与稀硫酸的反应放热,则乙中气体受热膨胀,U形管中可观察到的现象是:左端液面降低,右端液面升高。
②据分析,上述3个装置中,装置Ⅰ可通过U形管中红墨水液面的变化,判断铜与浓硝酸的反应是吸热还是放热,装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热还是吸热,装置Ⅲ只是一个铜与浓硝酸反应并将产生的气体用水吸收的装置,不能证明该反应是放热还是吸热反应,则能探究“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是I、Ⅱ。
16. 硅是带来人类文明的重要元素之一,工业上可用石英砂制备硅单质。
(1)硅和锗(Ge)属于同主族元素。下列推测不合理的是___________(填字母)。
a.Ge与Si的最外层电子数均为4 b.常温下是气体
c.酸性: d.Si和Ge都可做半导体材料
(2)下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。
①洗涤石英砂的目的是___________。
②在以上流程中,能否将盐酸改为NaOH溶液,请说明理由:___________。
(3)氮化硅()是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气中制得。反应的化学方程式为。
①该反应中的氧化剂为___________(填化学式)。
②若生成标准状况下16.8L CO,则生成氮化硅的质量是___________(保留1位小数)。
(4)我国成功发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测。月球上的主要矿物有辉石(主要成分为)、斜长石(主要成分为)和橄榄石(主要成分为)等,橄榄石的主要成分中铁元素为___________价,橄榄石的主要成分的氧化物形式可表示为___________。辉石、斜长石及橄榄石的主要成分均属于___________(填“氧化物”“混合物”或“硅酸盐”)。
【答案】(1)bc (2) ①. 除去石英砂表面的NaCl杂质 ②. 不能,二氧化硅能与NaOH溶液反应
(3) ①. ②. 17.5g
(4) ①. +2 ②. ③. 硅酸盐
【解析】
【小问1详解】
a.Ge和Si是同主族元素,最外层电子数均为4 ,故a正确;
b.同主族元素具有相似的性质,常温下是固体,故也是固体,故b错误;
c.同主族元素从上到下非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱,因此酸性:,故c错误;
d.Si和Ge在金属与非金属的交界处,既有金属性,也由非金属性,导电性介于导体和绝缘体之间,故都可做半导体材料,故d正确。
故选bc;
【小问2详解】
①石英石不溶于水,氯化钠易溶于水,氧化铝难溶于水,因此洗涤石英砂的目的是除去石英砂表面的NaCl杂质;②在以上流程中,用盐酸讲氧化铝溶解,而二氧化硅与盐酸不反应,因此溶解后过滤得到二氧化硅,由于二氧化硅能和氢氧化钠反应,故不能将盐酸改为氢氧化钠;
【小问3详解】
①在反应中,C的化合价由0升高到+2,被氧化,N的化合价由0价降低到-3价,被还原,故氧化剂为;②若生成标准状况下16.8L CO,即物质的量为,根据化学方程式即可得到氮化硅的质量为;
【小问4详解】
橄榄石中Mg的化合价为+2价,Si是+4价,O为-2价;根据化合价代数和为0可判断铁为+2价;根据原子守恒可知橄榄石(主要成分为)的氧化物形式可表示为;根据辉石、斜长石及橄榄石的化学式,可判断均为硅酸盐。
17. 依据原电池原理,请回答下列问题。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池属于___________(填“一次电池”或“二次电池”),锌锰电池的正极材料是___________,负极发生的电极反应式为___________。若反应消耗19.5g负极材料,则电池中转移电子的数目为___________。
(2)以Al、Mg为电极,可以组装如图所示原电池装置。
①若电解质溶液为稀硫酸,Mg上发生的电极反应式为___________。
②若电解质溶液为NaOH溶液,Al上发生的电极反应式为___________。
(3)微型锌银电池可用作电子仪器的电源,其电极分别是Ag/和Zn,电解质溶液为KOH溶液,电池总反应为。负极发生的电极反应式为___________,电池工作过程中,电解液中向___________(填“Ag/”或“Zn”)极迁移。
【答案】(1) ①. 一次电池 ②. 石墨 ③. ④. (或0.6)
(2) ①. ②.
(3) ①. ②. Zn
【解析】
【小问1详解】
锌锰干电池只能一次性使用,不能充电,属于一次电池,锌锰电池中锌较活泼,锌失去电子发生氧化反应为正极,石墨为正极;负极发生的电极反应式为;若反应消耗19.5g负极材料,反应锌0.3ml,则电池中转移电子0.6ml,电子数目为(或0.6);
【小问2详解】
①若电解质溶液为稀硫酸,Mg失去电子发生氧化反应,为负极,发生的电极反应式为。
②若电解质溶液为NaOH溶液,镁不能和氢氧化钠反应,Al失去电子发生氧化反应,为负极,发生的电极反应式为;
【小问3详解】
由总反应可知,锌失去电子发生氧化反应生成氢氧化锌,为负极,;原电池中阴离子向负极迁移,故电池工作过程中,电解液中向Zn极迁移。
18. 某学习小组用如图所示的实验装置探究能否被硝酸盐氧化(部分夹持仪器省略)。
回答下列问题:
(1)盛装浓硫酸的仪器名称是___________,该仪器使用的第一步操作是___________。
(2)实验时,先打开弹簧夹通一段时间,再滴加70%浓硫酸,目的是___________。
(3)装置A中发生反应的化学方程式为___________。
(4)开始实验后装置C中产生白色沉淀,实验结束后装置D试管中收集到的气体遇空气变为红棕色,则实验初期装置C中发生反应的离子方程式是___________。
(5)若D中试管收集到标准状况下0.224L气体,再向其中通入标准状况下___________L ,可使试管内充满液体。
(6)测定反应后装置B溶液中的浓度时,只考虑与的反应。用0.10酸性溶液与20.00mLB中溶液中的反应,共消耗溶液18.00mL,则B中为___________(保留两位小数)。
【答案】(1) ①. 分液漏斗 ②. 检查是否漏水
(2)排尽装置中的空气,防止实验时干扰气体性质验证(答案合理即可)
(3)
(4)
(5)0.168 (6)0.45ml/L
【解析】
【分析】A中通过反应:制取SO2,B、C用于探究SO2能否被硝酸盐氧化,D用于收集反应中产生的气体,为防止实验时装置内的空气干扰气体性质验证,实验时,应先打开弹簧夹通一段时间N2,再滴加70%浓硫酸,以排尽装置中的空气。
【小问1详解】
由图可知,盛装浓硫酸的仪器为:分液漏斗;该仪器使用的第一步操作是检查是否漏水;
【小问2详解】
实验时,先打开弹簧夹通一段时间N2,再滴加70%浓硫酸,目的是:排尽装置中的空气,防止实验时干扰气体性质验证(答案合理即可);
【小问3详解】
A中浓硫酸与Na2SO3反应生成Na2SO4、水、SO2,反应的化学方程式为:;
【小问4详解】
实验初期装置C中SO2被氧化为 , 与Ba2+结合为BaSO4沉淀,反应离子方程式为:;
【小问5详解】
由方程式可知,若D中试管收集到标准状况下0.224L气体即0.01mlNO,再向其中通入氧气可使试管内充满液体,即需要标准状况下O2:22.4L/ml×0.0075ml= 0.168L;
【小问6详解】
Fe2+被酸性高锰酸钾氧化的离子方程式为:,可得关系式:,即 ,。
甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期5月期中联考化学试题: 这是一份甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期5月期中联考化学试题,共12页。试卷主要包含了本卷主要考查内容,工业制备高纯硅的原理示意图如下等内容,欢迎下载使用。
甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期3月月考化学试卷(PDF版附解析): 这是一份甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期3月月考化学试卷(PDF版附解析),共10页。
甘肃省武威市天祝一中、民勤一中2023-2024学年高二下学期第一次月考化学试卷(PDF版附答案): 这是一份甘肃省武威市天祝一中、民勤一中2023-2024学年高二下学期第一次月考化学试卷(PDF版附答案),共6页。













