






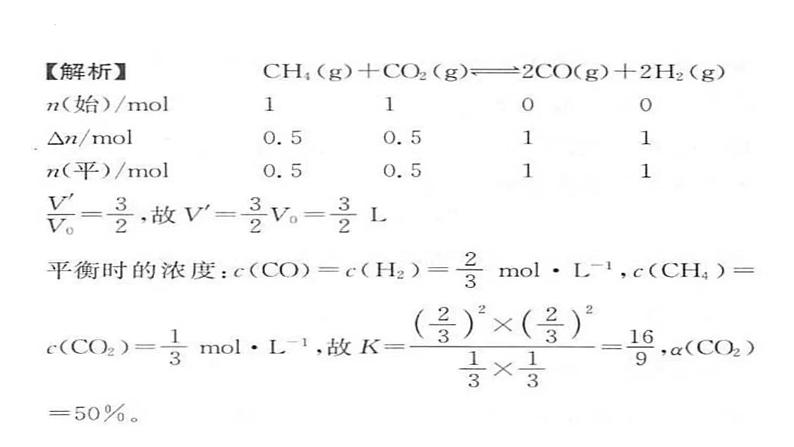
2024届高三化学二轮复习 压强平衡常数及其他平衡常数课件
展开1. 定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,用符号K表示。2. 表达式:mA+nB pC+qD化学平衡常数表达式为:
一 浓度平衡常数 K 的计算
【注意事项】⑴ 对于某一可逆反应,平衡常数只受温度影响,与反应物或生成物的起始浓度、压强变化无关。升温,吸热反应的平衡常数增大,放热反应的平衡常数减小⑵ 在平衡常数表达式中:水(液态)的浓度、固体物质的浓度不写⑶ 平衡常数表达式与化学方程式的书写方式有关,对于同一化学反应,由于书写方式不同,各反应物、生成物的系数不同,平衡常数的表达式就不同⑷ 将化学计量数扩大或缩小,K值可能会相应改变⑸ 同一可逆反应的K(正)与K(逆)互为倒数⑹ 若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)
4. 计算方法:①根据三段式法计算平衡体系中各组分的物质的量或物质的量浓度;②根据平衡常数计算公式代入计算
用CO2和H2可以在一定条件下生成CH3OH(不考虑副反应)
某温度下,恒容密闭容器中,CO2和H2的起始浓度分布为a ml/L和3a ml/L,反应平衡时, CH3OH 的产率为b,该温度下反应平衡常数的值为
【解析】假设在该条件下,CO2和H2的起始浓度分别为a ml/L和3a ml/L,CH3OH 的产率为b,则生成的CH3OH 的物质的量浓度ab ml/L根据三段式可知:
练习1.对于CH4(g)+CO2(g)
某温度下,在体积为1 L的恒压密闭容器中加入1 ml CH4、1 ml CO2和催化剂进行上述反应,平衡时,CH4的转化率为50%,则该温度下的化学平衡常数为________。CO2的转化率为________。
2CO(g)+2H2(g)。
1. 定义:在化学平衡体系中,各气体物质的平衡分压替代物质的量浓度,计算的平衡常数叫压强平衡常数,用符号Kp表示。2. 注意:①仅适用于有气体的化学平衡,以分压表示各成分的浓度;②压强平衡常数只受温度影响。3. 表达式:①N2(g)+3H2(g) 2NH3(g)的压强平衡常数表达式为:
②C(s)+CO2(g) 2CO(g)的压强平衡常数表达式为:
二 压强平衡常数 KP的计算
4. 计算方法:①根据三段式法计算平衡体系中各组分的物质的量或物质的量浓度;②计算各气体组分的物质的量分数或体积分数;③根据分压计算公式,求出各气体物质的分压;某气体的分压=气体总压强×该气体的物质的量分数(或体积分数)
④根据压强平衡常数计算公式代入计算
例2:(2022·乙卷)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:已知的热分解反应为 在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________,平衡常数Kp=________。
【答案】50% 4.76kPa
【解析】假设在该条件下,H2S和Ar的起始投料的物质的量分别为1ml和4ml,根据三段式可知:平衡时H2S和H2的分压相等,则二者的物质的量相等,即1-x=x,解得x=0.5,所以H2S的平衡转化率,
平衡时H2S的物质的量为1-x=1-0.5=0.5 ml, S2的物质的量为0.5x=0.25 ml, H2的物质的量为x=0.5 ml。气体的总物质的量为0.5+0.25+0.5+4=5.25ml。(注意:这里的4为惰性组分,不参与反应,但参与分压)所以平衡常数Kp=
= ≈4.76kPa。
(2019全国卷)某温度下,等物质的量的碘和环戊烯,在恒容容器内发生反应
, 起始总压为105Pa,平衡时总压增加了20%,该反应的平衡常数Kp=_________Pa。
“刚性容器”、“体积固定的密闭容器”等字眼,说明反应li 在恒容条件下发生,若反应前后的气体分子总数发生改变, 往往意味着平衡时,容器内的压强会发生改变。
解析:假设反应前碘单质与环戊烯均为nml,平衡时环戊烯反应了xml,根据题意可知;
平衡时总压增加了20%,恒温恒容下,压强之比等于物质的量之比,
金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为(TiCl4),再进一步还原得到钛。回答下列问题:(1) TiO2转化为TiCl4有直接氯化法和碳氯化法。在时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化: (ⅱ)碳氯化: ①反应 的∆H为_______kj·ml-1,_______Pa。
【答案】-223 1.2×1014Pa
【解析】根据盖斯定律,将“反应ⅱ-反应ⅰ”得到反应2C(s)+O2(g)=2CO(g),则∆H=-51kJ/ml-172kJ/ml=-223kJ/ml;Kp===1.2×1014Pa。
(已知:分压=总压×该组分物质的量分数)
,其中 PE 、PH 、 PD 、 PG 为各组分的平衡分压)。
在一定温度下,当一个可逆反应达到化学平衡时,在化学平衡体系中,求算出各气体物质的平衡分压
(2021湖南)氨气中氢含量高,是一种优良 小分子储氢载体,且安全、易储运,可通过氨热解法制备氢气,在一定温度和催化剂的条件下,将 0.1mlNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示:
在该温度下,反应的标准平衡常数
根据题意图可知,平衡时,体系中各物质的分压为P(NH3)=120kPa,P(N2)=40kPa,P(H2)=120kPa
考查四 物质的量分数平衡常数Kx(2021山东)2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
回答下列问题:反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx ,向某反应容器中加1.0mlTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为 ml,反应Ⅰ的平衡常数Kx1= 。
高中化学人教版 (2019)选择性必修1第二节 化学平衡公开课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡公开课ppt课件,共25页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡优秀ppt课件: 这是一份化学选择性必修1第二节 化学平衡优秀ppt课件,共39页。PPT课件主要包含了第二节化学平衡,知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业八,课后作业等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度授课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度授课ppt课件,共19页。PPT课件主要包含了0kPa-1,01MPa等内容,欢迎下载使用。












