




- 专题七 物质结构与性质综合题 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用) 试卷 1 次下载
- 专题八 化学反应中的能量变化 反应机理 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用) 试卷 1 次下载
- 专题一0 化学反应速率与化学平衡 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用) 试卷 1 次下载
- 专题一0一 水溶液中的离子反应与平衡 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用) 试卷 1 次下载
- 专题一0二 化学反应原理综合题 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用) 试卷 1 次下载
专题九 电化学及其应用 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用)
展开一、高考真题汇编的意义
1、增强高考考生的复习动力和信心。
2、提高高考考生的复习效率。使考生能够更好地梳理复习的重点,提高复习效率。
3、加深考生对知识点的理解和掌握。
二、高考真题汇编的内容
1、高考试题收录。高考真题汇编收录高考真题,涵盖了高考考试的各个学科。
2、答案解析。高考真题汇编提供了详细的答案解析,加深考生对知识点的理解和掌握。
3、复习指导。高考真题汇编还提供了一些复习指导,提高复习效率。
三、高考真题汇编的重要性
高考真题汇编不仅可以提高考生的复习动力和信心,增强考生的复习效率,而且还可以加深考生对知识点的理解和掌握,使考生更好地把握考试方向,为高考复习提供了有力的支持。本文介绍了高考真题汇编的意义、内容和重要性,分析了它对高考考生的重要作用,强调了它在高考复习中的重要性。
专题九 电化学及其应用
考点1 原电池 化学电源
1.(2023·广东卷,6)负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是
A.作原电池正极
B.电子由经活性炭流向
C.表面发生的电极反应:
D.每消耗标准状况下的,最多去除
【答案】B
【解析】在Pt得电子发生还原反应,Pt为正极,Cl-在Ag极失去电子发生氧化反应,Ag为负极。Cl-在Ag极失去电子发生氧化反应,Ag为负极,A错误;电子由负极经活性炭流向正极,B正确;溶液为酸性,故表面发生的电极反应为,C错误;每消耗标准状况下的,转移电子2ml,而失去2ml电子,故最多去除,D错误。
2.(2023·辽宁卷,11)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧通过质子交换膜移向左侧
D.充电总反应:
【答案】B
【解析】该储能电池放电时,Pb为负极,失电子结合硫酸根离子生成PbSO4,则多孔碳电极为正极,正极上Fe3+得电子转化为Fe2+,充电时,多孔碳电极为阳极,Fe2+失电子生成Fe3+,PbSO4电极为阴极,PbSO4得电子生成Pb和硫酸。放电时负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;储能过程中,该装置为电解池,将电能转化为化学能,B正确;放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;充电时,总反应为PbSO4+2Fe2+=Pb++2Fe3+,D错误。
3.(2022·浙江1月选考,21) pH计是一种采用原电池原理测量溶液pH的仪器。如图4所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=E-常数0.059。下列说法正确的是
图4
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为AgCl(s)+e-Ag(s)+Cl-(0.1 ml·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
【答案】C
【解析】如果玻璃薄膜球内电极电势低,则该电极为负极,电极反应式为Ag-e-+Cl-AgCl,A项错误;玻璃膜内外H+浓度存在差异,则会引起电极电势的变化,B项错误;根据pH=E-常数0.059,测量时以标准溶液标定pH计,然后测量待测液的pH,C项正确;pH计工作原理为原电池原理,故为化学能转化为电能,D项错误。
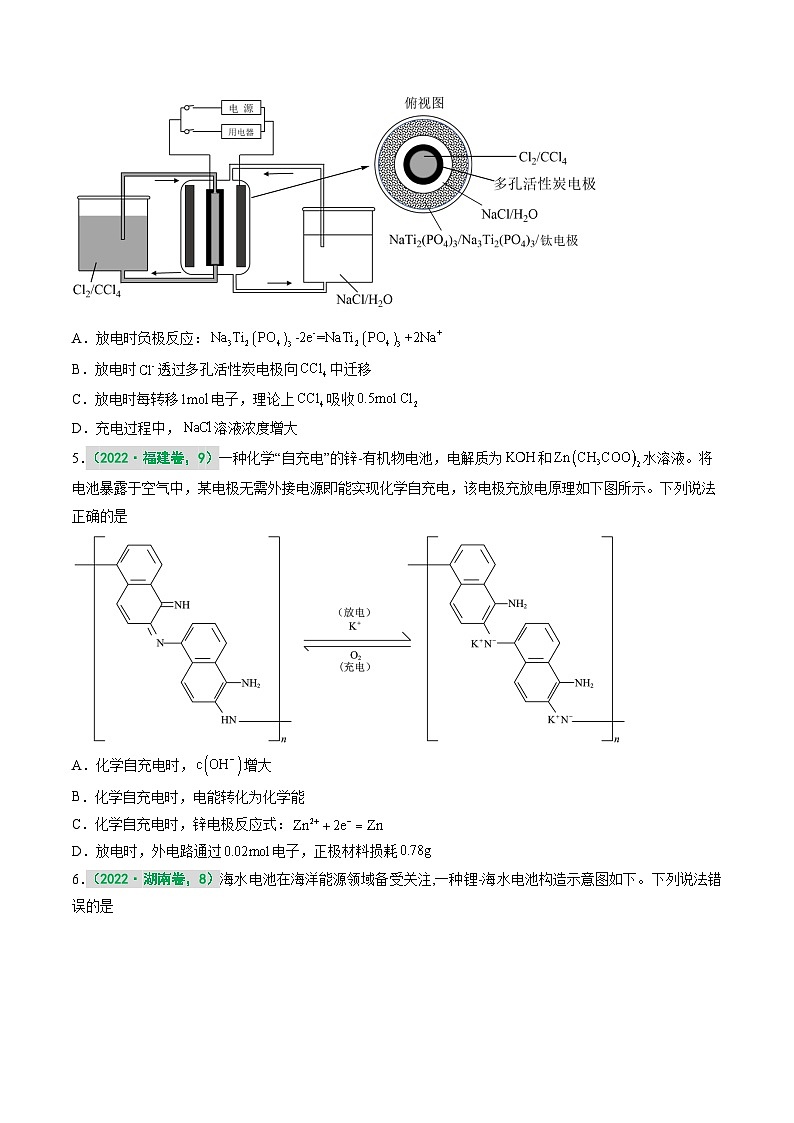
4.(2022·辽宁卷,14)某储能电池原理如图。下列说法正确的是
A.放电时负极反应:
B.放电时透过多孔活性炭电极向中迁移
C.放电时每转移电子,理论上吸收
D.充电过程中,溶液浓度增大
【答案】A
【解析】放电时负极反应:,正极反应:Cl2+2e-=2Cl-,消耗氯气,放电时,阴离子移向负极,充电时阳极:2Cl--2e-=Cl2。放电时负极失电子,发生氧化反应,电极反应:,A正确;放电时,阴离子移向负极,放电时透过多孔活性炭电极向NaCl中迁移,B错误;放电时每转移电子,正极:Cl2+2e-=2Cl-,理论上释放,C错误;充电过程中,阳极:2Cl--2e-=Cl2,消耗氯离子,溶液浓度减小,D错误。
5.(2022·福建卷,9)一种化学“自充电”的锌-有机物电池,电解质为和水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是
A.化学自充电时,增大
B.化学自充电时,电能转化为化学能
C.化学自充电时,锌电极反应式:
D.放电时,外电路通过电子,正极材料损耗
【答案】A
【解析】由图可知,化学自充电时,消耗O2,该反应为O2+2H2O+4e-=4OH-,增大,A正确;化学自充电时,无需外接电源即能实现化学自充电,该过程不是电能转化为化学能,B错误;化学自充电时,锌电极作阴极,该电极的电极反应式为O2+2H2O+4e-=4OH-,C错误;放电时,1ml转化为 ,消耗2ml K+,外电路通过电子时,正极物质增加0.02ml K+,增加的质量为0.02ml×39g/ml =0.78g,D错误。
6.(2022·湖南卷,8)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是
图
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
【答案】B
【解析】M极上Li失去电子发生氧化反应,则M极为负极,电极反应式为Li-e-Li+,N极为正极,发生还原反应,据此分析解答。海水中含有丰富的电解质,如氯化钠、氯化镁等,可作电解质溶液,A正确;海水呈弱碱性,有溶解氧,发生的电极反应可能为O2+2H2O+4e-4OH-,B错误;Li是活泼金属,易与水反应,玻璃陶瓷可防止水和Li接触,且玻璃陶瓷也可传导Li+,使M极产生的Li+向正极移动,形成闭合回路,C正确;该电池不可充电,属于一次电池,D正确。
7.(2022·广东卷,16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图6)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-
Na3Ti2(PO4)3。下列说法正确的是
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 ml Cl2,电极a质量理论上增加23 g
【答案】C
【解析】据题中已知信息可知,充电时,电极b的反应式为2Cl--2e-Cl2,则充电时电极b为阳极,A错误;由充电时的电极反应式可知,充电、放电过程溶液的pH没有发生变化,B错误;由充电时的电极反应式可知,放电时的总反应式为Na3Ti2(PO4)3+Cl22Cl-+2Na++NaTi2(PO4)3,显然NaCl溶液的浓度增大,C正确;每生成1 ml Cl2,转移2 ml电子,电极a有1 ml NaTi2(PO4)3转化为Na3Ti2(PO4)3,故电极a理论上增加的质量为2 ml×23 g·ml-1=46 g,D错误。
8.(2021·重庆卷,13)CO2电化学传感器是将环境中CO2浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融Li2CO3和YSZ之间的界面X会生成固体Li2O。下列说法错说的是
A.CO迁移方向为界面X →电极b
B.电极a上消耗的O2和电极b上产生的CO2的物质的量之比为1:1
C.电极b为负极,发生的电极反应为2CO-4e-=O2↑+2CO2↑
D.电池总反应为Li2CO3=Li2O+CO2↑
【答案】B
【解析】根据图示可知在电极a上O2得到电子变为O2-,所以a电极为负极;在电极b上熔融Li2CO3失去电子变为CO2、O2,所以金属电极b为正极,然后根据同种电荷相互排斥,一致电荷相互吸引的原则分析判断。根据图示可知:电极a上O2得到电子变为O2-,所以a电极为正极;在电极b上熔融Li2CO3失去电子变为CO2、O2,所以金属电极b为负极。CO会向负极区移动,故CO迁移方向为界面X →电极b,A正确;在电极a上发生反应:O2+4e-=2O2-,在电极b上发生反应:2CO-4e-= O2↑+2CO2↑,在同一闭合回路中电子转移数目相等,可知电极a上消耗的O2和电极b上产生的CO2的物质的量之比为1:2,B错误;电极b为负极,失去电子发生氧化反应 ,则负极的电极反应为2CO-4e-=O2↑+ 2CO2↑,C正确;负极上熔融的Li2CO3失去电子被氧化产生O2、CO2气体,反应式为Li2CO3(熔融)=2Li++;2CO-4e-=O2↑+2CO2↑,正极上发生反应:O2+4e-=2O2-,根据在同一闭合回路中电子转移数目相等,将正、负极电极式叠加,可得总反应方程式为:Li2CO3=Li2O+CO2↑,D正确。
9.(2021·福建卷,9)催化剂(Ⅱ)的应用,使电池的研究取得了新的进展。电池结构和该催化剂作用下正极反应可能的历程如下图所示。
下列说法错误的是
A.电池可使用有机电解液
B.充电时,由正极向负极迁移
C.放电时,正极反应为
D.、、和C都是正极反应的中间产物
【答案】D
【解析】Li是活泼金属能与水发生反应,因此不能采用水溶液作为电解质,应使用有机电解液,A正确;充电时原电池的负极与电源负极相连作阴极,原电池的正极与电源正极相连作阳极,阳离子由阳极向阴极移动,则由正极(电池中标注“+”,实际阳极)向负极(电池中标注“-”,实际阴极)迁移,B正确;由装置可知,该原电池的正极为二氧化碳得电子生成C单质,电极反应式为:,C正确;由正极的反应历程图示可知,C为最终的产物,不是中间产物,D错误。
10.(2021·湖南卷,10)锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图3所示:
下列说法错误的是
A.放电时,N极为正极
B.放电时,左侧贮液器中ZnBr2的浓度不断减小
C.充电时,M极的电极反应式为Zn2++2e-Zn
D.隔膜允许阳离子通过,也允许阴离子通过
【答案】B
【解析】由图可知,放电时N极作正极,电极反应式为Br2+2e-2Br-,A正确;放电时,M极作负极,电极反应式为Zn-2e-Zn2+,锌离子的浓度增大, ZnBr2的浓度增大,B错误;充电时M极作阴极,电极反应式为Zn2++2e-Zn,C正确;由电池工作原理图可知,隔膜允许阳离子通过,也允许阴离子通过,D正确。
11.(2021·河北卷,9)K-O2电池结构如图4,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是
图4
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
【答案】D
【解析】由图可知,a电极为原电池的负极,单质钾片失去电子发生氧化反应生成钾离子,电极反应式为K-e-K+,b电极为正极,氧气在正极得到电子发生还原反应生成超氧化钾; 金属性强的金属钾易与氧气反应,为防止钾与氧气反应,电池所选择隔膜应允许K+通过,不允许O2通过,故A正确。由分析可知,放电时,a为负极,b为正极,电流由b电极沿导线流向a电极;充电时,b电极应与直流电源的正极相连,作电解池的阳极,故B正确。由分析可知,生成1 ml超氧化钾时,消耗1 ml氧气,两者的质量比值为(1 ml×71 g·ml-1)∶(1 ml×32 g·ml-1)≈2.22,故C正确。铅酸蓄电池充电时的总反应方程式为2PbSO4+2H2OPbO2+Pb+2H2SO4,反应消耗2 ml水,转移2 ml电子,由得失电子守恒可知,消耗3.9 g钾时,铅酸蓄电池消耗水的质量为3.9 g39 g·ml-1×18 g·ml-1=1.8 g,故D错误。
12.(2021·广东卷,9)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
【答案】B
【解析】放电时负极上发生氧化反应,A项错误。放电时CO2在正极上得电子,B项正确。放电时阳离子由负极移向正极,C项错误。放电时该装置为原电池,能量转化形式为化学能转化为电能,D项错误。
13.(2021·浙江6月选考,22)某全固态薄膜锂离子电池截面结构如图3所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCO2薄膜;集流体起导电作用。下列说法不正确的是
图3
A.充电时,集流体A与外接电源的负极相连
B.放电时,外电路通过a ml电子时,LiPON薄膜电解质损失a ml Li+
C.放电时,电极B为正极,反应可表示为Li1-xCO2+xLi++xe-LiCO2
D.电池总反应可表示为LixSi+Li1-xCO2Si+LiCO2
【答案】B
【解析】充电时,电极A是Li+得电子发生还原反应,所以电极A作阴极,集流体A与电源负极相连,A项正确;放电时,电极A是负极,发生氧化反应,电极反应式为LixSi-xe-xLi++Si,电极B是正极,发生还原反应,电极反应式为Li1-xCO2+xe-+xLi+LiCO2,Li+从负极经LiPON薄膜电解质进入正极,LiPON薄膜电解质不损失Li+,B项错误,C项正确;电池总反应为LixSi+Li1-xCO2Si+LiCO2,D项正确。
14.(2021·山东卷,10) 以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 ml O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
【答案】C
【解析】碱性环境下,甲醇燃料电池总反应为2CH3OH+3O2+4KOH2K2CO3+6H2O;N2H4-O2清洁燃料电池总反应为N2H4+O2N2+2H2O;偏二甲肼[(CH3)2NNH2]中C和N的化合价均为-2价,H元素化合价为+1价,所以根据氧化还原反应原理可推知其燃料电池的总反应为(CH3)2NNH2+4O2+4KOH2K2CO3+N2+6H2O。放电过程为原电池工作原理,所以钾离子均向正极移动,A错误;根据上述分析可知,N2H4-O2清洁燃料电池的产物为氮气和水,其总反应中未消耗KOH,所以KOH的物质的量不变,其他两种燃料电池中KOH的物质的量减小,B错误;理论放电量与燃料的物质的量和转移电子数有关,设消耗燃料的质量均为m g,则甲醇、N2H4和(CH3)2NNH2放电量(物质的量表达式)分别是mg32 g·ml-1×6、mg32 g·ml-1×4、mg60 g·ml-1×16,通过比较可知(CH3)2NNH2理论放电量最大,C正确;根据转移电子数守恒和总反应式可知,消耗1 ml O2生成的氮气的物质的量为1 ml,在标准状况下为22.4 L,D错误。
15.(2021·辽宁卷,10)如图,某液态金属储能电池放电时产生金属间化合物Li3Bi。下列说法正确的是
A.放电时,M电极反应为Ni-2e-Ni2+
B.放电时,Li+由M电极向N电极移动
C.充电时,M电极的质量减小
D.充电时,N电极反应为Li3Bi+3e-3Li++Bi
【答案】B
【解析】由题干信息可知,放电时,M极由于Li比Ni更活泼,也比N极上的Sb、Bi、Sn更活泼,故M极作负极,电极反应式为Li-e-Li+,N极为正极,电极反应式为3Li++3e-+BiLi3Bi。由分析可知,放电时,M电极反应为Li-e-Li+,A项错误;由分析可知,放电时,M极为负极,N极为正极,故Li+由M电极向N极移动,B项正确;由二次电池的原理可知,充电时和放电时同一电极上发生的反应互为逆过程,M电极的电极反应为Li++e-Li,故电极质量增大,C项错误;充电时,N电极反应为Li3Bi-3e-3Li++Bi,D项错误。
考点2 电解池 金属的腐蚀与保护
1.(2023·北京卷,5)回收利用工业废气中的和,实验原理示意图如下。
下列说法不正确的是
A.废气中排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是的水解程度大于的电离程度
C.装置a中溶液的作用是吸收废气中的和
D.装置中的总反应为
【答案】C
【解析】是酸性氧化物,废气中排放到空气中会形成硫酸型酸雨,A正确;装置a中溶液的溶质为,溶液显碱性,说明的水解程度大于电离程度,B正确;装置a中溶液的作用是吸收气体,与溶液不反应,不能吸收,C错误;由电解池阴极和阳极反应式可知,装置b中总反应为,D正确。
2.(2023·广东卷,13)利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合,一段时间后
A.U型管两侧均有气泡冒出,分别是和
B.a处布条褪色,说明具有漂白性
C.b处出现蓝色,说明还原性:
D.断开,立刻闭合,电流表发生偏转
【答案】D
【解析】闭合,形成电解池,电解饱和食盐水,左侧为阳极,阳极氯离子失去电子生成氯气,电极反应为2Cl-—2e-=Cl2↑,右侧为阴极,阴极电极反应为2H++2e-=H2↑,总反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑。根据分析,U型管两侧均有气泡冒出,分别是和,A错误;左侧生成氯气,氯气遇到水生成HClO,具有漂白性,则a处布条褪色,说明HClO具有漂白性,B错误;b处出现蓝色,发生Cl2+2KI=I2+2KCl,说明还原性:,C错误;断开,立刻闭合,此时构成氢氯燃料电池,形成电流,电流表发生偏转,D正确。
3.(2023·广东卷,16)用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和,有利于电解反应顺利进行。下列说法不正确的是
A.电解总反应:
B.每生成,双极膜处有的解离
C.电解过程中,阳极室中的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
【答案】B
【解析】由信息大电流催化电解溶液制氨可知,在电极a处放电生成,发生还原反应,故电极a为阴极,电极方程式为,电极b为阳极,电极方程式为,“卯榫”结构的双极膜中的H+移向电极a,OH-移向电极b。由分析中阴阳极电极方程式可知,电解总反应为,A正确;每生成,阴极得8ml e-,同时双极膜处有8ml 进入阴极室,即有8ml的解离,B错误;电解过程中,阳极室每消耗4ml ,同时有4ml 通过双极膜进入阳极室,KOH的物质的量不因反应而改变,C正确;相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于被催化解离成和,可提高氨生成速率,D正确。
4.(2023·湖北卷,10)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是
A.b电极反应式为
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为
【答案】D
【解析】由图可知,该装置为电解水制取氢气的装置,a电极与电源正极相连,为电解池的阳极,b电极与电源负极相连,为电解池的阴极,阴极反应为2H2O+2e-=H2↑+2OH-,阳极反应为4OH--4e-=O2↑+2H2O,电池总反应为2H2O2H2↑+O2↑。b电极反应式为b电极为阴极,发生还原反应,电极反应为2H2O+2e-=H2↑+2OH-,A正确;该装置工作时阳极无Cl2生成且KOH浓度不变,阳极发生的电极反应为4OH--4e-=O2↑+2H2O,为保持OH-离子浓度不变,则阴极产生的OH-离子要通过离子交换膜进入阳极室,即离子交换膜应为阴离子交换摸,B正确;电解时电解槽中不断有水被消耗,海水中的动能高的水可穿过PTFE膜,为电解池补水,C正确;由电解总反应可知,每生成1mlH2要消耗1mlH2O,生成H2的速率为,则补水的速率也应是,D错误。
5.(2023·辽宁卷,7)某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A.b端电势高于a端电势B.理论上转移生成
C.电解后海水下降D.阳极发生:
【答案】D
【解析】由图可知,左侧电极产生氧气,则左侧电极为阳极,电极a为正极,右侧电极为阴极,b电极为负极,该装置的总反应产生氧气和氢气,相当于电解水。由分析可知,a为正极,b电极为负极,则a端电势高于b端电势,A错误;右侧电极上产生氢气的电极方程式为:2H++2e-=H2↑,则理论上转移生成,B错误;由图可知,该装置的总反应为电解海水的装置,随着电解的进行,海水的浓度增大,但是其pH基本不变,C错误;由图可知,阳极上的电极反应为:,D正确。
6.(2023·山东卷,11)利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
A.甲室电极为正极
B.隔膜为阳离子膜
C.电池总反应为:
D.扩散到乙室将对电池电动势产生影响
【答案】CD
【解析】向甲室加入足量氨水后电池开始工作,则甲室电极溶解,变为铜离子与氨气形成,因此甲室电极为负极,A错误;再原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,B错误;左侧负极是,正极是,则电池总反应为:,C正确;扩散到乙室会与铜离子反应生成,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,D正确。
7.(2023·浙江6月选考,13)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:
C.应选用阳离子交换膜,在右室获得浓度较高的溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
【答案】B
【解析】电极A是氯离子变为氯气,化合价升高,失去电子,是电解池阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得到电子,其电极反应式为:,B错误;右室生成氢氧根,应选用阳离子交换膜,左边的钠离子进入到右边,在右室获得浓度较高的溶液,C正确;改进设计中增大了氧气的量,提高了电极B处的氧化性,通过反应物的氧化性来降低电解电压,减少能耗,D正确。
8.(2023·浙江1月选考,11)在熔融盐体系中,通过电解和获得电池材料,电解装置如图,下列说法正确的是
A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:
C.该体系中,石墨优先于参与反应
D.电解时,阳离子向石墨电极移动
【答案】C
【解析】由图可知,在外加电源下石墨电极上C转化为CO,失电子发生氧化反应,为阳极,与电源正极相连,则电极A作阴极,和获得电子产生电池材料,电极反应为。在外加电源下石墨电极上C转化为CO,失电子发生氧化反应,为阳极,A错误;电极A的电极反应为,B错误;根据图中信息可知,该体系中,石墨优先于参与反应,C正确;电解池中石墨电极为阳极,阳离子向阴极电极A移动,D错误。
9.(2022·浙江6月选考,21)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e-MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
【答案】C
【解析】电极B上Mn2+转化为MnO2,锰元素化合价升高,失电子,则电极B为阳极,电极A为阴极,阴极得电子,发生还原反应,A正确;电极B上Mn2+失电子转化为MnO2,电极反应式为2H2O+Mn2+-2e-MnO2+4H+,B正确;电极A为阴极,LiMn2O4得电子,电极反应式为2LiMn2O4+6e-+16H+2Li++4Mn2++8H2O,依据得失电子守恒,电解池总反应为2LiMn2O4+4H+2Li++Mn2++3MnO2+2H2O,反应生成了Mn2+,电解过程中Mn2+浓度逐渐增大,C错误;通过调节溶液pH将Mn2+转化为Mn(OH)2沉淀除去,再加入Na2CO3溶液,将Li+转化为Li2CO3,D正确。
10.(2022·重庆卷,12)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是
A.惰性电极2为阳极
B.反应前后WO/WO数量不变
C.消耗1ml氧气,可得到1ml硝酮
D.外电路通过1ml电子,可得到1ml水
【答案】C
【解析】惰性电极2,Br-被氧化为Br2,惰性电极2为阳极,A正确;WO/WO循环反应,反应前后WO/WO数量不变,B正确;总反应为氧气把二丁基-N-羟基胺氧化为硝酮,1ml二丁基-N-羟基胺失去2mlH原子生成1ml硝酮,氧气最终生成水,根据氧原子守恒,消耗1ml氧气,可得到2ml硝酮,C错误;外电路通过1ml电子,生成0.5mlH2O2,H2O2最终生成水,根据氧原子守恒,可得到1ml水,D正确。
11.(2022·山东卷,13)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为
D.若甲室减少,乙室增加,则此时已进行过溶液转移
【答案】BD
【解析】由于乙室中两个电极的电势差比甲室大,所以乙室是原电池,甲室是电解池。电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,同时生成H+,电极反应式为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,H+通过阳膜进入阴极室,甲室的电极反应式为C2++2e-=C,因此,甲室溶液pH逐渐减小,A错误;对于乙室,正极上LiCO2得到电子,被还原为C2+,同时得到Li+,其中的O2-与溶液中的H+结合H2O,电极反应式为2LiCO2+2e-+8H+=2Li++2C2++4H2O,负极发生的反应为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,负极产生的H+通过阳膜进入正极室,但是乙室的H+浓度仍然是减小的,因此电池工作一段时间后应该补充盐酸,B正确;电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为:LiCO2+e-+4H+=Li++C2++2H2O,C错误;若甲室C2+减少200 mg,则电子转移物质的量为n(e-)= ;若乙室C2+增加300 mg,则转移电子的物质的量为n(e-)=,由于电子转移的物质的量不等,说明此时已进行过溶液转移,即将乙室部分溶液转移至甲室,D正确。
12.(2022·天津卷,11)实验装置如图所示。接通电源后,用碳棒(、)作笔,在浸有饱和NaCl溶液和石蕊溶液的湿润试纸上同时写字,端的字迹呈白色。下列结论正确的是
A.a为负极
B.端的字迹呈蓝色
C.电子流向为:
D.如果将、换成铜棒,与碳棒作电极时的现象相同
【答案】B
【解析】根据实验现象,a'端呈白色,即生成了氯气,即氯离子失去电子,为阳极,即a为正极,A错误;b'端为阴极,水得到电子放电的同时,生成氢氧根离子,遇石蕊变蓝,B正确;电子从电源的负极出来,即从a极出来,而不是b极,C错误;如果换成铜棒,铜做阳极放电,现象与碳作电极时不相同,D错误。
13.(2022·辽宁卷,9)如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取待测样品加入b容器中,接通电源,进行实验。下列说法正确的是
A.左侧电极反应:
B.实验结束时,b中溶液红色恰好褪去
C.若c中收集气体,则样品中乙酸浓度为
D.把盐桥换为U形铜导线,不影响测定结果
【答案】A
【解析】本装置为电解池,左侧阳极析出氧气,右侧阴极析出氢气。左侧阳极析出氧气,左侧电极反应:,A正确;右侧电极反应2CH3COOH+2e-=H2+2CH3COO-,反应结束时溶液中存在CH3COO-,水解后溶液显碱性,故溶液为红色,B错误;若c中收集气体,若在标况下,c中收集气体的物质的量为0.5×10-3ml,转移电子量为0.5×10-3ml×4=2×10-3ml,故产生氢气:1×10-3ml,则样品中乙酸浓度为:2×10-3ml ÷10÷10-3=,并且题中未给定气体状态不能准确计算,C错误;盐桥换为U形铜导线则不能起到传递离子使溶液呈电中性的效果,影响反应进行,D错误。
14.(2022·湖北卷,14)含磷有机物应用广泛。电解法可实现由白磷直接制备,过程如图所示(为甲基)。下列说法正确的是
A.生成,理论上外电路需要转移电子
B.阴极上的电极反应为:
C.在电解过程中向铂电极移动
D.电解产生的中的氢元素来自于
【答案】D
【解析】石墨电极发生反应的物质:P4→化合价升高发生氧化反应,所以石墨电极为阳极,对应的电极反应式为:,则生成,理论上外电路需要转移电子,A错误;阴极上发生还原反应,应该得电子,为阳极发生的反应, B错误;石墨电极:P4→发生氧化反应,为阳极,铂电极为阴极,应该向阳极移动,即移向石墨电极,C错误;由所给图示可知HCN在阴极放电,产生和,而HCN中的H来自,则电解产生的中的氢元素来自于,D正确。
15.(2022·河北卷,12)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如图。
下列说法正确的是
A.电极b为阳极
B.隔膜为阴离子交换膜
C.生成气体M与N的物质的量之比为2:1
D.反应器I中反应的离子方程式为4[Fe(CN)6]3—+4OH—4[Fe(CN)6]4—+O2↑+2H2O
【答案】BD
【解析】由图可知,a电极为阳极,碱性条件下[Fe(CN)6]4—离子在阳极失去电子发生氧化反应生成[Fe(CN)6]3—离子,催化剂作用下,[Fe(CN)6]3—离子与氢氧根离子反应生成[Fe(CN)6]4—离子、氧气和水,b电极为阴极,水分子作用下DHPS在阴极得到电子发生还原反应生成DHPS—2H和氢氧根离子,催化剂作用下,DHPS—2H与水反应生成DHPS和氢气,氢氧根离子通过阴离子交换膜由阴极室向阳极室移动,则M为氧气、N为氢气。由分析可知,b电极为电解池的阴极,A错误;氢氧根离子通过阴离子交换膜由阴极室向阳极室移动,则隔膜为阴离子交换膜,B正确;M为氧气、N为氢气,由得失电子数目守恒可知,氧气和氢气的的物质的量之比为1:2,C错误;反应器I中发生的反应为催化剂作用下,[Fe(CN)6]3—离子与氢氧根离子反应生成[Fe(CN)6]4—离子、氧气和水,反应的离子方程式为4[Fe(CN)6]3—+4OH—4[Fe(CN)6]4—+O2↑+2H2O,D正确。
16.(2022·海南卷,9)一种采用和为原料制备的装置示意图如下。
下列有关说法正确的是
A.在b电极上,被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中不断减少
【答案】A
【解析】由装置可知,b电极的N2转化为NH3,N元素的化合价降低,得到电子发生还原反应,因此b为阴极,电极反应式为N2+3H2O+6e-=2NH3+3O2-,a为阳极,电极反应式为2O2--4e-=O2。由分析可得,b电极上N2转化为NH3,N元素的化合价降低,得到电子发生还原反应,即N2被还原,A正确;a为阳极,若金属Ag作a的电极材料,则金属Ag优先失去电子,B错误;改变工作电源的电压,电流强度发生改变,反应速率也会改变,C错误;电解过程中,阴极电极反应式为N2+3H2O+6e-=2NH3+3O2-,阳极电极反应式为2O2-+4e-=O2,因此固体氧化物电解质中O2-不会改变,D错误。
17.(2022·北京卷,13)利用下图装置进行铁上电镀铜的实验探究。
下列说法不正确的是
A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:
C.随阴极析出,推测②中溶液减少,平衡逆移
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
【答案】C
【解析】由实验现象可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。实验①时,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,A正确;实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为,B正确;铜离子在阴极得到电子发生还原反应,在阴极析出铜,但阳极发生Cu-2e-=Cu2+的反应,铜离子浓度不变,平衡不移动,C错误;实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,D正确。
18.(2022·广东卷,10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中
A.阴极发生的反应为Mg-2e-Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
【答案】C
【解析】根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,从而使阳极区的Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生。阴极应该发生Al3+得电子的还原反应,A错误; Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝和镁失电子生成阳离子,还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
19.(2022·广东卷,11)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
【答案】D
【解析】将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中,会构成原电池,由于锌比铁活泼,所以锌作原电池的负极,而铁作正极,溶液中破损的位置会变大,当锌反应完,铁也会和酸化的氯化钠溶液反应产生氢气,溶液中会有亚铁离子生成。氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,故A不符合题意;淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质可与碘化钾发生反应,故B不符合题意; KSCN溶液可检测铁离子的存在,溶液中不会出现铁离子,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,故C不符合题意; K3[Fe(CN)6]是用于检测Fe2+的试剂,若铁片没有被腐蚀,则溶液中不会生成亚铁离子,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,故D符合题意。
20.(2021·天津卷,11)如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是
A.a是电源的负极
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,CuCl2溶液浓度变大
D.当完全溶解时,至少产生气体336mL (折合成标准状况下)
【答案】C
【解析】通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,说明石墨电极Ⅱ为阳极,则电源b为正极,a为负极,石墨电极Ⅰ为阴极。a是电源的负极,A正确;石墨电极Ⅱ为阳极,通电一段时间后,产生氧气和氢离子,所以向石墨电极Ⅱ附近滴加石蕊溶液,出现红色,B正确;随着电解的进行,铜离子在阴极得电子生成铜单质,所以CuCl2溶液浓度变小,C错误;当完全溶解时,消耗氢离子为0.06ml,根据阳极电极反应式,产生氧气为0.015ml,体积为336mL (折合成标准状况下),D正确。
21.(2021·江苏卷,12)通过下列方法可分别获得H2和O2:①通过电解获得NiOOH和H2(如图);②在90℃将NiOOH与H2O反应生成Ni(OH)2并获得O2。下列说法正确的是
A.电解后KOH溶液的物质的量浓度减小
B.电解时阳极电极反应式:Ni(OH)2+OH--e-=NiOOH+H2O
C.电解的总反应方程式:2H2O2H2↑+O2↑
D.电解过程中转移4ml电子,理论上可获得22.4LO2
【答案】B
【解析】阴极水电离的氢离子得电子生成氢气,阳极Ni(OH)2失电子生成NiOOH,电解过程总反应为,电解后KOH溶液的物质的量浓度不变,A错误;电解时阳极Ni(OH)2失电子生成NiOOH,电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,B正确;阴极水电离的氢离子得电子生成氢气,阳极Ni(OH)2失电子生成NiOOH,电解过程总反应为,C错误;电解过程中转移4ml电子,生成4mlNiOOH,根据,生成1ml氧气,非标准状况下的体积不一定是22.4L,D错误。
22.(2021·海南卷,9)液氨中存在平衡:。如图所示为电解池装置,以的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是
A.b电极连接的是电源的负极B.a电极的反应为
C.电解过程中,阴极附近K+浓度减小D.理论上两极产生的气体物质的量之比为1:1
【答案】B
【解析】根据图示可知:在b电极上产生N2,N元素化合价升高,失去电子,发生氧化反应,所以b电极为阳极,连接电源的正极,A错误;电极a上产生H2,H元素化合价降低得到电子,发生还原反应,所以a电极为阴极,电极反应式为:,B正确;电解过程中,阴极附近产生,使附近溶液中阴离子浓度增大,为维持溶液电中性,阳离子K+会向阴极区定向移动,最终导致阴极附近K+浓度增大,C错误;每反应产生1 ml H2,转移2 ml电子,每反应产生1 ml N2,转移6 ml电子,故阴极产生H2与阳极产生的N2的物质的量的比是3:1,D错误。
23.(2021·广东卷,16) 钴(C)的合金材料广泛应用于航空航天、机械制造等领域。图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 ml C,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:2C2++2H2O2C+O2↑+4H+
【答案】D
【解析】阳极是水放电,电极反应式为2H2O-4e-O2↑+4H+,Ⅰ室的H+经阳离子交换膜向Ⅱ室中移动,则工作时,Ⅰ室硫酸浓度增大,Ⅱ室H+浓度增大,Ⅰ室和Ⅱ室溶液的pH均减小,A项错误。生成1 ml C,则整个电路中转移2 ml电子,Ⅰ室溶液质量理论上减少1 ml O和2 ml H,共减少18 g,B项错误。移除两交换膜后,石墨电极上发生的反应是2Cl--2e-Cl2↑,C项错误。工作时,阳极是水放电,阴极是C2+放电,其电解总反应为2C2++2H2O2C+O2↑+4H+,D项正确。
24.(2021·辽宁卷,13)利用(Q)与(QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
【答案】C
【解析】由题干信息可知,M极发生的是由(Q)转化为(QH2)的过程,该过程是一个还原反应,故M极为阴极,电极反应式为+2H2O+2e-+2OH-,故与M极相连的a电极为负极,N极为阳极,电极反应式为-2e-+2H+,b极为电源正极。由分析可知,a为电源负极,A项正确;由分析可知,根据得失电子守恒可知,溶液中Q的物质的量保持不变,B项正确;由分析可知,整个过程CO2未被还原,CO2在M极发生反应CO2+OH-HCO3-,C项错误;由题干信息可知,M极上CO2发生反应CO2+OH-HCO3-被吸收,HCO3-向阳极移动,N极上发生反应HCO3-+H+H2O+CO2↑,故分离出的CO2从出口2排出,D项正确。
25.(2021·湖北卷,15)Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如图所示。下列说法错误的是
A.电解时只允许H+通过离子交换膜
B.生成O2和H2的质量比为8∶1
C.电解一段时间后阴极区溶液OH-的浓度增大
D.CrO3的生成反应为Cr2O72−+2H+2CrO3+H2O
【答案】A
【解析】左侧生成O2为阳极区,电极反应为2H2O-4e-4H++O2↑,导致阳极区H+浓度增大,Cr2O72−+2H+2CrO3+H2O,因此电解时H+不能通过离子交换膜,通过离子交换膜的是Na+,A项错误,D项正确;阴极区电极反应为2H2O+2e-2OH-+H2↑,根据得失电子守恒,由阳极反应和阴极反应,知生成O2和H2的物质的量之比为1∶2,生成O2和H2的质量比为8∶1,B项正确;阴极区电极反应为2H2O+2e-2OH-+H2↑,电解一段时间后阴极区溶液OH-的浓度增大,C项正确。
26.(2021·浙江1月选考,22)镍镉电池是二次电池,其工作原理示意图如下(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法不正确的是
图3
A.断开K2、合上K1,镍镉电池能量转化形式:化学能→电能
B.断开K1、合上K2,电极A为阴极,发生还原反应
C.电极B发生氧化反应过程中,溶液中KOH浓度不变
D.镍镉二次电池的总反应式:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2
【答案】C
【解析】A项,断开K2、合上K1,装置为原电池,能量转化形式为化学能→电能,正确;B项,断开K1、合上K2,则装置为电解池,电极A与电源负极相连,故电极A为阴极,阴极发生还原反应,正确;C项,电极B发生氧化反应,应为电解池阳极发生的反应,有元素化合价升高,失去电子,电极反应式为2Ni(OH)2+2OH――2e-2NiOOH+2H2O,电极A为阴极,得电子,电极反应式为Cd(OH)2+2e-Cd+2OH-,总反应为Cd(OH)2+2Ni(OH)2Cd+2NiOOH+2H2O,反应中生成水,KOH浓度降低,错误;D项,镍镉二次电池的总反应式为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,正确。
装置示意图
序号
电解质溶液
实验现象
①
0.1ml/LCuSO4
+少量H2SO4
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
②
0.1ml/LCuSO4
+过量氨水
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
专题一0 化学反应速率与化学平衡 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用): 这是一份专题一0 化学反应速率与化学平衡 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用),文件包含专题十化学反应速率与化学平衡原卷版docx、专题十化学反应速率与化学平衡解析版docx等2份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。
专题七 物质结构与性质综合题 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用): 这是一份专题七 物质结构与性质综合题 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用),文件包含专题七物质结构与性质综合题原卷版docx、专题七物质结构与性质综合题解析版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
专题五 常见无机物的性质、用途与转化 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用): 这是一份专题五 常见无机物的性质、用途与转化 -【真题汇编】2021-2023年高考化学真题分享汇编(全国通用),文件包含专题五常见无机物的性质用途与转化原卷版docx、专题五常见无机物的性质用途与转化解析版docx等2份试卷配套教学资源,其中试卷共44页, 欢迎下载使用。












