




黄金卷04-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用)
展开(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Fe 56 Ni 59
第Ⅰ卷
一、选择题:本题共16个小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.二十大报告指出,我国在一些关键核心技术实现突破,载人航天、探月探火、深海深地探测、超级计算机、卫星导航等领域取得重大成果。下列成果中所用材料属于合金的是
【答案】C
【解析】A.属于无机非金属材料,A错误;
B.BN陶瓷是新型陶瓷材料,属于无机非金属材料,B错误;
C.钛铝外壳属于合金材料,C正确;
D.氮化镓是化合物,不是合金材料,D错误;
故选C。
2.化学与科技、社会、文化、生活有着密切的联系。下列说法正确的是
A.纳米材料石墨烯被称为“黑金”,它属于有机高分子材料
B.利用潮汐发电,是将化学能转化为电能
C.“落红不是无情物,化作春泥更护花”,蕴藏着自然界的碳、氮循环
D.可做为漂白剂、防腐剂、强氧化剂使用
【答案】C
【解析】A.石墨烯是由碳元素形成的碳单质,是新型无机非金属材料,故A错误;
B.潮汐发电是利用潮汐能,其不属于化学变化,故B错误;
C.“落红不是无情物,化作春泥更护花”中落红是指花瓣,花瓣中含有C、H、O、N等化学元素,其掉落到土壤中被其它植物吸收是自然界的碳、氮循环,故C正确;
D.SO2可作为漂白剂和防腐剂以及还原剂,其不具备强氧化性,故D错误;
故选C。
3.2022年11月29日神舟十五号载人飞船发射成功,搭载该飞船使用的长征二号F遥十五运载火箭用偏二甲肼作燃料,作氧化剂。下列化学用语正确的是
A.该反应的化学方程式:
B.二氧化碳的空间填充模型:
C.偏二甲肼的结构简式:
D.水的电子式:
【答案】D
【解析】A.偏二甲肼作燃料,作氧化剂,两者发生氧化还原反应生成氮气和二氧化碳、水,该反应的化学方程式:,A错误;
B.碳原子半径大于氧,二氧化碳的空间填充模型:,B错误;
C.偏二甲肼的结构简式: ,C错误;
D.水是由氢氧构成的共价化合物,电子式: ,D正确;
故选D。
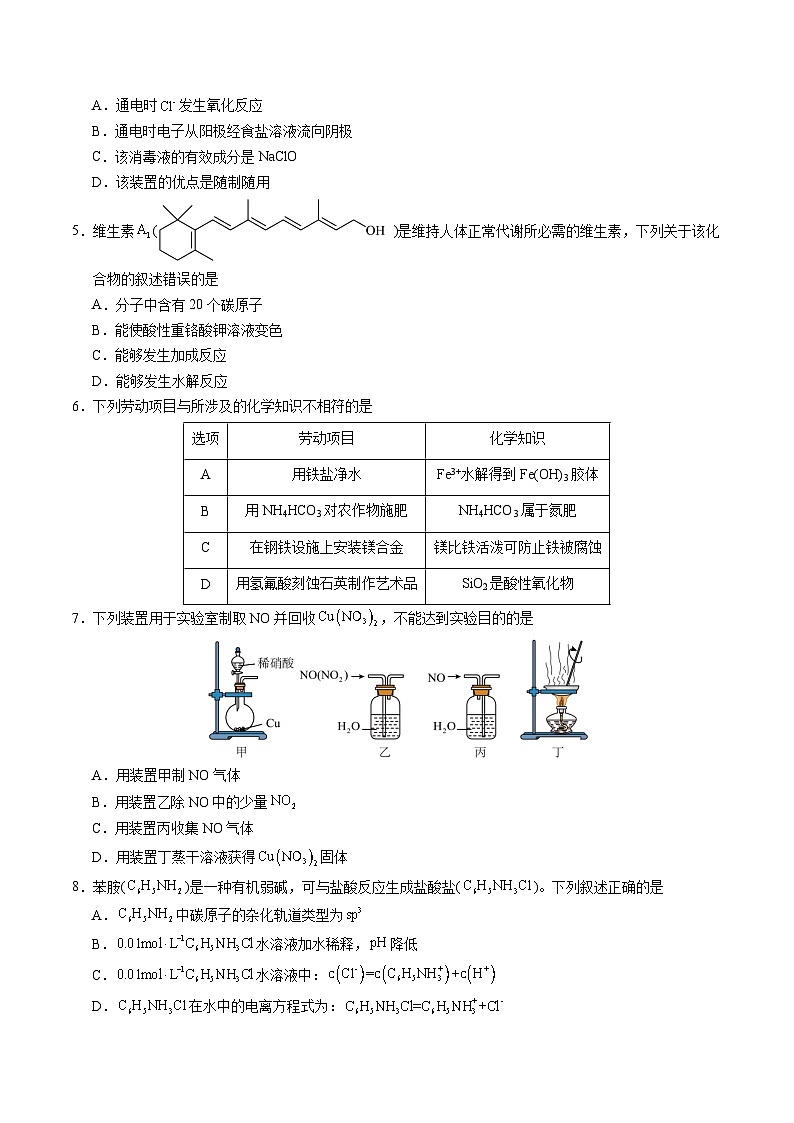
4.某学生设计了一种家用消毒液发生器,装置如图如示。下列说法错误的是
A.通电时发生氧化反应B.通电时电子从阳极经食盐溶液流向阴极
C.该消毒液的有效成分是NaClOD.该装置的优点是随制随用
【答案】B
【解析】A.通电时Cl-的化合价由-1变为0,Cl-发生氧化反应生成氯气,A正确;
B.溶液中只有阴阳离子没有电子,电子不能经过电解质溶液,B错误;
C.电解食盐溶液会生成氯气、氢气和氢氧化钠,氯气与氢氧化钠反应生成次氯酸钠,故有效成分为是次氯酸钠,C正确;
D.该装置的优点是随制随用,以防旧制的次氯酸钠分解失效,D正确;
答案选B。
5.维生素( )是维持人体正常代谢所必需的维生素,下列关于该化合物的叙述错误的是
A.分子中含有20个碳原子
B.能使酸性重铬酸钾溶液变色
C.能够发生加成反应
D.能够发生水解反应
【答案】D
【解析】A.在键线式结构中,线段的起点、拐点、终点都表示碳原子,在六元环 上,有9个C原子,在 结构中,有11个C原子,所以分子中含有20个碳原子,A正确;
B.该有机化合物结构中含有的碳碳双键和醇羟基,都能被酸性重铬酸钾溶液氧化,从而使重铬酸钾溶液褪色,B正确;
C.该有机化合物结构中含有碳碳双键,能够与H2、Br2、H2O等发生加成反应,C正确;
D.该有机化合物中不含有能发生水解反应的酯基、卤原子、肽键、多糖等结构,D错误;
故选D。
6.下列劳动项目与所涉及的化学知识不相符的是
【答案】D
【解析】A.用铁盐净水是由于铁盐电离产生的Fe3+发生水解反应产生Fe(OH)3胶体,Fe(OH)3胶体表面积大,吸附力强,可以吸附水中悬浮的固体小颗粒,使之形成沉淀,从而具有净水作用,A正确;
B.NH4HCO3易溶于水,能电离产生,中含有植物需要的营养元素氮元素,因此可以对农作物施肥,NH4HCO3属于氮肥,B正确;
C.在被保护的金属上连接一种更活泼的金属,被保护的金属作原电池的正极,活泼的金属为负极,首先被氧化腐蚀,这种保护金属的方法称为牺牲阳极的阴极保护法,因此通常是在被保护的钢铁设备上安装若干镁合金或者锌块,C正确;
D.用氢氟酸刻蚀石英制作艺术品,是由于玻璃中含有的SiO2能够与氢氟酸中的HF反应产生SiF4气体和水,因此用于玻璃的雕刻,这与SiO2是酸性氧化物无关,D错误;
故合理选项是D。
7.下列装置用于实验室制取NO并回收,不能达到实验目的的是
A.用装置甲制NO气体B.用装置乙除NO中的少量
C.用装置丙收集NO气体D.用装置丁蒸干溶液获得固体
【答案】D
【解析】A.Cu与稀硝酸在常温下发生氧化还原反应产生Cu(NO3)2、NO、H2O,因此可以用装置甲制NO气体,A不符合题意;
B.二氧化氮和水生成一氧化氮,能除去NO中的少量,B不符合题意;
C.NO气体在常温下容易与空气中的O2反应产生NO2气体,因此应该根据NO不溶于水,也不能与水发生反应,采用排水方法收集NO气体,C不符合题意;
D.Cu(NO3)2溶液加热时会促进铜离子水解,且生成硝酸易挥发,应根据其溶解度受温度的影响变化较大,采用冷却结晶法制备Cu(NO3)2·6H2O,D符合题意;
故选D。
8.苯胺()是一种有机弱碱,可与盐酸反应生成盐酸盐()。下列叙述正确的是
A.中碳原子的杂化轨道类型为
B.水溶液加水稀释,降低
C.水溶液中:
D.在水中的电离方程式为:
【答案】D
【解析】A.苯环内碳原子都采用sp2杂化,A错误;
B.盐酸盐()属于强酸弱碱盐,水解显酸性,加水稀释,水解程度增大,但由于溶液被稀释,H+浓度减小,增大,B错误;
C.水溶液中存在电荷守恒:,C错误;
D.盐酸盐()在水中完全电离,电离方程式为:,D正确;
故选D。
9.常温下,下列各组离子在指定溶液中能大量共存的是
A.含有FeCl2的溶液中:、H+、K+、Ca2+
B.中性溶液中:Fe3+、、、
C.澄清透明溶液中:Cu2+、、Cl-、Mg2+
D.的溶液中:、Na+、OH-、S2-
【答案】C
【解析】A.含有FeCl2的溶液中,Fe2+、、H+会发生氧化还原反应,在水溶液中不能大量共存,故A不符合题意;
B.Fe3+在pH=4.4时已经沉淀完全,中性溶液中不能大量存在Fe3+、和之间会发生双水解反应,在水溶液中不能大量共存,故B不符合题意;
C.Cu2+、、Cl-、Mg2+之间不发生化学反应,在水溶液中可以大量共存,故C符合题意;
D.常温下,Kw=c(H+)c(OH-)=10-14,,则c(OH-)=10-13ml/L,c(H+)=10-1ml/L,c(H+)>c(OH-),溶液显酸性,酸性条件下,、OH-、S2-与H+会发生反应生成Al(OH)3或Al3+、水、HS-或硫化氢,在溶液中不能大量共存,故D不符合题意;
答案选C。
10.硝酸厂利用下图将NOx转化为无污染气体。下列有关说法正确的是
A.N2的电子式为
B.H2O的结构式为H-O-H
C.过程Ⅱ中NOx发生氧化反应
D.转化过程中Ce4+/Ce3+会被不断消耗
【答案】B
【分析】由图可知反应经过两个过程:Ⅰ、H2+2Ce4+=2Ce3++2H+,Ⅱ、4xCe3++4xH++2NOx=4xCe4++N2+2xH2O,总反应为2xH2+2NOx2xH2O+N2。
【解析】A.N2中两个N形成3对共用电子对,其电子式为,A错误;
B.H2O分子之间形成2个H-O键,其结构式为H-O-H,B正确;
C.过程Ⅱ中NOx转化为N2和H2O,N元素化合价降低,被还原,发生还原反应,C错误;
D.由反应过程和总反应可知,Ce4+为该反应的催化剂,转化过程中Ce4+/Ce3+不会被消耗,D错误;
答案选B。
11.2021年,我国科学家首次在实验室实现到淀粉的全合成,其合成路线如下:设为阿伏加德罗常数,下列有关说法不正确的是
A.标况下,11.2L 中含有共用电子对数目为2
B.反应②、③无法在高温下进行
C.反应②中,3.2g 生成HCHO时转移电子数目为0.2
D.1ml DHA与乙酸发生取代反应,可消耗乙酸分子数目为
【答案】D
【解析】A.的结构式为O=C=O,标况下11.2L 中含有共用电子对数目为,故A正确;
B.反应②、③需要用酶作2催化剂,反应②、③无法在高温下进行,故B正确;
C.反应②中,3.2g 生成HCHO时转移电子数目为,故C正确;
D.DHA含有2个羟基,1ml DHA与乙酸发生取代反应,可消耗2ml乙酸,故D错误;
选D。
12.实验探究是化学学科的魅力所在。下列有关实验操作、现象和结论均正确的是
【答案】D
【解析】A.向平衡体系2NO2N2O4中加压,NO2浓度增大,气体颜色先变深,后又因2NO2N2O4的平衡正向移动,颜色逐渐变浅,因此现象应为气体颜色先变深后变浅,故A错误;
B.加入稀硫酸使淀粉水解后,应在碱性环境下检验葡萄糖,即应先加过量的NaOH中和稀硫酸,再加入新制Cu(OH)2悬浊液,故B错误;
C.根据金属单质与水或酸反应置换出氢的难易判断金属性的强弱,与NaOH是否反应不能作为判断金属性强弱的依据,故C错误;
D.向海带灰的浸取液中滴加适量氯水,再加入CCl4萃取,溶液分层,下层出现紫红色,说明生成了I2,从而证明海带中含有碘元素,故D正确;
答案选D。
13.已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是
A.化合物为含有非极性共价键的离子化合物
B.简单离子半径:
C.X、Z和O形成的盐溶液XZO呈酸性
D.电负性:Y>Z
【答案】A
【解析】W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液的浓度均为0.01ml•L−1,其中X的pH=12,属于一元强碱,且X的原子半径最大,则X为Na;W、Z的pH均为2,说明是一元强酸,原子序数和原子半径均满足Z>W,则Z为Cl,W为N元素;Y的pH<2,应该为二元强酸,Y的原子半径大于Cl,则Y为S元素,以此分析解答。
A.为Na2S2,和Na+之间形成离子键,中S原子之间含有非极性共价键,故A正确;
B.离子的核外电子层结构相同时,核电荷数越大离子半径越小,电子层数越多离子半径越大,则简单离子半径大小为:S2−>Cl−>N3−>Na+,即Y>Z>W>X,故B错误;
C.XZO为NaClO,ClO-水解呈碱性,故C错误;
D.氯的电负性大于硫,故D错误;
故答案选A。
14.下列过程涉及的离子方程式正确的是
A.泡沫灭火器的工作原理:Al3++3HCO=Al(OH)3↓+3CO2↑
B.用纯碱溶液吸收海水提溴时吹出的Br2:3Br2+6OH-=5Br-+BrO+3H2O
C.用石灰乳与浓缩的海水制备氢氧化镁:Mg2++2OH-=Mg(OH)2↓
D.用稀硝酸鉴别铜合金制成的假金币:Cu+4H++NO=Cu2++NO2↑+2H2O
【答案】A
【解析】A.泡沫灭火器中的硫酸铝和碳酸氢钠溶液发生水解反应,最终生成氢氧化铝和二氧化碳,离子方程式为:Al3++3HCO=Al(OH)3↓+3CO2↑,故A正确;
B.Na2CO3溶液与吹出的Br2反应生成物有溴化钠、溴酸钠和二氧化碳,反应的离子方程式为3+3Br2=5Br-++3CO2↑,故B错误;
C.石灰乳为氢氧化钙乳浊液,与浓缩的海水反应的离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,故C错误;
D.稀硝酸与铜反应生成硝酸铜、一氧化氮和水:3Cu+8H++2NO=3Cu2++2NO↑+4H2O,故D错误;
故选A。
15.氨气在工业上应用广泛,已知反应 ,反应相同时间,的体积百分数随温度的变化情况如图所示,下列相关描述正确的是
A.线上的点均代表平衡时刻的点B.逆反应速率:
C.b点时D.平衡常数值:
【答案】D
【解析】由图可知,c点氨气的体积百分数最大,说明反应达到平衡,则c点以前为平衡的形成过程,c点以后为平衡的移动过程。
A.由分析可知,c点以前均未达到平衡,故A错误;
B.温度越高,反应速率越快,则d点逆反应速率大于a点,故B错误;
C.由分析可知,b点反应未达到平衡,正反应速率大于逆反应速率,故C错误;
D.该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,由分析可知,c点以后为平衡的移动过程,则c点平衡常数大于d点,故D正确;
故选D。
16.我国科学家利用电池,以水溶液作为锌离子电池的介质,可实现快速可逆的协同转化反应。如图所示,放电时该电池总反应为:。下列说法正确的是
A.放电时,为负极,发生氧化反应
B.放电时,参与反应,转移
C.充电时,通过阳离子交换膜从极移向极
D.充电时,阳极发生反应:
【答案】D
【解析】A.由总反应可知,放电时,Zn为负极,发生氧化反应,故A错误;
B.由总反应可知,反应时生成2mlBi,转移6ml电子,参与反应,转移,故B错误;
C.充电时,Zn电极作阴极,极作阳极,溶液中阳离子向阴极移动,则通过阳离子交换膜从极移向极,故C错误;
D.充电时的总反应为:,阳极发生反应:,故D正确;
故选:D。
第Ⅱ卷
二、非选择题:本题共4个小题,共56分。
17.(14分)某学习小组发现溶液呈绿色,与溶液颜色不一样,于是对溶液呈绿色的原因展开了研究。回答下列问题:
查阅资料:在溶液中存在如下平衡:
提出假设:溶液呈绿色的原因是其溶液中既有黄色的又有蓝色的,根据光学原理蓝色和黄色的混合色为绿色。
(1)配制100 mL 0.5溶液,需要称量_______g(保留4位有效数字),先将溶解在较浓的盐酸中再加水稀释的原因是_____________________________________。
(2)设计方案并完成实验:
限选实验试剂和仪器:0.5 溶液、蒸馏水、饱和溶液、饱和NaCl溶液、饱和溶液、恒温水浴槽、试管等。
①实验Ⅰ、Ⅱ的目的是_______________________________。
②根据表中信息,补充数据:a=_______;从浓度商与平衡常数的相对大小的角度定量分析实验Ⅳ中溶液颜色为绿色而Ⅴ中溶液颜色为蓝绿色的原因:_______________________(写出推导过程)。
③与实验Ⅴ相对比,实验Ⅶ探究_____________对溶液颜色的影响。
④根据表中信息,推测b_______25℃(填“>”“=”或“<”)。
实验结论:假设成立。
【答案】(每空2分)
(1)8.550 抑制水解
(2)①同阴离子的溶液对照,说明蓝色和绿色不是由这些阴离子导致的(或说明这些阴离子是无色的)
②2.0 Ⅳ→Ⅴ,加水稀释使溶液浓度变为原来的一半,由,可知,实验Ⅴ中的平衡正向移动,溶液颜色由绿色变为蓝绿色 ③的浓度 ④>
【解析】(1),。根据可知,在酸中稀释是提高引起水解平衡逆向移动,从而抑制水解;
(2)①实验Ⅰ、Ⅱ具有相同的温度和颜色,仅阴离子浓度不同,故为不同阴离子的溶液对照,与研究目的相联系说明阴离子是不具有颜色的,或者说明蓝色和绿色不是由这些阴离子导致的。②观察表格实验组对照发现25℃下只有实验Ⅳ和Ⅴ在上有不同数据,故实验目的是探究与溶液颜色关系,需要保持其他变量相同,仅取样不同,则需要水的体积为4.0 mL-2.0 mL=2.0 mL;实验Ⅳ加水稀释使溶液浓度变为原来的一半,即是实验Ⅴ,结合实验目的和题干平衡信息,列出浓度商表达式并代入减半浓度得:,可得,实验V中的平衡正向移动,溶液颜色由绿色变为蓝绿色。
③将实验Ⅶ与实验Ⅴ进行对比可知,选择相同温度、相同浓度、相同体积的溶液,实验Ⅶ中另加入,使得的浓度大于实验Ⅴ的,故此问应为的浓度。
④此问考查温度对平衡的影响,结合平衡中焓变信息可知,将实验Ⅷ与实验Ⅳ对照,离子颜色从绿色变为黄绿色是平衡逆向移动,对放热反应而言是温度升高,故应填“>”。
18.(14分)金属钴、镍作为重要的战略资源,有“工业味精”之称,工业上利用红土镍矿(主要成分为Ni、C、Fe、Al、Si等元素的氧化物)生产中间品MSP(硫化钴镍),并利用MSP进一步生产NiSO4的流程如图。
已知:
i.几种金属离子开始沉淀和沉淀完全的pH如下表所示:
ii.氧化前后,溶液中Ni、C元素的化合价均为+2价。
回答下列问题:
(1)“加压浸出”时,滤渣I的主要成分为____________(填化学式)。
(2)“氧化”时,加入NaClO3的目的是______________________________(用离子方程式表示),NaClO3中阴离子的空间结构为__________________。
(3)“中和”时,应控制的pH范围是___________。
(4)Cyanex272(RH)是一种有机萃取剂,其作用原理为nRH+Mn2+RnM+nH+(Mn+表示金属阳离子),从“含钴负载有机相”中重新获取Cyanex272的方法是_______________________。
(5)工业上利用电解NiSO4溶液制备Ni的同时可获得较浓的硫酸,电解装置如图所示,离子交换膜M为___________(填“阳”或“阴”)离子交换膜,阳极反应式为_____________________________。
(6)NiSO4在一定条件下分解可得到镍的某种氧化物,其晶胞如图所示。该晶体中与O距离最近且相等的Ni的个数为___________。已知晶胞内Ni和O的最短距离为apm,设NA为阿伏加德罗常数的值,则该晶体的密度为___________g•cm-3。
【答案】(1)SiO2(1分)
(2)6H++6Fe2++ClO=6Fe3++3H2O+Cl-(2分) 三角锥形(1分)
(3)4.5≤pH<6.9(2分)
(4)往“含钴负载有机相”中加入稀硫酸,转移至分液漏斗中,振荡,静置,分液(2分)
(5)阴(1分) 2H2O-4e-=4H++O2↑(2分)
(6)6(1分) ×1030(2分)
【解析】红土镍矿主要成分为Ni、C、Fe、Al、Si等元素的氧化物,加入硫酸加压浸出,Ni、C、Fe、Al的氧化物溶解生成硫酸盐,二氧化硅和稀硫酸不反应,“氧化”加入NaClO3的目的是将Fe2+氧化为Fe3+,加入石灰石浆中和,除去Fe3+和Al3+,过滤,加入H2S沉淀Ni2+和C2+,生成MSP(硫化钴镍),酸化,萃取,将Ni和C分离。
(1)加入硫酸加压浸出,Ni、C、Fe、Al的氧化物溶解,二氧化硅和稀硫酸不反应,因此滤渣I的主要成分为SiO2。
(2)“氧化”加入NaClO3的目的是将Fe2+氧化为Fe3+,离子方程式为:6H++6Fe2++ClO=6Fe3++3H2O+Cl-,中心原子Cl的孤电子对数为,价层电子对数为3+1=4,则Cl采取sp3杂化,因此空间结构为三角锥形。
(3)“中和”是为了除去Fe3+和Al3+,为了保证Fe3+和Al3+完全沉淀,而Ni2+和C2+不沉淀,pH范围应该为4.5≤pH<6.9。
(4)有机萃取剂Cyanex272(RH)萃取钴离子的方程式为2RH+C2+R2 C +2H+,想要得到Cyanex272,需要反应逆向进行,因此可以向含钴负载有机相中加入盐酸。
(5)该电解装置通过电解NiSO4溶液制备Ni的同时可获得较浓的硫酸,则右侧电极为阴极,发生反应为Ni2++2e-=Ni,左侧为阳极,反应为2H2O-4e-=4H++O2↑,要生成硫酸,则右室的向左室移动,离子交换膜M为阴离子交换膜。
(6)由晶胞结构图可知,该晶体中与O距离最近且相等的Ni的个数为6。
已知晶胞内Ni和O的最短距离为apm,则晶胞边长为2apm,一个晶胞中Ni的个数为,O的个数为,则该晶体的化学式为NiO,则该晶体的密度为×1030g•cm-3。
19.(14分)N2O是《联合国气候变化框架公约》所列六种温室气体之一。目前,直接催化分解法是消除N2O的主要方法,该过程中发生的反应如下:
i.2N2O(g)2N2(g)+O2(g) ΔH1
ii.2N2O(g)N2(g)+2NO(g) ΔH2
iii.4N2O(g)3N2(g)+2NO2(g) ΔH3
回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g)2NO2(g)的ΔH=____________ (写出代数式即可)。
(2)已知反应i在任意温度下均能自发进行,则反应i为____________ (填“吸热”或“放热”)反应。
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):
①过程Ⅲ中最大势能垒(活化能)为________________kcal·ml-1。
②下列有关反应i的说法不正确的是_____________ (填标号)。
A.过程Ⅰ中有极性键断裂
B.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅱ中间体A—O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为________________m3·h-1。欲提高N2O的转化率,可采取的措施为________________________________ (任写一条)。
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
其中x=____________,N2O的平衡转化率为__________________ (保留三位有效数字);该温度下,反应2N2O(g)2N2(g)+O2(g)的压强平衡常数Kp=____________kPa(以分压表示,分压=总压×物质的量分数)。
【答案】(1)ΔH3-ΔH1-ΔH2(2分)
(2)放热(1分)
(3)①82.17(1分) ②C(1分)
(4)①960(1分) 减压(或升温、将废气缓慢通过催化剂等)(2分)
②1(2分) 97.1%(2分) 500p(2分)
【解析】(1)i.2N2O(g)2N2(g)+O2(g) ΔH1
ii.2N2O(g)N2(g)+2NO(g) ΔH2
iii.4N2O(g)3N2(g)+2NO2(g) ΔH3
根据盖斯定律,将iii-i-ii得:反应2NO(g)+O2(g)2NO2(g)的ΔH=ΔH3-ΔH1-ΔH2。
(2)已知反应i在任意温度下均能自发进行,则表明反应i为任意条件下的自发反应,其∆S>0,则∆H<0,所以该反应为放热反应。
(3)①过程Ⅲ中最大势能垒(活化能)为活化分子的最高能量与分子平均能量的差值,即为37.49 kcal·ml-1-(-44.68 kcal·ml-1)= 82.17kcal·ml-1。
②A.过程Ⅰ中,N2O转化为N2等,断裂为氮氧共价键,其为极性键,A正确;B.从图中可以看出,过程Ⅰ、Ⅱ、Ⅲ中都有N2生成,B正确;C.从图中可以看出,A、A-O、A-O2都能吸附N2O,所以该反应中有三种物质能够吸附N2O分子,C不正确;D.从图中看出, A-O2在过程Ⅱ中转化为A,从而释放出O2,在过程Ⅲ中吸附N2O分子,D正确;故选C。
(4)①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为6000m3·h-1×40%×40%=960m3·h-1。由于反应为气体分子数增大的分解反应,所以欲提高N2O的转化率,可采取的措施为:减压(或升温、将废气缓慢通过催化剂等)。
②利用表中数据,可建立以下三段式:
由分析可得出,其中x=1,N2O的平衡转化率为;该温度下,反应2N2O(g)2N2(g)+O2(g)的压强平衡常数Kp=kPa ==500p kPa。
20.(14分)化合物Ⅸ是合成一种新型多靶向抗肿瘤药物的中间体,其合成路线流程图如下:
回答下列问题:
(1)写出化合物Ⅰ的名称________,化合物Ⅰ→Ⅱ的反应类型____________。
(2)化合物Ⅲ由C、H、O三种原子组成,结构简式为________________。
(3)化合物Ⅳ分子结构中的含氧官能团有________ (填名称)。
(4)化合物Ⅴ在酸性下水解,有一种产物能在一定条件下自身聚合形成高聚物。形成该高聚物的反应方程式为_______________________________________。
(5)化合物X是V的同系物,其相对分子质量比V小28,化合物X同时满足如下条件的同分异构体有_____________种。
①苯环上有两种取代基,且能与溶液发生显色反应;
②能与溶液反应生成气体。
这些同分异构体中满足核磁共振氢谱峰面积比为6∶2∶2∶1∶1的结构简式_______________。
(6)根据上述信息,写出以苯乙烯( )与化合物Ⅶ为主要原料合成有机物 的路线流程。
【答案】(1)4-溴苯甲酸(对溴苯甲酸)(1分) 取代反应(1分)
(2)CH≡CCH2CH2OH(1分)
(3)羟基、酯基(2分)
(4)n+(n-1)H2O(2分)
(5)15(2分) (2分)
(6) (3分)
【解析】I到II在羧基上发生了酯化反应;II与III生成了IV,对比结构简式,III为CH≡CCH2CH2OH;IV与氢气反应,碳碳三键发生了加成反应得到V;V在NaClO和KBr,NaHCO3作用下生成VI,醛基被氧化,并且发生了溴原子的取代反应;VI与VII在醋酸钠存在下发生反应得到VIII,VIII中酯基水解得到了IX。
(1)化合物I的名称为4-溴苯甲酸(对溴苯甲酸);I与甲醇在浓硫酸加热条件下发生酯化反应;
(2)对比II和IV的结构简式,III仅含C、H、O三种元素,III的结构简式为:CH≡CCH2CH2OH;
(3)化合物IV中的含氧官能团为:羟基、酯基;
(4)化合物V在酸性条件下水解,水解产物为 和甲醇, 在一定条件下可以发生缩聚反应生成聚酯,化学方程式为:n+(n-1)H2O;
(5)化合物X是V的同系物,其相对分子质量比V小28,化合物X比V少两个CH2,X苯环上有两种取代基,且能与FeCl3溶液发生显色反应,说明含有酚羟基,能与NaHCO3溶液反应生成CO2气体,说明含有羧基,满足条件的同分异构体的结构简式:两个取代基为对位时,共有 、 、 、 、5种;同理,两个取代基为邻位和间位各有5种,共15种;核磁共振氢谱峰面积比为6∶2∶2∶1∶1,即有5种不同化学环境的氢原子,且氢原子个数比为6∶2∶2∶1∶1,满足条件的结构简式为 ;
(6)苯乙烯与水生成 ,参照题中制备路线, 在NaClO和KBr,NaHCO3作用下生成 , 与VII在醋酸钠作用下即可得到产物,故合成路线为: 。
A.天问一号用的SiO2气凝胶
B.天和核心舱用的BN陶瓷
C.“奋斗者”号潜水艇的钛铝外壳
D.北斗导航卫星的太阳能电池用的氮化镓
选项
劳动项目
化学知识
A
用铁盐净水
Fe3+水解得到Fe(OH)3胶体
B
用NH4HCO3对农作物施肥
NH4HCO3属于氮肥
C
在钢铁设施上安装镁合金
镁比铁活泼可防止铁被腐蚀
D
用氢氟酸刻蚀石英制作艺术品
SiO2是酸性氧化物
选项
实验操作
实验现象
结论
A
向平衡体系2NO2N2O4中加压
红棕色变浅
平衡正向移动
B
向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
溶液中未观察到砖红色沉淀产生
淀粉没有水解
C
将大小相同的Al和Mg分别投入到相同浓度的NaOH溶液中
Al溶解有气泡产生,Mg无现象
Al的金属性强于Mg
D
向海带灰的浸取液中滴加适量氯水,再加入CCl4萃取
分层,下层出现紫红色
海带中含有碘元素
序号
温度/℃
V(0.5)/mL
V(饱和)/mL
V(饱和)/mL
V(饱和NaCl)/mL
/mL
溶液颜色
Ⅰ
25
/
/
4.0
/
/
无色
Ⅱ
25
/
/
/
4.0
/
无色
Ⅲ
25
/
4.0
/
/
/
蓝色
Ⅳ
25
4.0
/
/
/
/
绿色
Ⅴ
25
2.0
/
/
/
a
蓝绿色
Ⅵ
25
2.0
2.0
/
/
/
蓝绿色
Ⅶ
25
2.0
/
/
2.0
/
黄绿色
Ⅷ
b
4.0
/
/
/
/
黄绿色
全属离子
Fe3+
Fe2+
Al3+
Ni2+
C2+
开始沉淀的pH
2.3
7.0
3.1
6.9
7.1
沉淀完全的pH
3.7
9.0
4.5
8.9
9.1
物质
N2
N2O
O2
CO2
NO
NO2
n(投料)/ml
19
34
6.5
25
0
0
n(平衡)/ml
50
x
20
25
2
2
黄金卷07-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用): 这是一份黄金卷07-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用),文件包含黄金卷07-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用解析版docx、黄金卷07-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用考试版docx、黄金卷07-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用参考答案docx等3份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
黄金卷05-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用): 这是一份黄金卷05-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用),文件包含黄金卷05-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用解析版docx、黄金卷05-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用考试版docx、黄金卷05-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用参考答案docx等3份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
黄金卷03-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用): 这是一份黄金卷03-【赢在高考·黄金8卷】备战2024年高考化学模拟卷(广东专用),文件包含黄金卷03-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用解析版docx、黄金卷03-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用考试版docx、黄金卷03-赢在高考·黄金8卷备战2024年高考化学模拟卷广东专用参考答案docx等3份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。












