




第17讲 铝、镁及其化合物-2024年高考化学大一轮复习课件(新教材)
展开1.了解镁、铝及其重要化合物的存在、性质和用途。2.掌握工业提取铝、镁的一般方法。
考点一 铝及其化合物
考点二 镁 海水提镁
考点一 铝 及 其 化 合 物
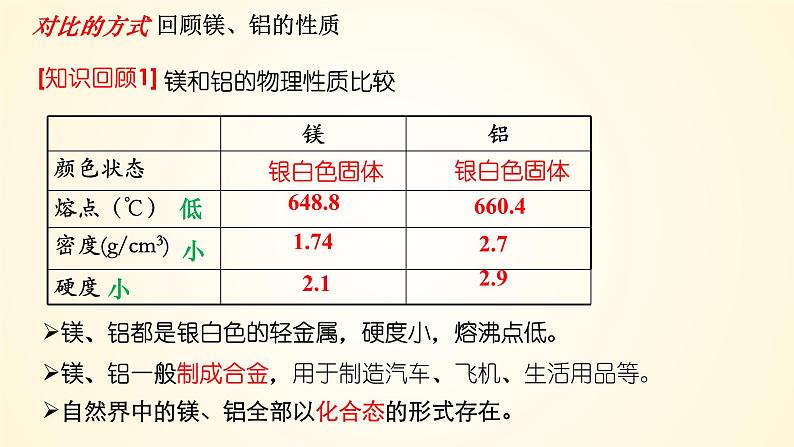
镁、铝都是银白色的轻金属,硬度小,熔沸点低。
镁、铝一般制成合金,用于制造汽车、飞机、生活用品等。
自然界中的镁、铝全部以化合态的形式存在。
对比的方式 回顾镁、铝的性质
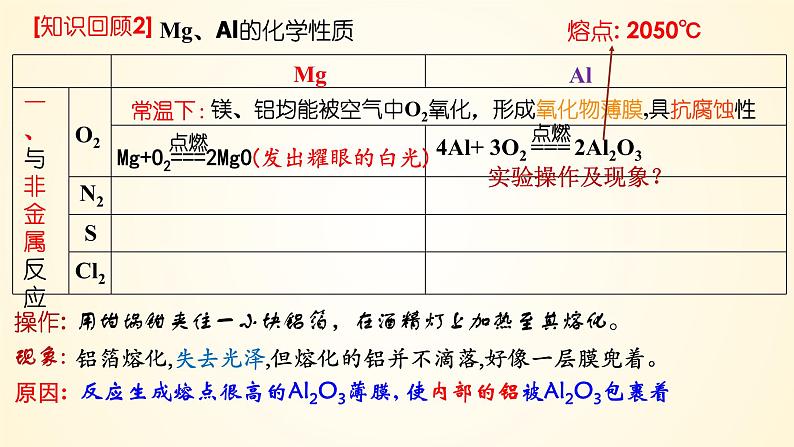
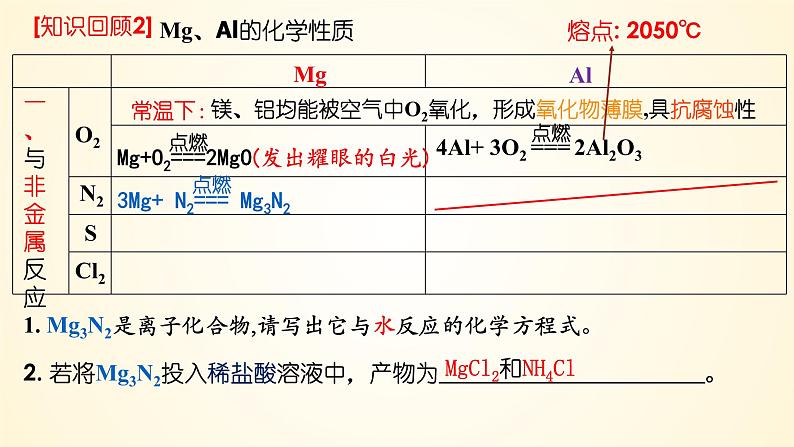
镁、铝均能被空气中O2氧化,形成氧化物薄膜,具抗腐蚀性
用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化。
铝箔熔化,失去光泽,但熔化的铝并不滴落,好像一层膜兜着。
反应生成熔点很高的Al2O3薄膜, 使内部的铝被Al2O3包裹着
1. Mg3N2是离子化合物,请写出它与水反应的化学方程式。
2. 若将Mg3N2投入稀盐酸溶液中,产物为 。
MgCl2和NH4Cl
注意:Al2S3只在干态下生成,遇水发生双水解
Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑
除氧化膜后可与沸水微弱反应
铝和金属氧化物在高温下剧烈反应生成另一种金属,并放出大量热的化学反应。
2Al+6H2O=2Al(OH)3+3H2↑
镁着火不能用干粉灭火器和泡沫灭火器灭火
知识回顾: 铝热反应
剧烈反应,发出强光,纸漏斗被烧穿,沙子上落有红热的铁珠
2.镁条的作用是什么?3.氯酸钾的作用是什么?
(如Fe2O3 、V2O5、Cr2O3 、MnO2等)
1.引发该铝热反应的操作为 。
在铝热剂上加少量KClO3,插上镁条,并将其点燃
试写出铝分别与Fe3O4、MnO2、Cr2O3、V2O5发生的铝热反应
铝热反应在生产上的应用①用于焊接钢轨等;②冶炼铁、钒、铬、锰、镍等熔点高的金属。
说明: 铝只能与排在金属活动性顺序其后的金属氧化物反应。铝不能与MgO反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
在冷浓硝酸、浓硫酸中“钝化”,加热时反应,无H2生成
Mg+2H+=Mg2++H2↑
2Al+6H+=2Al3++3H2↑
2Al+2H2O+2OH- =2AlO2- + 3H2↑
Mg+Cu2+ = Mg2++Cu
2Al+3Cu2+ = 2Al3++3Cu
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
此反应中,还原剂是 ,氧化剂是 。
思考与讨论1:铝与强碱溶液反应的实质是?
该反应还原剂、氧化剂分别是何物质?
① 2Al + 6H2O = 2Al(OH)3 + 3H2↑
② 2Al(OH)3 + 2NaOH = 2NaAlO2 +4H2O
总: 2Al+ 6H2O + 2NaOH = 2NaAlO2 + 3H2↑+ 4H2O
请用“双线桥法”表示该反应中的电子转移情况!
1、电解质溶液为稀硫酸
2、电解质溶液为NaOH(aq)
2Al +8OH- - 6e- = 2AlO2-+4H2O
6H2O + 6e- = 6OH- +3H2↑
2Al +2OH- +6H2O= 2AlO2- + 3H2↑ +4H2O
Mg — 2e- = Mg 2+
思考与讨论2:思考下列装置是否构成原电池,能构成则写出其中的电极反应及总反应式。
注意:正、负极的判断受电解质溶液的影响,“较活泼金属”不一定做负极
1、下列关于铝的叙述中,不正确的是( )A.铝是地壳中含量最多的金属元素B.在常温下,铝不能与氧气发生反应C.铝是一种比较活泼的金属,在空气中易受腐蚀D.在化学反应中,铝容易失去电子,是还原剂E.铝箔在空气中受热可以熔化,且发生剧烈的燃烧F.铝既能与盐酸反应,又能与NaOH溶液反应,都能置换出H2
2、某无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中一定不能大量存在的是( )A.Na+ B.Mg2+ C.OH- D.HCO3-
3. 将相同质量的镁条分别在①O2 ②空气 ③N2 ④CO2中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是( )A.②<①<③<④ B.④=①=②=③ C.③<②<①<④ D.③<①<②<④
② 以MgO为主(少量Mg3N2和微量C)
解析:假设镁条为1ml,则燃烧后所得固体产物分别为:
4.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的H2在标准状况下为11.2L,则混合物中一定含有的金属是( ) A、锌 B、铁 C、铝 D、镁
“平均电子摩尔质量法”
解析:根据反应生成11.2L标况下的H2
反应中转移1mle—
∴金属混合物10g,需转移电子1mle-
5.用铝热法还原下列化合物,制得金属各1摩尔,消耗铝最少的是( ) A.MnO2 B.WO3 C. Fe3O4 D.Cr2O3 E.Fe2O3
反应的实质:铝失e—,氧化物得e—生成金属单质
KAl(SO4)2·12H2O
(1)物理性质:白色固体,难溶于水,有很高的熔点
氧化铝的天然产物俗称刚玉
(含少量铬元素的刚玉)
(含少量的铁和钛元素的刚玉)
(耐火坩埚、耐火管、耐高温的实验仪器等)
Al2O3+6H+ = 2Al3++3H2O
Al2O3+2OH- = 2AlO2-+H2O
白色难溶于水的离子化合物,高熔点,可作耐火材料
MgO + 2H+ = Mg2+ + H2O
②冶炼Al: .
(1)物理性质白色胶状不溶于水的固体,有较强的 性。
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+ OH— = AlO2— +2H2O
②受热分解: 。
只能存在于中性或弱酸性弱碱性环境中
AlO2-+H++H2O
可以吸附水中的悬浮物和各种色素
①向铝盐中加入氨水,离子方程式为 。②NaAlO2溶液中通入足量CO2,离子方程式为。③NaAlO2溶液与AlCl3溶液混合: 。
(3)制备Al(OH)3
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
AlO2—+CO2+2H2O = Al(OH)3↓+HCO3 —
3AlO2—+Al3++6H2O = 4Al(OH)3↓
AlO2—+CO2+ H2O
= Al(OH)3↓+ CO32 —
(反应实质: AlO2—和Al3+发生双水解反应)
既可以与强酸反应,又能与强碱溶液反应的物质有:
Al Al2O3 Al(OH)3
如:NaHCO3 NaHSO3 NaHS Na2HPO4等
如:(NH4)2CO3 (NH4)2SO3 CH3COONH4等
2.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成ZnNH342+ 。
Zn+ 2NaOH=Na2ZnO2+H2
2)写出锌和氢氧化钠溶液反应的化学方程式。
回答下列问题:1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 。
3)试解释在实验室不适宜用可溶性锌盐与氨水反应制备ZnOH2的原因。
可溶性锌盐与氨水反应产生的ZnOH2可溶于过量氨水中,生成 ZnNH342+ ,氨水的用量不易控制。
①可与碱(OH-、氨水等)反应
,与AlO2—、CO32—(HCO3—)、SO32—(HSO3—)、 S2- (HS—)、ClO—等发生双水解
② Al3+水解呈酸性
①与比偏铝酸更强的酸性物质(H+、CO2、HCO3—等)反应
②AlO2-水解呈碱性,与所有弱碱阳离子发生双水解反应。
(Mg2+、Al3+、Zn2+、Fe2+、Fe3+、Cu2+、Ag+、NH4+等)
熟练掌握下列反应的离子方程式:
AlCl3 + NaAlO2
NaAlO2 + NaHCO3
AlCl3 + NaHCO3
它是无色晶体,可溶于水,水溶液pH 7。
(2)明矾的化学式为 ,
Al(OH)3胶体吸附水中杂质形成沉淀而净水
(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
或 K2SO4·Al2 (SO4)3·24H2O
明矾可以净水,其净水的原理是。
3)KAl(SO4)2·12H2O
1.下列化合物的俗称与化学式不对应的是A.绿矾——FeSO4·7H2OB.芒硝——Na2SO4·10H2OC.明矾——Al2(SO4)3·12H2OD.胆矾——CuSO4·5H2O
2.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
3.下列除去杂质的方法不正确的是( )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
含铝杂质的提纯方法归类利用Al、Al2O3、Al(OH)3可溶于强碱的特性,可除去许多物质中的含铝杂质,如:①Mg(Al):加足量NaOH溶液;②Fe2O3(Al2O3):加足量NaOH溶液;③Mg(OH)2[Al(OH)3]:加足量NaOH溶液;④Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。
5.下列离子方程式书写正确的是( )A.向氯化铝溶液中通入过量氨气: 4NH3+Al3++2H2O = AlO2— +4NH4+B.将铝片打磨后置于NaOH溶液中: 2Al+2OH- = 2 AlO2— +H2↑C.向明矾溶液中加入过量的Ba(OH)2溶液: Al3++2SO42—+2Ba2++4OH-=2BaSO4↓+AlO2—+2H2OD.向NaAlO2溶液中通入足量CO2: 2AlO2—+CO2+3H2O=2Al(OH)3↓+ CO32—
6.讨论: 下列反应离子方程式
明矾[KAl(SO4)2·12H2O]溶液中加入Ba(OH)2溶液
①至Al3+恰好完全沉淀
②至SO42—恰好完全沉淀
2 : 3
2Al3++ SO42—
+3Ba2++6OH-
1 : 2
问:此时Al元素以什么形式存在?
Al3++2SO42—
+2Ba2++4OH-
+AlO2—+ 2H2O
写出上述转化的离子方程式。
4. Al3+、Al(OH)3、AlO2—之间的转化关系
① Al3++3NH3·H2O = Al(OH)3↓+3NH4+
Al3+——→Al(OH)3↓
② 3AlO2—+Al3++6H2O = 4Al(OH)3↓
③ Al3++3OH- = Al(OH)3↓
(2) Al(OH)3+3H+ = Al3++3H2O
Al3+ ↔ AlO2—
(3)Al3++4OH- = AlO2—+2H2O
(4)AlO 2— +4H+ = Al3++2H2O
AlO2— ——→Al(OH)3↓
② AlO2—+ H2O + H+= Al(OH)3↓
① AlO2—+CO2+2H2O = Al(OH)3↓+HCO3—
或 2AlO2—+CO2+3H2O = 2Al(OH)3↓+CO32—
(6) Al(OH)3+ OH— = AlO2—+2H2O
5.与Al(OH)3沉淀生成有关的图像分析
(1)把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
①Al3++3OH- = Al(OH)3↓
产生白色沉淀→沉淀逐渐增多→最多→逐渐减少→消失
②Al(OH)3+ OH— = AlO2—+2H2O
换: 往HCl、AlCl3的混合溶液中逐滴加NaOH溶液,图像如何?
n[Al(OH)3]=
3< <4,
产物有Al(OH)3↓和AlO2-
发生反应Al3++4OH- = AlO2—+2H2O
铝盐(Al3+)与强碱溶液反应,Al元素的存在形式:
Al3+形成Al(OH)3的简单计算
1.向30 mL 1 ml·L-1的AlCl3溶液中逐渐加入浓度为4 ml·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )A.3 mL B.7.5 mL C.15 mL D.17.5 mL
0.01ml Al(OH)3↓
由Al(OH)3沉淀的量小于AlCl3的量
可推知此题可能有两个答案:①NaOH不足,②NaOH过量。
Al3++3OH- = Al(OH)3↓
=0.007 5 L=7.5 mL;
Al(OH)3+ OH—=AlO2—+2H2O
需NaOH 0.11 ml
当生成沉淀0.01 ml时,需NaOH 0.03 ml或0.11 ml显然B项符合题意。
把该题的信息转化为图像
0 0.09 0.12
2.有一未知浓度的AlCl3溶液,取出50ml该溶液,分别与60ml1ml/LNaOH溶液和60ml3ml/LNaOH溶液充分反应,得到沉淀的质量相等,试求c(AlCl3)
方法一、列方程式求解(略)
a点: Al3++3OH- = Al(OH)3↓
(2)把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量
①Al3+ + 4OH—= AlO2—+ 2H2O
②Al3++ 3AlO2-+6H2O = 4Al(OH)3↓
先无明显现象→产生白色↓→沉淀渐多→最多→沉淀不消失
换:把铝盐(Al3+)溶液逐滴加入到氨水溶液中至过量
请分析其中的反应及图像。
立即产生白色沉淀→沉淀逐渐增多→最多→沉淀量不变
(3)在AlO2-溶液中逐滴加入强酸至过量
① AlO2- + H+ + H2O = Al(OH)3↓
② Al(OH)3 + 3H+ = Al3++ 3H2O
立即产生白色↓→沉淀渐多→最多→逐渐减少→消失
换: 把CO2通入到AlO2-溶液中至过量
CO32—+CO2+H2O = 2HCO3—
2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
(4)向强酸溶液中逐滴加入AlO2-溶液至过量
① AlO2-+ 4H+ =Al3+ + 2H2O
② Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
(5)往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量
Al3++3OH- = Al(OH)3↓
Mg2++2OH- = Mg(OH)2↓
② Al(OH)3+ OH— = AlO2—+2H2O
开始出现白色沉淀,后沉淀量增多,最后沉淀部分溶解。
Al(OH)3、Mg(OH)2
向盐酸、MgCl2、AlCl3的混合溶液中逐滴加入NaOH溶液到过量。画出生成沉淀的量与加入溶液的体积关系图。
3.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO42—的物质的量之比为( ) A.1∶3 B.2∶3 C.6∶1 D.3∶1
AB段完全溶解Al(OH)3 消耗NaOH 0.1 L,则Al3+生成Al(OH)3消耗NaOH 0.3 L,沉淀Mg2+消耗NaOH 0.1 L,因而n(AlCl3)∶n(MgSO4)=2∶1,所以,n(Cl-)∶n(SO42— )=6∶1。
(6)明矾[KAl(SO4)2·12H2O]溶液中滴加Ba(OH)2溶液至过量
请分析其中发生的反应,
→铝是地壳中含量最多的金属元素,
→铝土矿的主要成分是Al2O3
含有少量SiO2、Fe2O3等杂质
→写出①、②两步骤中可能发生反应的离子方程式。
(SiO2、Fe2O3)
①Al2O3+2OH-=2AlO2-+H2O
SiO2+2OH-=SiO32-+H2O
②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
AlCl3FeCl3HCl
(1)写出①、②中可能发生反应的离子方程式。
①Al2O3+6H+ = 2Al3++3H2O,
Fe2O3+6H+ = 2Fe3++3H2O
②Al3++4OH-=AlO2—+2H2O
Fe3++3OH-= Fe(OH)3↓
NaAlO2NaClNaOH
(2)步骤②中不用氨水沉淀Fe3+的原因:_____________________________________________________________。
Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
1.MgO与Al粉的混合物也可称为铝热剂( )2.实验室可用氧化铝坩埚熔化NaOH、Na2CO3固体等( )3.铝和酸反应时,氧化剂是酸,铝和碱反应时,氧化剂是碱( )4.明矾可作净水剂,起到杀菌消毒的作用( )
1.下列关于铝的化合物的说法错误的是A.氧化铝俗名为刚玉,是高温耐火材料B.KAl(SO4)2·12H2O溶于水可形成Al(OH)3胶体,可以净水
一、铝及其化合物的性质
C.Al3+和AlO2-两种离子不能大量共存于同一溶液中D.将AlCl3溶液滴入浓氨水中的离子方程式:
Al3++4NH3·H2O=AlO2-+4NH4++2H2O
2.称取两份铝粉,第一份加入足量氢氧化钠溶液,第二份加入足量盐酸,若要放出等量的气体,两份铝粉的质量之比为A.1∶3 B.3∶1 C.1∶1 D.4∶3
2Al + 6H+ = 2Al3+ + 3H2↑
2Al+2H2O+2OH—=2AlO2—+3H2↑
3.向含有HCl、MgCl2、AlCl3、NH4Cl的混合溶液中(假设各1 ml),逐滴加入NaOH溶液,沉淀的物质的量随NaOH溶液体积变化的图像如下。(假设Mg2+、Al3+结合OH-能力相同)
分析图像的变化情况,回答下列问题:
(1)H+、Al3+、Al(OH)3、NH4+四种微粒与OH-反应的先后顺序依次为__________________。
H+、Al3+、NH4+、Al(OH)3
(2)依次写出各阶段的离子方程式:①OA:________________。②AB:______________________________________。③BC:_______________________。④CD:_________________________。
Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓
NH4++OH-=NH3·H2O
Al(OH)3+OH-=AlO2-+2H2O
4.工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
对上述流程中的判断正确的是A.试剂X可以为氨水,沉淀中含有铁的化合物B.CO2可以用H2SO4溶液或稀盐酸代替
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
C.反应Ⅱ中的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
5.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃时水解生成A的化学方程式为_____________________________,“水解”采用90 ℃而不在室温下进行的原因是 。(2)“酸溶”时,Al2O3发生反应的离子方程式为______________________。
加快AlN的水解反应速率,降低NH3在水中的溶解度,促使NH3逸出
Al2O3+6H+=2Al3++3H2O
Al、Al2O3、AlN、FeO
(3)“氧化”时,发生反应的离子方程式为_________________________。(4)“废渣”的成分为__________(填化学式)。(5)采用喷雾干燥而不用蒸发的原因是______________________________。
2Fe2++2H++ClO-=2Fe3++Cl-+H2O
防止Al(OH)2Cl水解生成Al(OH)3
考点二 镁 海 水 提 镁
1.从海水中提取镁的流程
CaO+H2O = Ca(OH)2;
Mg2++ Ca(OH)2=Mg(OH)2↓+Ca2+
Mg(OH)2+2HCl= MgCl2+2H2O
2.镁的重要化合物(1) MgO :白色粉末状固体, 溶于水,属于 , 与盐酸反应的离子方程式为__________________________。(2) Mg(OH)2 :白色固体, 溶于水,中强碱, 与盐酸反应的离子方程式为___________________________。
MgO+2H+=Mg2++H2O
Mg(OH)2+2H+=Mg2++2H2O
1.以混有SiO2的MgCO3为原料制备MgO的实验流程如图:
下列说法错误的是A.酸浸的离子方程式为CO32-+2H+=CO2↑+H2OB.浸出渣的成分是SiO2C.母液的主要溶质是NH4ClD.固体X是Mg(OH)2
MgCO3是微溶物,不可拆成离子
MgCl 2+2NH3·H2O=Mg(OH)2↓+2NH4Cl
2.从海水中提取镁的工艺流程如图所示:
(1)海水通过结晶、过滤得到的固体物质主要是________。
(2)怎样使MgCl2·6H2O失去结晶水得到MgCl2?
答案 将晶体置于HCl气体氛围中脱水。
(3)上述工艺流程涉及到的基本反应类型有__________________________。
化合反应、分解反应、复分解反应
(4)写出电解熔融MgCl2的电极反应式。
答案 阳极:2Cl--2e-=Cl2↑ 阴极:Mg2++2e-=Mg
3. KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
(2)易拉罐溶解过程中主要反应的化学方程式为____________________
(1)为尽量少引入杂质,试剂①应选用_____(填标号)。 a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
KAl(SO4)2·12H2O(明矾)
新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析),共60页。PPT课件主要包含了内容索引,铝及其化合物,铝单质,必备知识,Al2O3+,AlOH3,方案二酸溶法,关键能力,FeOH3,镁海水提镁等内容,欢迎下载使用。
第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共35页。PPT课件主要包含了复习目标,铝及其化合物,考点一,必备知识,易错辨析,专项突破,归纳提升,镁海水提镁,考点二,特别提醒等内容,欢迎下载使用。
高考化学一轮复习课件8 铝、镁及其化合物(含解析): 这是一份高考化学一轮复习课件8 铝、镁及其化合物(含解析),共44页。PPT课件主要包含了镁及其化合物,铝的性质,铝的结构和存在,第三周期第ⅢA族,金属铝的物理性质,银白色,金属铝的化学性质,形成致密的氧化膜,铝的用途,补充铝热反应等内容,欢迎下载使用。












