



备战2025届新高考化学一轮总复习第5章物质结构与性质元素周期律第24讲元素周期表和元素周期律及其应用课件
展开1.认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。2.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
考点一 元素周期表的结构与核外电子排布
答题模板1 电离能的比较及原因分析
考点一元素周期表的结构与核外电子排布
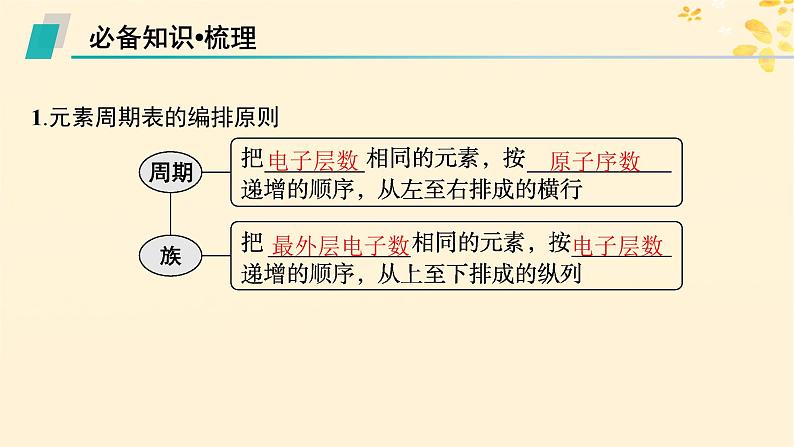
1.元素周期表的编排原则
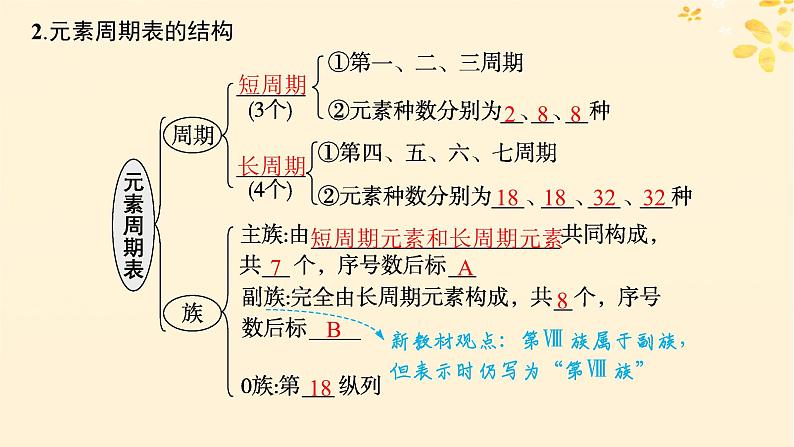
2.元素周期表的结构
短周期元素和长周期元素
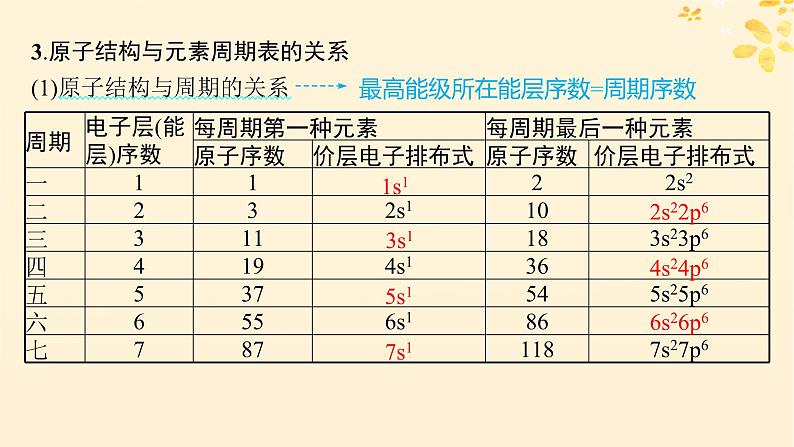
3.原子结构与元素周期表的关系(1)原子结构与周期的关系
最高能级所在能层序数=周期序数
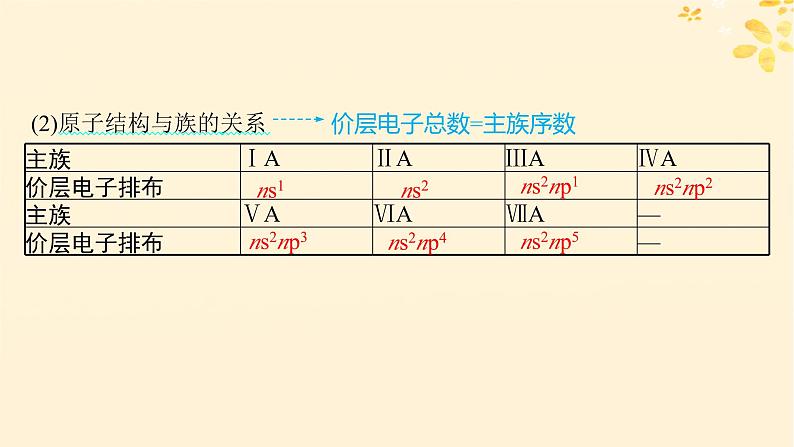
(2)原子结构与族的关系
价层电子总数=主族序数
4.元素周期表的分区(1)按元素的种类分区
(2)按价层电子排布分区
微点归纳元素周期表中各分区原子的价层电子排布特点
【应用示例】元素在周期表中的位置与其基态原子核外电子排布有关,元素X的+3价基态离子的电子排布式为[Ar]3d5,回答问题:(1)元素X是________,其基态原子核外简化电子排布式为_____________。(2)元素X在周期表中的位置是__________________,处于周期表的________区。
[Ar]3d64s2
5.元素周期表和元素周期律的应用(1)科学预测:为新元素的发现及预测其原子结构和性质提供了线索。(2)寻找新物质
(3)用于工农业生产:对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
考向1 原子结构与元素周期表的关系例1具有以下结构的基态原子的元素,一定属于主族元素的是( )A.最外层有1个电子的原子B.最外层电子排布式为ns2的原子C.最外层有3个未成对电子的原子D.次外层无未成对电子的原子
解析 最外层有1个电子的原子,可能属于主族元素(第ⅠA族),也可能属于副族元素,如Cr(3d54s1)、Cu(3d104s1)等,A错误;最外层电子排布式为ns2的原子可能是主族元素(第ⅡA族),也可能是0族(如He)或副族元素,如Mn(3d54s2)、Zn(3d104s2)等,B错误;最外层有3个未成对电子的原子,其电子排布式为ns2np3,属于第ⅤA族元素,C正确;次外层无未成对电子的原子,说明次外层全充满,可能属于主族元素(如O、N等),也可能属于0族(如Ne等)或副族(如Cu、Zn等),D错误。
[对点训练1] 具有下列特征的原子对应的元素,一定属于同一周期的是( )A.最外电子层上全部都是s轨道电子B.3p能级上电子数为奇数C.4s能级上有2个电子D.次外层电子数均为8
解析 原子最外电子层上全部都是s轨道电子,对应元素可能是第ⅠA、ⅡA族,也可能是过渡元素,如Cu(3d104s1)等,不一定处于同周期,A错误;3p能级上电子数为奇数的原子可能是Al(3s23p1)、P(3s23p3)、Cl(3s23p5),对应元素均处于第三周期,B正确;4s能级上有2个电子,若4s能级是最高能级,可能是第四周期的元素,如Ca(4s2)、Zn(3d104s2)等,若4s能级不是最高能级,可能是第五、六、七周期的元素,C错误;原子的次外层电子数为8的元素可能是第三周期元素,如Na、Mg等,也可能是第四周期元素,如K、Ca等,不一定处于同周期,D错误。
考向2 元素周期表的结构及应用例2(2024·湖南长郡中学月考)元素X、Y、Z在元素周期表中的相对位置如图所示。已知Y元素原子的价层电子排布式为nsn-1npn+1,下列说法不正确的是( )
A.Y元素原子的价层电子排布式为3s23p4B.Y元素在元素周期表的第四周期第ⅥA族C.X元素所在周期中所含非金属元素最多D.Z元素在元素周期表中处于p区
解析 Y元素原子的价层电子排布式中出现了np能级,故其ns能级已经充满且只能为2个电子,则n-1=2,n=3,即Y元素原子的价层电子排布式为3s23p4,A正确,B错误;Y为S元素,X为F元素,第二周期所含非金属元素最多,C正确;Z为As元素,核外电子排布式为1s22s22p63s23p63d104s24p3,最后1个电子填充在4p轨道,故属于p区元素,D正确。
归纳总结1.相邻周期同主族元素的原子序数之间的关系
[对点训练2] X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,已知W原子的最外层电子比内层电子少3个,下列说法正确的是( )A.氧化物对应水化物酸性W比Z强B.Y单质与Z的氢化物水溶液反应,有沉淀生成C.基态原子核外的未成对电子数:X
2.主族元素的原子结构和元素性质的变化规律(1)原子结构的变化规律
(2)元素性质的变化规律
3.元素的金属性和非金属性强弱的判断方法
5.电离能的三个重要应用
7.电负性的三个重要应用
8.对角线规则在元素周期表中,某些主族元素与________的主族元素的有些性质是相似的,这种相似性被称为“对角线规则”。
考向1 粒子半径、元素金属性和非金属性的比较例1X、Y、Z、W、M是五种常见的短周期主族元素,其原子半径随原子序数的变化如图所示,已知Y的原子核外电子总数是W的4倍,M、X的最外层电子数之和与W的最外层电子数相等。下列说法错误的是( )A.金属性:X>WB.非金属性:Z>Y>MC.M、X、Y、Z的离子半径:M
[对点训练2] (2023·广东广州天河区二模)X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是( )
进阶1 练易错·避陷阱1.以下有关元素性质的说法错误的是( )A.元素电负性:Na
解析 根据电负性变化规律,电负性:Na
2.若某原子处于能量最低状态时,其价层电子排布式为3d24s2。下列说法正确的是( )A.该元素处于周期表中的ds区B.该元素处于周期表中的第四周期第ⅡB族C.该元素原子的M能层共有10个电子D.该元素是金属元素,与Zn处于同族
解析 该元素基态原子的价层电子排布式为3d24s2,则其电子排布式为1s22s22p63s23p63d24s2,应为Ti元素,处于元素周期表中的第四周期第ⅣB族,属于d区元素,与Zn不是同族元素。由原子的电子排布式可知,M能层的电子总数为2+6+2=10。
进阶2 练热点·提素能3.(2023·广东江门一模)部分短周期元素的原子半径及主要化合价如表所示。
下列有关说法正确的是( )A.第一电离能:X比Y小B.简单离子半径:T>X>YC.W的气态氢化物沸点比T气态氢化物沸点低D.T的氧化物对应水化物的酸性一定比Z的氧化物对应水化物的酸性强
解析 T和W均有-1价化合价,且两者的半径依次减小,那么两者分别为Cl、F。由Z的化合价推知Z为S。X、Y的半径大于Z且其化合价为+2价、+3价,那么它们分别为Mg、Al。X为3s2全充满稳定结构,难失电子,所以其第一电离能X>Y,A项错误;离子半径:电子层多半径大;同电子层,核电荷数多半径小。半径T>X>Y,B项正确;HF中有分子间氢键,沸点更高,即W的气态氢化物的沸点高于T,C项错误;T的氧化物的水化物有HClO、HClO4等,而Z的有H2SO4和H2SO3,没有明确物质无法比较,D项错误。
4.(2024·黑龙江大庆第一次质检)短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )A.第一电离能:W>X>Y>ZB.电负性:Y>Z>WC.简单离子的半径:W>X>Y>ZD.氢化物水溶液的酸性:Y>W
解析 短周期主族元素X、Y、Z、W的原子序数依次增大,Z与X能形成淡黄色化合物Z2X2,该淡黄色化合物应为Na2O2,则X为O元素,Z为Na元素,基态O原子的电子总数是其最高能级电子数的2倍;Y与W的最外层电子数相同,结合Y的原子序数在O与Na之间,则Y为F元素,W为Cl元素。同一周期从左向右元素第一电离能总趋势为逐渐增大,同一主族从上到下第一电离能逐渐减小,故四种元素中第一电离能从大到小的顺序为Y>X>W>Z,A错误;非金属性越强,元素的电负性越大,则电负性为Y>W>Z,B错误;四种元素的离子半径从大到小的顺序为Cl->O2->F->Na+,即W>X>Y>Z,C正确;F元素的非金属性强于Cl元素,则形成氢化物后,F原子吸引H原子的能力强于Cl原子,在水溶液中HF不容易发生电离,则HCl的酸性强于HF,D错误。
6.(2021·广东卷)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )
A.XEZ4是一种强酸B.非金属性:W>Z>YC.原子半径:Y>W>ED.ZW2中,Z的化合价为+2价
解析 本题考查元素推断与元素周期律。X的原子核只有1个质子,则X是氢元素;Y、Z、W为第二周期元素,可分别形成4、2、1条共价键,则Y、Z、W分别是C元素、O元素、F元素;元素E的原子比F原子多8个电子,则E为Cl元素。HClO4是强酸,A项正确;非金属性:F>O>C(W>Z>Y),B项正确;原子半径:Cl>F(E>W),C项错误;氟元素的非金属性比氧元素强,OF2中F为-1价,O为+2价,D项正确。
答题模板1电离能的比较及原因分析
1.(2023·北京卷,15节选)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:___________________________________________。 2.(2022·河北卷,17节选)Cu与Zn相比,第二电离能与第一电离能差值更大的是________,原因是___________________________________________。
答案 I1(O)>I1(S);氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子
答案 Cu Cu的第二电离能失去3d10电子,第一电离能失去4s1电子,3d10电子处于全充满状态,较难失去电子,则Cu的第二电离能较大,与第一电离能的差值大
备战2025届新高考化学一轮总复习第5章物质结构与性质元素周期律第25讲化学键课件: 这是一份备战2025届新高考化学一轮总复习第5章物质结构与性质元素周期律第25讲化学键课件,共39页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,极性键,离子键和共价键,阳离子,不同种,离子键,共价键等内容,欢迎下载使用。
2024版新教材高考化学全程一轮总复习第五章物质结构与性质元素周期律第15讲元素周期表元素周期律课件: 这是一份2024版新教材高考化学全程一轮总复习第五章物质结构与性质元素周期律第15讲元素周期表元素周期律课件,共59页。PPT课件主要包含了核电荷数,质子数,核外电子数,原子序数,最外层电子数,ns2,ns2np1,ns2np2,ns2np3,ns2np4等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第5章物质结构与性质元素周期律第14讲元素周期表元素周期律课件: 这是一份新教材适用2024版高考化学一轮总复习第5章物质结构与性质元素周期律第14讲元素周期表元素周期律课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,第一张元素周期表,周期表,核电荷数,核外电子数,电子层数目,原子序数等内容,欢迎下载使用。












