



高考化学一轮复习第6章物质结构与性质元素周期律第28讲元素周期表元素周期律课件
展开1.知道元素周期表的结构、分区、周期和族的元素原子核外电子排布特征。2.认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化。3.通过元素周期律(表)核心知识的学习,建立“位—构—性”等认知模型,体会结构与性质的联系。
考点一 元素周期表 1.元素周期表的编排原则
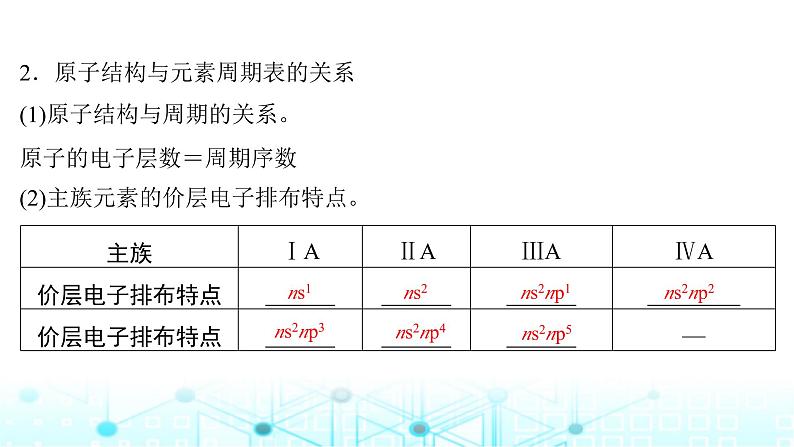
2.原子结构与元素周期表的关系(1)原子结构与周期的关系。原子的电子层数=周期序数(2)主族元素的价层电子排布特点。
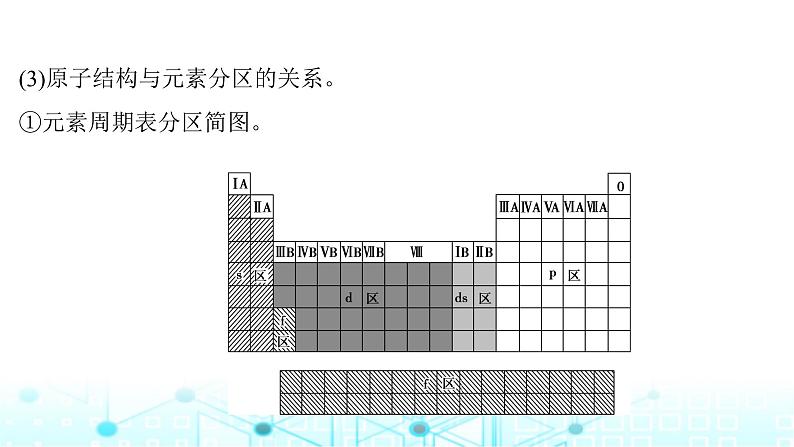
(3)原子结构与元素分区的关系。①元素周期表分区简图。
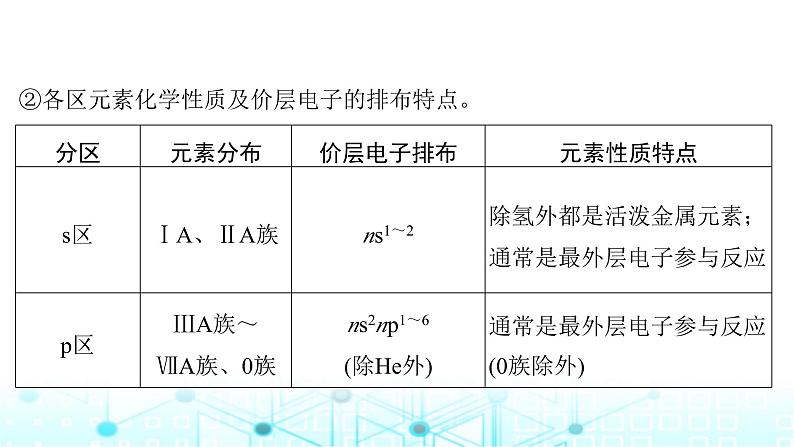
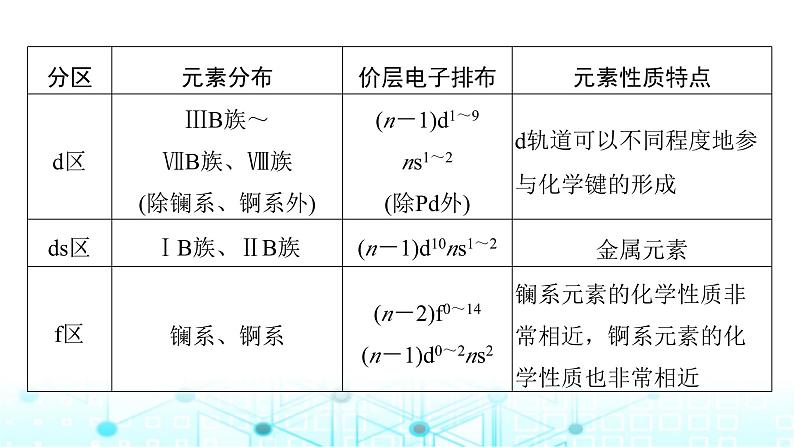
②各区元素化学性质及价层电子的排布特点。
(4)根据金属与非金属分界线分区。
3.元素周期表的应用(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供了线索。(2)寻找新材料。
[易错秒判](1)元素周期表共18个纵列,18个族,7个周期 ( )(2)所有非金属元素都分布在p区( )(3)原子的最外层有2个电子的元素一定是第ⅡA族元素( )(4)价层电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素( )(5)第ⅠA族元素都是碱金属元素,在化学反应中均易失去1个电子( )(6)过渡元素都是金属元素,且均由副族元素组成( )(7)两种短周期元素的原子序数相差8,周期序数一定相差1( )答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)√
一、元素周期表的结构1.请在下表中画出元素周期表的轮廓,并回答下列问题:
(1)标出族序数、周期序数。(2)将主族元素前六周期的元素符号补充完整。(3)画出金属与非金属的分界线,并用阴影表示出过渡元素的位置。(4)标出镧系、锕系的位置。(5)写出各周期元素的种类数。(6)写出稀有气体元素的原子序数,标出113号~117号元素的位置。
二、元素周期表的应用2.部分元素在元素周期表中的分布如下。下列说法不正确的是( ) A.B只能得电子,不能失电子B.原子半径:Ge>SiC.As可用作半导体材料D.P位于第六周期第ⅥA族
解析:由题图可知,虚线为金属元素与非金属元素的分界线。B元素位于金属元素与非金属元素的分界线附近,既能得电子,也能失电子,故A错误;同一主族元素从上到下,原子半径逐渐增大,所以原子半径:Ge>Si,故B正确;As元素位于金属元素与非金属元素的分界线附近,可用作半导体材料,故C正确;P为主族元素,原子核外有6个电子层,最外层电子数为6,即位于元素周期表中第六周期第ⅥA族,故D正确。
3.根据元素周期表的结构确定元素原子序数之间的关系。(1)若甲、乙是元素周期表中同一周期的第 ⅡA 族和第ⅦA 族元素,原子序数分别为m、n,则m、n的关系为________________________。(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是___________________。答案:(1)n=m+5、n=m+15、n=m+29(2)x+2、x+8、x+18、x+32
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为________。(4)下列各表为元素周期表中的一部分,表中数字表示原子序数,其中M的原子序数为37的是________。
答案:(3)y=x+m或y=x+n(4)B
考点二 元素周期律 1.元素周期律
元素原子的核外电子排布
2.主族元素的周期性变化规律
3.金属性、非金属性的判断方法
4.电离能(1)第一电离能:气态基态原子失去一个电子转化为气态基态正离子所需要的_________,符号为________,单位为 __________。(2)变化规律①同周期:第一种元素(氢和碱金属)的第一电离能最______,最后一种元素(稀有气体)的第一电离能最______,从左到右呈增大的变化趋势(注意第ⅡA族、第ⅤA族的特殊性)。②同族元素:从上到下第一电离能逐渐________。③同种原子:逐级电离能越来越大,即I1
6.对角线规则在元素周期表中,某些主族元素与______的主族元素的有些性质是相似的,这种相似性被称为对角线规则。
[易错秒判](1)第二周期元素从左到右,最高正化合价从 +1 价递增到+7价( )(2)同周期元素从左到右,原子半径逐渐减小,离子半径也逐渐减小( )(3)同主族元素含氧酸的酸性随核电荷数的增加而减弱( )(4)元素的气态氢化物越稳定,其水溶液的酸性越强,元素的非金属性越强( )(5)元素的原子得电子越多,元素的非金属性越强;失电子越多,元素的金属性越强( )(6)主族元素的电负性越大,元素的第一电离能一定越大( )(7)在形成化合物时,电负性越大的元素越容易显示正价( )(8)钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能( )答案:(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)×
1.比较下列微粒半径的大小(填“>”或“<”)。(1)Na______Mg______Cl(2)Li______Na______K(3)Na+______Mg2+______Al3+(4)F-______Cl-______Br-(5)Cl-______O2-______Na+______Mg2+(6)Fe2+______Fe3+答案:(1)> > (2)< < (3)> > (4)< <(5)> > > (6)>
[方法技巧]“三看”法快速判断简单微粒半径的大小一看电子层数:当最外层电子数相同时,电子层数越多,半径越大。二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
2.下列事实不能说明元素的金属性或非金属性相对强弱的是( )
解析:SO2能与NaHCO3溶液反应生成CO2,说明H2SO3的酸性比H2CO3的酸性强,但H2SO3不是最高价含氧酸,故不能说明非金属性:S>C。
3.已知X、Y是主族元素,I为电离能,单位是kJ·ml-1。请根据下表数据判断,错误的是( )
A.元素X的常见化合价是+1价B.元素Y是第ⅢA族元素C.元素X与氯形成化合物时,化学式可能是XClD.若元素Y处于第三周期,它可与冷水剧烈反应
解析:由数据知,X的I2≫I1,X易呈+1价,为第ⅠA 族元素,A、C正确;Y的I4≫I3,Y易呈+3价,为第ⅢA 族元素,B正确;若Y处于第三周期,则Y为铝元素,铝不与冷水反应,D错误。
4.已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出n种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是_________________________________________________________。(2)通过分析电负性数值变化规律,确定镁元素电负性值的最小范围是________。答案:(1)随着原子序数的递增,元素的电负性呈周期性变化 (2)0.9~1.5
(3)判断下列物质是离子化合物还是共价化合物:A.Li3N B.BeCl2 C.AlCl3 D.SiC属于离子化合物的是________(填字母,下同);属于共价化合物的是________;请设计一个实验方案证明上述所得到的结论:______________。(4)在P与Cl组成的化合物中,Cl元素显________(填“正”或“负”)价,理由是________________________________________________________。答案:(3)A BCD 测定各物质在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物 (4)负 Cl的电负性大于P的电负性,Cl对键合电子的吸引能力强
1.(2023·新高考江苏卷)元素C、Si、Ge位于元素周期表中第ⅣA族。下列说法正确的是( )A.原子半径:r(C)>r(Si)>r(Ge)B.第一电离能:I1(C)
2.(2023·新高考重庆卷)“嫦娥石”是中国首次在月球上发现的新矿物,其主要由Ca、Fe、P、O和Y(钇,原子序数比Fe大13)组成,下列说法正确的是( )A.Y位于元素周期表的第ⅢB族B.基态Ca原子的核外电子填充在6个轨道中C.5种元素中,第一电离能最小的是FeD.5种元素中,电负性最大的是P
解析:A.钇原子序数比Fe大13,为39号元素,位于元素周期表的第五周期第ⅢB族,A正确;B.钙为20号元素,基态原子的核外电子排布式为1s22s22p63s23p64s2,核外电子填充在10个轨道中,B错误;C.同主族从上到下,元素的第一电离能逐渐减小,同周期从左到右,元素的第一电离能呈增大趋势,5种元素中,钙的第一电离能最小,C错误;D.同周期从左到右,主族元素的电负性逐渐增大,同主族从上到下,元素的电负性逐渐减小,5种元素中,电负性最大的是O,D错误。
3.(2023·新高考北京卷)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A.F—F的键能小于Cl—Cl的键能B.三氟乙酸的Ka大于三氯乙酸的KaC.氟化氢分子的极性强于氯化氢分子的极性D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
解析:A项,F原子半径小,电子云密度大,两个原子间的斥力较强,F—F不稳定,因此F—F的键能小于Cl—Cl的键能;B项,氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基极性更大,更容易电离出氢离子,酸性更强;C项,氟的电负性大于氯的电负性,F—H的极性大于Cl—H的极性,导致HF分子的极性强于HCl分子的极性;D项,氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在(HF)2。
解析:A.核外电子排布相同时,核电荷数越大,离子半径越小,故r(Al3+)
5.(2023·浙江6月选考)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻;X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是( )A.第一电离能:Y>Z>XB.电负性:Z>Y>X>WC.Z、W原子形成稀有气体电子构型的简单离子的半径:W
2025届高考化学一轮总复习第6章物质结构与性质元素周期律第28讲元素周期表元素周期律课件: 这是一份2025届高考化学一轮总复习第6章物质结构与性质元素周期律第28讲元素周期表元素周期律课件,共47页。PPT课件主要包含了原子序数,最外层电子数,电子层数,ns1,ns2,ns2np1,ns2np2,ns2np3,ns2np4,ns2np5等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第2讲元素周期表元素周期律课件: 这是一份新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第2讲元素周期表元素周期律课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,原子半径,电负性,答案C,归纳总结等内容,欢迎下载使用。
2025版高考化学一轮总复习第5章物质结构与性质元素周期律第17讲元素周期表和元素周期律课件: 这是一份2025版高考化学一轮总复习第5章物质结构与性质元素周期律第17讲元素周期表和元素周期律课件,共60页。PPT课件主要包含了考点1元素周期表,周期表,核电荷数,核外电子数,元素周期表的结构,2s22p6,s24p6,5s1,s26p6,x+8等内容,欢迎下载使用。












