

第5讲 有关阿伏加德罗常数(NA)的选择题 -备战2023年高考化学【一轮·夯实基础】复习精讲精练
展开【复习目标】
1.加深对物质的量及相关物理量的理解,理清其适用条件和范围。
2.掌握宏观物理量与微观物理量转化计算的技巧。
【知识精讲】
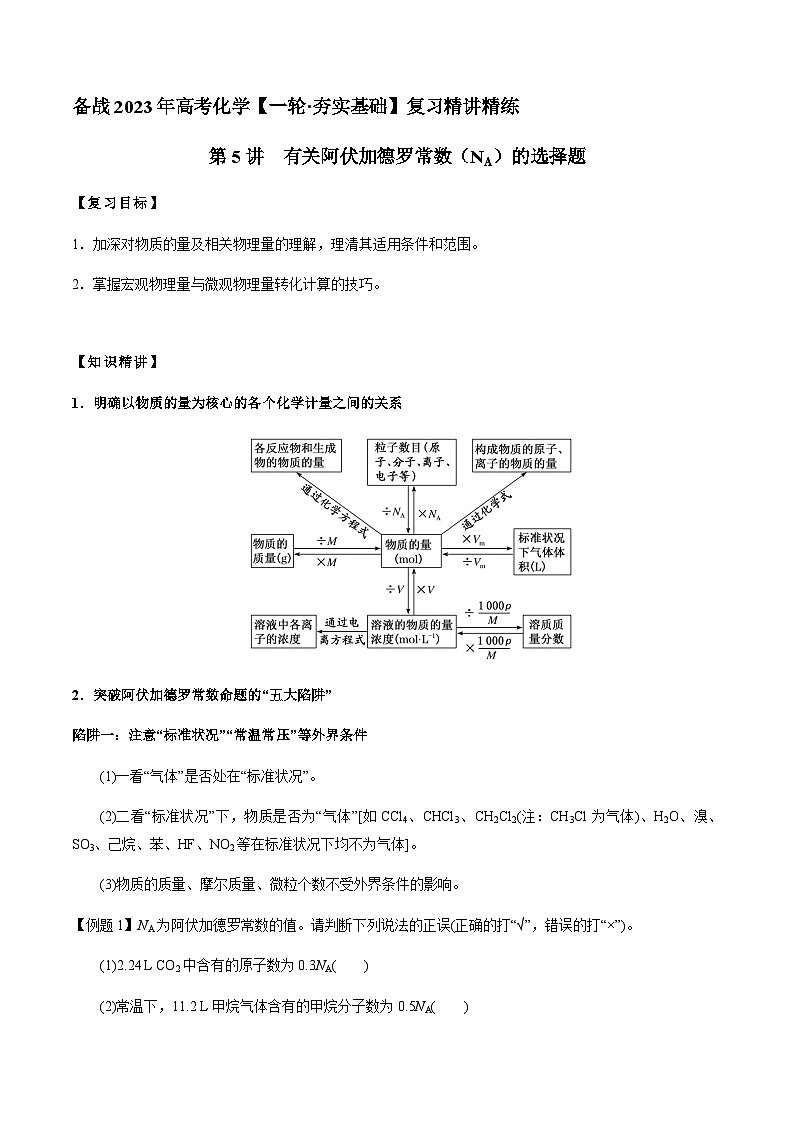
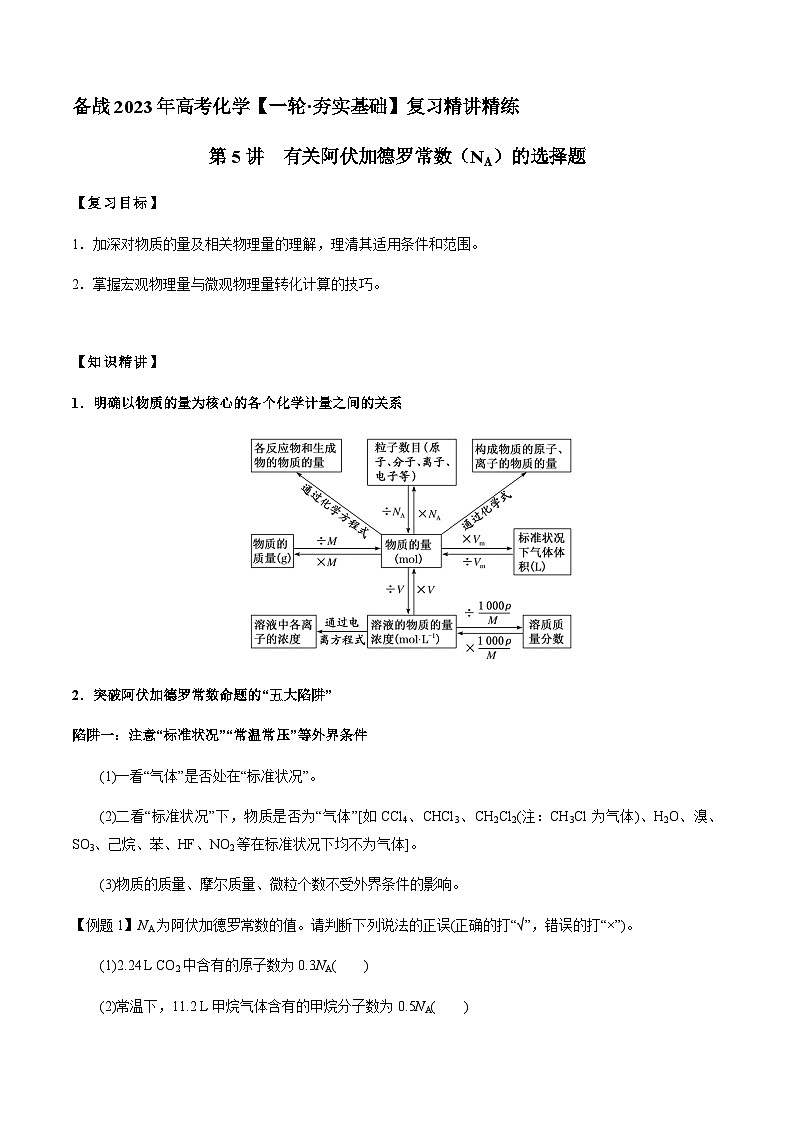
1.明确以物质的量为核心的各个化学计量之间的关系
2.突破阿伏加德罗常数命题的“五大陷阱”
陷阱一:注意“标准状况”“常温常压”等外界条件
(1)一看“气体”是否处在“标准状况”。
(2)二看“标准状况”下,物质是否为“气体”[如CCl4、CHCl3、CH2Cl2(注:CH3Cl为气体)、H2O、溴、SO3、己烷、苯、HF、NO2等在标准状况下均不为气体]。
(3)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
【例题1】NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)2.24 L CO2中含有的原子数为0.3NA( )
(2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5NA( )
(3)常温常压下,1.4 g乙烯与丙烯混合气体含有的原子数为0.3NA( )
(4)标准状况下,22.4 L SO3中含有SO3的分子数为NA( )
(5)标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子( )
(6)用惰性电极电解饱和食盐水,若阴极产生11.2 L气体,则线路中通过NA个电子( )
(7)常温常压下,1 ml CO2与SO2的混合气体中含氧原子数为2NA( )
【答案】(1)× (2)× (3)√ (4)× (5)√ (6)× (7)√
陷阱二:注意物质的组成和结构
(1)特殊物质中所含微粒 (分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、H37Cl;
(2)物质中所含化学键的数目,如CO2、CnH2n+2等;
有特殊结构的物质的量计算:如1 ml Si中含Si—Si 2NA、1 ml SiO2中含Si—O 4NA、1 ml石墨烯(单层石墨)中含有六元环的个数为0.5NA等。
(3)最简式相同的物质中的微粒数目,如NO2和N2O4、乙烯和丙烯、O2和O3等;
(4)摩尔质量相同的物质中的微粒数目,如N2、CO、C2H4等。
【例题2】NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)36 g 18O2中含有10NA个中子( )
(2)17 g —OH与17 g OH-所含电子数均为10NA( )
(3)92 g NO2与N2O4的混合气体中含有的原子总数为6NA( )
(4)乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3NA个氢原子( )
(5)CH4与P4的分子结构均为正四面体形,在1 ml CH4分子或P4分子中含有的共价键数均为4NA( )
(6)4.5 g SiO2晶体中含有的硅氧键的数目为0.3NA( )
(7)34 g过氧化氢存在的极性键总数为3NA( )
(8)46 g乙醇中存在的共价键总数为8NA( )
【答案】(1)× (2)× (3)√ (4)× (5)× (6)√ (7)× (8)√
陷阱三:注意氧化还原反应中电子转移数目的判断
(1)同一种物质在不同反应中氧化剂、还原剂的判断;
如Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2或NO等反应,Na2O2只作氧化剂。
(2)量不同,所表现的化合价不同。
如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。
(3)氧化剂或还原剂不同,所表现的化合价不同。
如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
(4)注意氧化还原的顺序。
如向FeI2溶液中通入Cl2,Cl2首先氧化I-,再氧化Fe2+。
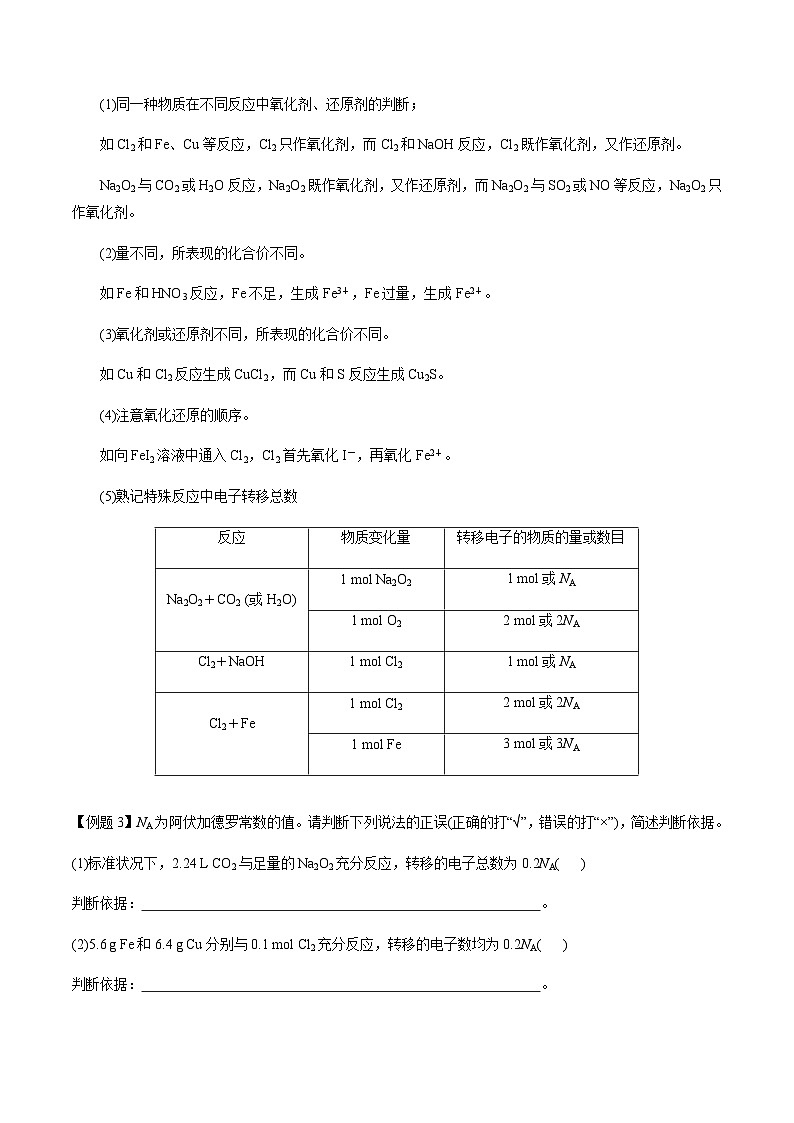
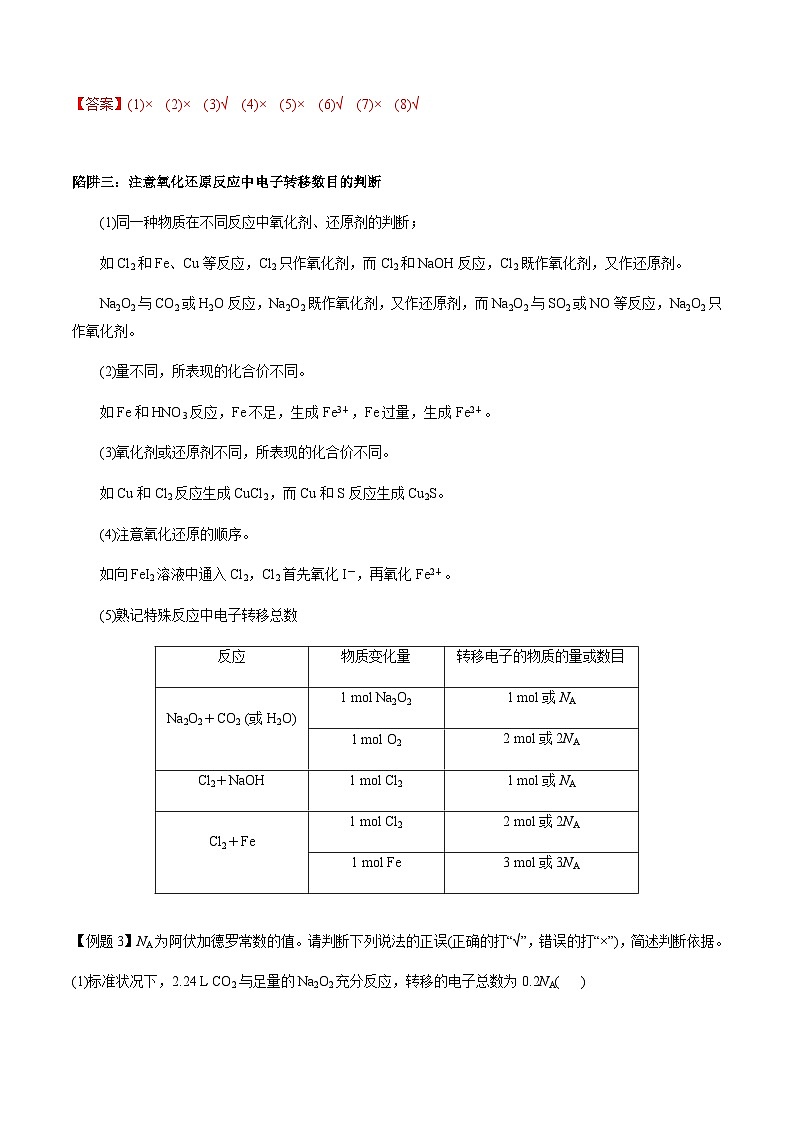
(5)熟记特殊反应中电子转移总数
【例题3】NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。
(1)标准状况下,2.24 L CO2与足量的Na2O2充分反应,转移的电子总数为0.2NA( )
判断依据: 。
(2)5.6 g Fe和6.4 g Cu分别与0.1 ml Cl2充分反应,转移的电子数均为0.2NA( )
判断依据: 。
(3)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA( )
判断依据: 。
(4)6.4 g Cu与S完全反应,转移的电子数为0.2NA( )
判断依据: 。
(5)向FeBr2溶液中通入适量Cl2,当有1 ml Fe2+被氧化时,转移的电子总数一定等于3NA( )
判断依据: 。
【答案】
(1)(×) 判断依据:该反应为Na2O2中-1价氧元素的歧化反应,0.1 ml CO2反应消耗0.1 ml Na2O2,转移0.1 ml电子。
(2)(√) 判断依据:0.1 ml Fe和0.1 ml Cu均能完全使0.1 ml Cl2转化为0.2 ml Cl-,转移0.2 ml电子。
(3)(×) 判断依据:没有给出硝酸的量,不能判断最终产物中铁元素的价态,故不能判断转移电子的数目。
(4)(×) 判断依据:该反应的产物为Cu2S,0.1 ml Cu只能失去0.1 ml电子。
(5)(×) 判断依据:还原性:Fe2+>Br-,Cl2首先氧化Fe2+,Cl2的量不确定,无法确定Br-被氧化的量,转移的电子数在NA ~3NA之间。
陷阱四:注意电解质溶液中粒子数目的判断
(1)是否存在弱电解质的电离或盐类的水解。
(2)已知浓度,是否指明体积,用好公式n=cV。
(3)在判断溶液中微粒总数时,是否忽视溶剂水。
【例题4】NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。
①1 L 1 ml·L-1的NaClO溶液中含有ClO-的数目为NA( )
②1 L 0.1 ml·L-1氨水含有0.1NA个OH-( )
③常温下,10 L pH=1的硫酸溶液中含有的H+的数目为2NA( )
④常温下,10 L pH=13的NaOH溶液中含有的OH-的数目为NA( )
⑤1.0 L 1.0 ml·L-1的NaAlO2水溶液中含有的氧原子数为2NA( )
⑥1 ml·L-1NaCl溶液含有NA个Na+( )
【答案】①× ②× ③× ④√ ⑤× ⑥×
陷阱五:注意一些可逆反应、特殊反应,记住反应条件、反应物浓度变化对反应的影响。
(1)反应为可逆反应,反应物不能完全转化,如:
2SO2+O22SO3,
N2+3H22NH3。
Cl2+H2OHCl+HClO。
NH3+H2ONH3·H2ONHeq \\al(+,4)+OH-。
2有些物质常温常压下就以聚合分子形式存在。比如2NO2N2O4,2HFHF2。
3有些反应浓度不一样,反应不一样。如铜与硝酸的反应、铜与浓硫酸的反应。
4有些反应反应物的用量不一样,反应不一样。如二氧化碳与碱的反应,碳酸钠与盐酸的反应,石灰水与碳酸氢钠的反应等。
(5)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,浓盐酸浓度降低,反应不再进行。
(6)常温下,铁、铝遇浓硫酸、浓硝酸发生“钝化”。
【例题5】NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)50 mL 12 ml·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA( )
(2)常温下,密闭容器中2 ml NO与1 ml O2充分反应,产物的分子数为2NA( )
(3)常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子( )
(4)一定条件下,用 1.5 ml H2和0.5 ml N2,充分反应后可得到NH3分子数为NA( )
(5)标准状况下,将22.4 L Cl2通入足量水中充分反应转移电子数小于NA( )
【答案】(1)× (2)× (3)× (4)× (5)√
【课后精练】
第I卷(选择题)
1.(2022·浙江·高考真题)为阿伏加德罗常数的值,下列说法正确的是( )
A.中含有个阳离子
B.乙烷和丙烯的混合气体中所含碳氢键数为
C.含有中子数为
D.和于密闭容器中充分反应后,分子总数为
【答案】C
【解析】
A. 由钠离子和硫酸氢根离子构成,其中的阳离子只有钠离子,的物质的量为0.1ml,因此,其中只含有个阳离子,A说法不正确;
B.没有指明气体的温度和压强,无法确定乙烷和丙烯的混合气体的物质的量是多少,因此,无法确定其中所含碳氢键的数目,B说法不正确;
C.分子中有6个中子,的物质的量为0.5ml,因此,含有的中子数为,C说法正确;
D.和发生反应生成,该反应是可逆反应,反应物不能完全转化为生成物,因此,和于密闭容器中充分反应后,分子总数小于,D说法不正确。
综上所述,本题选C。
2.(2022·浙江·高考真题)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA
B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7g MnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C—H键的数目为4NA
【答案】A
【解析】
A.1LpH为12的Ba(OH)2溶液中含有OH-的浓度为0.01ml/L,物质的量0.01ml/L 1L=0.01ml,OH-的数目为0.01NA,A正确;
B.1.8g重水(D2O)的物质的量为:0.09ml,所含质子数为0.9NA,B错误;
C.足量的浓盐酸与8.7gMnO2(0.1ml)反应,+4价Mn转化生成Mn2+,转移电子的数目为0.2NA,C错误;
D.甲醇的结构简式为:CH3OH,32g (1ml)的分子中含有C—H键的数目为3NA,D错误;
答案选A。
3.(2021·福建·高考真题)设为阿伏加德罗常数的值.下列说法正确的是( )
A.所含极性共价键的数目为
B.晶体中阴、阳离子总数为
C.与足量反应生成的分子数为
D.电解熔融制,电路中通过的电子数为
【答案】B
【解析】
A.没有标明气体的存在状态,的物质的量不一定为0.5ml,故A错误;
B.硫酸氢钠晶体中存在钠离子和硫酸氢根离子,硫酸氢钠的摩尔质量为120g/ml,所以12g硫酸氢钠晶体的物质的量为0.1ml,阴、阳离子总数为,故B正确;
C.甲烷与足量氯气反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,因此与足量反应生成的分子数小于,故C错误;
D.电解熔融的氯化镁生成金属镁,镁由+2价降低到0价,因此1ml氯化镁完全电解生成金属镁,转移2ml电子,电解熔融制(物质的量为0.1ml),电路中通过的电子数为,故D错误;
故选B。
4.(2021·海南·高考真题)代表阿伏加德罗常数的值。下列说法正确的是( )
A.中含有的电子数为1.3
B.中含有的共价键的数目为0.1
C.肼含有的孤电子对数为0.2
D.,生成乙烷时断裂的共价键总数为
【答案】C
【解析】
A.1个的电子数为10,故中含有的电子数为1.0,故A错误;
B.的电子式为,含有1个共价键,的物质的量为=0.05ml,故中含有的共价键的数目为0.05,故B错误;
C.肼中每个N原子上各有1个孤电子对,故肼含有的孤电子对数为0.2,故C正确;
D.发生反应时,C=C中的一个键和H-H键都断裂,故生成乙烷时断裂的共价键总数为2,故D错误;
故选C。
5.(2021·湖北·高考真题)NA为阿伏加德罗常数的值。下列说法错误的是( )
A.23g CH3CH2OH中sp3杂化的原子数为NA
B.0.5ml XeF4中氙的价层电子对数为3NA
C.1ml [Cu(H2O)4]2+中配位键的个数为4NA
D.标准状况下,11.2L CO和H2的混合气体中分子数为0.5NA
【答案】A
【解析】
A.中C和O均为杂化,23g乙醇为0.5ml,杂化的原子数为,选项A错误;
B.中氙的孤电子对数为,价层电子对数为,则中氙的价层电子对数为,选项B正确;
C.1个中含有4个配位键,1ml含配位键的个数为,选项C正确;
D.标准状况下。11.2LCO和的混合气体为0.5ml,分子数为,选项D正确。
答案选A。
6.(2021·辽宁·高考真题)下列说法正确的是( )
A.(标准状况)与水充分反应转移电子
B.和均可通过化合反应得到
C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生
D.与溶液反应:
【答案】B
【解析】
A.由于溶于水中的Cl2只有部分与H2O反应,故(标准状况)与水充分反应转移电子数目小于,A错误;
B.根据反应:SO3+H2O=H2SO4,Cu+Cl2CuCl2,故和均可通过化合反应得到,B正确;
C.将蘸有浓氨水和浓盐酸或浓硝酸的玻璃棒相互靠近,有白烟产生,由于浓硫酸难挥发,故不能形成白烟,C错误;
D.由于ClO-具有强氧化性,SO2具有强还原性,故与溶液反应:,D错误;
故答案为:B。
7.(2021·天津·高考真题)设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1ml/L HCl溶液中,HCl分子的数目为NA
B.22.4L氢气中,H2分子的数目为NA
C.180g葡萄糖中,C原子的数目为6NA
D.1ml N2中,σ键的数目为3NA
【答案】C
【解析】
A.体积未知,HCl分子的数目不能计算,故A错误;
B.没有标准状态,不能计算H2分子的数目,故B错误;
C.葡萄糖的分子式为C6H12O6,故180g葡萄糖的分子的物质的量为1ml,C原子的数目为6NA,故C正确;
D.1mlN2中有1mlσ键,故σ键的数目为NA,故D错误;
故选C。
8.(2021·山东·高考真题)X、Y均为短周期金属元素,同温同压下,0.1ml X的单质与足量稀盐酸反应,生成H2体积为V1L;0.1ml Y的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )
A.X、Y生成H2的物质的量之比一定为
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由一定能确定产物中X、Y的化合价
【答案】D
【解析】
设与1ml X反应消耗HCl的物质的量为aml,与1ml Y反应消耗H2SO4的物质的量为bml,根据转移电子守恒以及H原子守恒可知、。
A.同温同压下,气体体积之比等于其物质的量之比,因此X、Y生成H2的物质的量之比一定为,故A正确;
B. X、Y反应过程中消耗酸的物质的量之比为,因,因此,故B正确;
C.产物中X、Y化合价之比为,由B项可知,故C正确;
D.因短周期金属单质与盐酸或稀硫酸反应时,生成的盐中金属元素化合价有+1、+2、+3三种情况,因此存在a=1,2,3,b=0.5,1的多种情况,由可知,当a=1,b=0.5时,=1,当a=2,b=1时,=1,两种情况下X、Y的化合价不同,因此根据可能无法确定X、Y的化合价,故D错误;
综上所述,错误的D项,故答案为D。
9.(2021·浙江·高考真题)设为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,中含有中子数为
B.(分子结构:)中的共价键数目为
C.的水溶液中含有氧原子数为
D.三肽(相对分子质量:189)中的肽键数目为
【答案】C
【解析】
A.标准状况下,的物质的量为:0.05ml,一个中含有中子数为:个,所以中含有中子数为,A正确;
B.的物质的量为:0.25ml,根据白磷的分子结构可知一个白磷分子里含有六条共价键,所以共价键数目为:,B正确;
C.的水溶液中含有溶质氢氧化钠和溶剂水,氧原子数目为二者氧原子数目的加和,C错误;
D.三肽的物质的量为:0.1ml,三分子氨基酸脱水缩合形成三肽,三肽中含有两个肽键,所以三肽中的肽键数目为,D正确;
答案为:C。
10.(2021·广东·高考真题)设为阿伏加德罗常数的值。下列说法正确的是( )
A.含有键的数目为
B.的盐酸含有阴离子总数为
C.与混合后的分子数目为
D.与足量反应生成的分子数目为
【答案】A
【解析】
A.1个分子中含有3个键,微粒个数与物质的量成正比,故含有3ml键,键的数目为,A正确;
B.盐酸为氯化氢的水溶液,氯化氢会全部电离出阴离子Cl-,水会部分电离出阴离子OH-,水的质量及电离程度未知,故无法计算的盐酸含有阴离子总数,B错误;
C.未提到具体的温度、压强(如标况下),故无法计算与混合后的分子数目,C错误;
D.为1ml,钠与足量的水反应生成氢气的关系式为:,故1ml Na应对应生成0.5ml H2,分子数目应为0.5,D错误;
故选A。
11.(2021·全国·高考真题)为阿伏加德罗常数的值。下列叙述正确的是( )
A.重水()中含有的质子数为
B.的与完全反应时转移的电子数为
C.环状( )分子中含有的键数为
D.的溶液中离子数为
【答案】C
【解析】
A.的质子数为10,18g的物质的量为 0.9ml, 则重水()中所含质子数为,A错误;
B.与反应的化学方程式为:3NO2+H2O=2HNO3+NO,该反应消耗3个NO2分子转移的电子数为2个,则有3ml的NO2参与反应时,转移的电子数为,B错误;
C.一个( )分子中含有的键数为8个,32gS8的物质的量为ml,则含有的键数为,C正确;
D.酸性溶液中存在:,含Cr元素微粒有和,则的溶液中离子数应小于,D错误;
故选C。
12.(2021·河北·高考真题)NA是阿伏加德罗常数的值,下列说法错误的是( )
A.22.4L(标准状况)氟气所含的质子数为18NA
B.1ml碘蒸气和1ml氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1L 1ml•L-1溴化铵水溶液中NH与H+离子数之和大于NA
【答案】C
【解析】
A.在标准状况下氟气的物质的量为1ml,其质子数为1ml=,A正确;
B.碘蒸气与氢气发生的反应为:,反应为可逆反应,有一定的限度,所以充分反应,生成的碘化氢分子数小于,B正确;
C.电解饱和食盐水时电极总反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,若阴阳两极产生气体分别是氢气与氯气,且物质的量之比为1:1,若气体的总质量为,则说明反应生成的氢气与氯气的物质的量各自为1ml,根据关系式H22e-可知,转移的电子数为,C错误;
D.溴化铵水溶液存在电荷守恒,即c()+c()=c(Br-)+c(OH-),则物质的量也满足n()+n()=n(Br-)+n(OH-),因为n(Br-)=,所以该溶液中与离子数之和大于,D正确;
故选C。
13.(2021·湖南·高考真题)为阿伏加德罗常数的值。下列说法正确的是( )
A.含有的中子数为
B.溶液中含有的数为
C.与在密闭容器中充分反应后的分子数为
D.和(均为标准状况)在光照下充分反应后的分子数为
【答案】D
【解析】
A.的物质的量为=0.9ml,1个含0+(18-8)=10个中子,则含有的中子数为,A错误;
B.未给溶液体积,无法计算,B错误;
C.存在2NO+O2=2NO2,2NO2N2O4,因此与在密闭容器中充分反应后的分子数小于,C错误;
D.甲烷和氯气在光照下发生取代,1ml氯气可取代1mlH,同时产生1mlHCl分子,标准状况下的物质的量为0.5ml,的物质的量为1ml,0.5mlCH4含4mlH,最多可消耗4mlCl2,因此CH4过量,根据1ml氯气可取代1mlH,同时产生1mlHCl分子可知1mlCl2完全反应可得1mHCl,根据C守恒,反应后含C物质的物质的量=甲烷的物质的量=0.5ml,因此和(均为标准状况)在光照下充分反应后的分子数为,D正确;
选D。
14.(2021·浙江·高考真题)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 ml NH4F晶体中含有的共价键数目为3NA
B.CH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NA
C.向100mL 0.10ml·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA
D.0.1 ml CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA
【答案】C
【解析】
A.NH4F结构中只有铵根中含有4个共价键,则l ml NH4F晶体中含有的共价键数目为4NA,A错误;
B.CH4和C2H4混合气体2.24L(标准状况)的物质的量是0.1ml,由于1ml CH4和C2H4分别完全燃烧消耗氧气的物质的量分别是2ml、3ml,则0.1ml混合气体完全燃烧消耗氧气的分子数目应该介于0.2NA和0.3NA之间,B错误;
C.l00 mL0.10 ml/L FeCl3溶液中铁离子的物质的量是0.01ml,加入足量Cu粉充分反应,铁离子被还原为亚铁离子,则转移电子数目为0.01NA,C正确;
D.乙酸和乙醇的酯化反应是可逆反应,则0.1 ml CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目小于0.1NA,D错误;
答案选C。
15.(2012·江苏·高考真题)设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,18g H2O中含有的原子总数为3NA
B.标准状况下,0.1ml Cl2溶于水,转移的电子数目为0.1NA
C.标准状况下,11.2L CH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA
【答案】A
【解析】
A.常温常压下,18gH2O的物质的量为1ml,一个分子中含有3个原子,则含有的原子总数为3NA,A说法正确;
B.标准状况下,0.1mlCl2溶于水,少量的氯气与水反应,则转移的电子数目无法确定,B说法错误;
C.标准状况下,CH3CH2OH为液体,则11.2LCH3CH2OH的物质的量大于0.5ml,则含有的分子数目大于0.5NA,C说法错误;
D.常温常压下,气体摩尔体积大于22.4L/ml,则2.24LCO和CO2混合气体的物质的量小于0.1ml,则含有的碳原子数目小于0.1NA,D说法错误;
答案为A。
16.(2022·河北衡水中学高三阶段练习)2021年,我国科学家首次在实验室实现CO2到淀粉的全合成,其合成路线如图:
设NA为阿伏加德罗常数,下列有关说法错误的是( )
A.标准状况下,11.2L CO2含有共用电子对数目为2NA
B.反应②中,3.2g CH3OH生成HCHO时转移电子数目为0. 2NA
C.0.1 ml DHA中含有碳原子数目为0.3NA
D.1 ml DHA与乙酸发生取代反应,可消耗乙酸分子数目为NA
【答案】D
【解析】
A.CO2的结构式为O=C=O,标况下11.2L CO2中含有共用电子对数目为0.5ml×4×NA=2NA,故A正确;
B.反应②中,3.2g CH3OH生成HCHO时转移电子数目为×2×NA=0.2NA,故B正确;
C.由DHA的键线式可知其分子式为,0.1 ml DHA中含有碳原子数目为0.3NA,故C正确;
D.DHA含有2个羟基,1ml DHA与乙酸发生取代反应,可消耗2ml乙酸即2NA,故D错误;
故选:D。
17.(2022·四川·射洪中学模拟预测)NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.室温下,1L pH= 13的Ba(OH)2溶液中阴离子数为0.1 NA
B.5.6g铁粉与足量水蒸气完全反应转移的电子数为0.2 NA
C.标准状况下,11.2L NO与5.6LO2混合后分子总数为0.5 NA
D.120g熔融NaHSO4中含有的离子总数为3NA
【答案】A
【解析】
A.常温下,1L pH= 13的Ba(OH)2中阴离子为OH-,pH=13的溶液中氢氧根离子浓度为0.1ml/L,则1L该溶液中含有0.1ml氢氧根离子,含有的OH-离子数目为0.1NA,A正确;
B.5.6g铁的物质的量为n==0.1ml,而铁和水蒸气反应,Fe化合价由0价变为+2价和+3价,其中1个+2价和2个+3价,故0.1mlFe失去NA电子,B错误;
C.标准状况下,11.2LNO物质的量为=0.5ml,5.6LO2物质的量为=0.25ml,混合后发生反应2NO+O2=2NO2;依据反应的定量关系一氧化氮和氧气恰好反应生成二氧化氮气体物质的量为0.5ml,但二氧化氮和四氧化二氮气体存在化学平衡2NO2⇌N2O4;所以分子数小于0.5ml,C错误;
D.120gNaHSO4固体的物质的量为1ml,而NaHSO4固体由钠离子和硫酸氢根离子构成,故1mlNaHSO4固体中含2ml离子即2NA,D错误;
故选A。
18.(2022·广东实验中学三模)若用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.142g Na2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
B.锌与某浓度的浓硫酸反应,生成SO2和H2的混合气体22.4 L(标准状况),锌失去电子数目为2NA
C.标准状况下,22.4L甲烷和乙烯混合物中含碳氢共价键数目为4NA
D.0.1ml•L﹣1的CH3COONH4溶液显中性,1L该溶液中含CH3COO-数等于0.1NA
【答案】D
【解析】
A. Na2HPO4中含有2个Na+和1个,142g固体中,则阴阳离子总数目为3NA。Na2SO4中含有2个Na+和1个,142g固体中,则阴阳离子总数目为3NA。A项正确;
B.反应中关系式为SO2~2e-、H2~2e-,则电子的总物质的量为2[n(SO2)+ n(SO2)]=2ml,反应中转移的电子总数目为2NA,B项正确;
C.关系是有CH4~4C-H、CH2=CH2~4C-H,则n(C-H)=4n(CH4)+ 4n(CH2=CH2)=4ml,C-H的总数目为4NA,C项正确;
D.溶液中CH3COO-发生水解,得到的物料守恒式为c(CH3COOH)+c(CH3COO-)=0.1ml/l,1L该溶液中含CH3COO-数小于0.1NA
D项错误;
故选D。
19.(2022·湖北·襄阳四中模拟预测)NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L 正戊烷、异戊烷、新戊烷混合物含有共价键数为16 NA
B.1ml Na2O2与CaCl2固体混合物中所含阴离子数目大于NA
C.lml CH2Cl2分子中孤电子对数为4NA
D.1L 1ml·L-1氯化铵水溶液中与H+离子数之和等于NA
【答案】B
【解析】
A.标准状况下,正戊烷和新戊烷不是气体,无法使用22.4L/ml计算物质的量,A项错误;
B. 若1ml全是 Na2O2含阴离子数目为1NA,若1ml全是CaCl2含阴离子数目为2NA,所以混合物中阴离子数目大于NA小于2NA,B项正确;
C. CH2Cl2中只有氯原子含有孤电子对,每个氯原子含有三对孤电子对,所以lml CH2Cl2分子中孤电子对数为6NA,C项错误;
D.1L1ml•L-1氯化铵水溶液中,氯离子的物质的量为1ml,由电荷守恒可知,故溶液中与H+离子数之和大于NA,D项错误;
故答案选:B。
20.(2022·重庆市育才中学模拟预测)光合作用可表示为。若代表阿伏加德罗常数的值,下列叙述正确( )
A.中含有的质子数为
B.中含有的共用电子对数为
C.产生需消耗的分子数为
D.产生(标准状况)转移的电子数为
【答案】C
【解析】
A.中含有的质子数为:(6+8+8)NA=22NA,A错误;
B.1分子水中氢原子和氧原子之间共2对共用电子对,1ml水中有共用电子对数2NA,B错误;
C.产生90g,物质的量为0.5ml,根据方程式可知消耗水的分子数为:,C正确;
D.生成1mlO2转移4ml电子,故产生22.4L (标准状况)O2转移的电子数为4NA,D错误;
故选C。
21.(2022·辽宁沈阳·三模)为阿伏加德罗常数的值,下列说法正确的是( )
A.反应中,每生成释放的中子数为
B.电解精炼铜时,若转移了个电子,阳极溶解铜
C.将一定量的通入溶液中,当有转化为时,转移电子总数为
D.标准状况下,庚烷中所含的分子数约为
【答案】A
【解析】
A.反应中,每生成释放的中子数=(48+249-294)=,故A正确;
B.电解精炼铜时,由于阳极存在锌、铁等金属杂质,转移个电子时,阳极溶解铜的质量小于,故B错误;
C.将一定量的Cl2通入FeBr2溶液中,由于还原性Fe2+>Br-,Cl2先氧化Fe2+,然后氧化Br-,故当有1ml Br-转化为Br2时,Fe2+已被完全氧化,则转移的电子数大于NA,故C错误;
D.标况下庚烷为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误;
故答案选A。
22.(2022·安徽安徽·模拟预测)已知叠氮酸(HN3)为一元弱酸。若表示阿伏加德罗常数的值,下列说法不正确的是( )
A.叠氮酸(HN3)的摩尔质量为43g/ml
B.等物质的量的Na3N和NaN3中含有阴离子数相等
C. 的HN3与足量Mg反应产生H2的分子数远大于
D.向 溶液中滴入NaOH溶液至中性,溶液中Na+数目为0.1
【答案】D
【解析】
A.叠氮酸(HN3)的相对分子质量为1+3×14=43,故其摩尔质量为43g/ml,A正确;
B.已知Na3N是由Na+和N3-组成,而NaN3则是由Na+和,故等物质的量的Na3N和NaN3中含有阴离子数相等,B正确;
C.由于HN3是一元弱酸,随着反应的进行,HN3能够继续电离出H+,故的HN3与足量Mg反应产生H2的分子数远大于=,C正确;
D.向溶液中滴入NaOH溶液至Na+数目为0.1时,即溶液中的溶质为NaN3,此时溶液因水解使溶液呈碱性,即至中性溶液时,所加NaOH的量小于0.1ml,即Na+的数目小于0.1NA,D错误;
故答案为:D。
23.(2022·辽宁大连·二模)84消毒液不能和医用酒精混用的原因是。设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中数目为
B.中含有σ键数目为
C.标准状况下,中原子数为
D.室温下,为13的溶液中数目为
【答案】B
【解析】
A.溶液中NaClO物质的量为0.2ml,由于次氯酸根水解,因此数目小于,故A错误;
B.一分子乙醇含有σ键8个,物质的量为0.5ml,含有σ键数目为,故B正确;
C.标准状况下,是非气态物质,无法计算物质的量,故C错误;
D.室温下,为13的溶液的体积未知,无法计算物质的量,故D错误。
综上所述,答案为B。
24.(2022·湖北·枣阳一中模拟预测)NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.5ml SF6中硫的价层电子对数为3NA
B.1L pH 值等于4的0.1ml·L-1的 K2Cr2O7溶液中含有 Cr2O数为 0.1NA
C.含2ml共价键的水蒸气,分子间存在2NA个氢键
D.密闭容器中 1 ml PCl3与 1 ml Cl2反应制备PCl5(g),增加2NA个P-Cl键
【答案】A
【解析】
A.SF6中心硫原子的价层电子对数=6+,所以0.5mlSF6中硫的价层电子对数为0.5ml×6×NA=3NA,A正确;
B.重铬酸根离子能与水反应生成铬酸根离子,所以1L pH 值等于4的0.1ml·L-1的 K2Cr2O7溶液中含有 Cr2O数为 0.1NA的数目小于0.1NA,B错误;
C.水蒸气分子间几乎不存在氢键,C错误;
D.PCl3与Cl2生成PCl5的反应为可逆反应,则生成PCl5的物质的量小于1ml,增加的P-Cl键小于2NA,D错误;
故选A。
25.(2022·重庆·西南大学附中三模)为阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.1ml/L的溶液中含有的数目为
B.0.5ml雄黄(,结构如图)含有个键
C.化学反应中每生成1ml转移电子数一定为
D.常温常压下,体积为22.4L的所含分子数为
【答案】B
【解析】
A.溶液体积不明确,故溶液中的数目无法计算,故A错误;
B.由于As和N同主族,所以要达到8电子稳定结构,需形成3个共价键,而S需形成2个共价键,所以黑色球为As,白色球为S,分子中不存在S-S键,0.5ml雄黄As4S4含有NA个As-As键,故B正确;
C.2ml过氧化钠与水反应生成1ml氧气,转移2ml电子,转移电子数不一定为,故C错误;
D.常温常压,Vm≠22.4L/ml,Vm未知无法计算物质的量,故D错误;
故选:B。
第II卷(非选择题)
26.(2010·江苏南通·一模)下列叙述中完全正确的是______。
①常温常压下,1 ml甲基(—CH3)所含的电子数为10NA
②1ml含8个碳原子的某烃分子,最多形成8ml碳碳单键
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA
⑤1 ml C10H22分子中共价键总数为31 NA
⑥1 ml Cl2发生反应时,转移的电子数一定是2NA
⑦室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
⑧标准状况下,测得一定量的铜与浓硝酸反应后生成22.4 L的气体,则被还原的硝酸的分子数一定等于NA
⑨精炼铜过程中阳极减轻6.4g时,电路中转移电子数是0.2NA
⑩常温常压下,2.24L四氯化碳中所含氯原子数大于0.4NA
⑪在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
【答案】④⑤⑦⑩
【解析】
①1ml甲基(-CH3)中含有9ml电子,所含的电子数为9NA,故①错误;
②1ml含8个碳原子的某烃分子,最多形成12ml碳碳单键,如分子式为C8H8的立方烷,故②错误;
③反应后的体系中还存在NO2与N2O4的转化,所以得到的分子数应略小于0.75NA,故③错误;
④过氧化钡(BaO2)是由过氧根离子和钡离子构成,两个氧形成一个过氧根离子,所以阴、阳离子之比为1:1,其摩尔质量为169g/ml,16.9g 过氧化钡(BaO2)的物质的量为0.1ml,所以阴、阳离子总数为0.2NA,故④正确;
⑤1ml C10H22分子中含有9ml碳碳键、22ml碳氢键,总共含有31ml共价键,含有的共价键总数为31NA,故⑤正确;
⑥氯气只作氧化剂时,1 ml Cl2发生反应,转移的电子为2ml,但在发生歧化反应时,情况就有所不同了,例如,氯气与氢氧化钠反应时,1ml Cl2发生反应时,转移的电子为1ml,故⑥错误;
⑦乙烯和丙烯的最简式相同,都为CH2,则42.0g乙烯和丙烯的混合气体中含有的碳原子的物质的量为=3ml,所以含有的碳原子数为3NA,故⑦正确;
⑧反应的方程式有:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O,若有1ml的Cu反应,标准状况下产生22.4LNO2即1ml。则被还原的硝酸为1ml,但若铜过量,硝酸变稀后反应生成NO,则被还原的硝酸的物质的量小于1ml,故⑧错误;
⑨电解精炼铜时阳极电极反应Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,Ni-2e-=Ni2+,阴极电极反应为Cu2++2e-=Cu,若阴极得到电子数为0.2NA个,依据电子守恒,阳极失去的电子物质的量为0.2ml,为几种金属共失去的电子,不是铜失电子物质的量,固体质量减少不是6.4g,故⑨错误;
⑩常温下,四氯化碳为液体,无法计算2.24L四氯化碳的物质的量,故⑩错误;
⑪H2O2中O元素是-1价,所以每生成32g氧气,转移2NA个电子,故⑪错误;
正确的有④⑤⑦⑩。
27.(2021·浙江·高三专题练习)判断正误:
(1)常温常压下,3.2gO2所含的原子数为0.2NA___________
(2)标准状况下,18gH2O所含的氧原子数目为NA___________
(3)室温下,1mlCH4中含有5NA原子___________
(4)常温常压下,1mlCO2与SO2的混合气体中含氧原子数为2NA___________
(5)2g石墨晶体中,含有的质子数目为6NA___________
(6)2mlSO2和1mlO2在一定条件下充分反应后,混合物的分子数为2NA___________
(7)密闭容器中2amlNO与amlO2充分反应,产物的分子数为2aNA___________
(8)标准状况下,0.1mlCl2溶于水,转移的电子数目为0.1NA___________
(9)1L0.1ml·L-1的氨水中有NA个NH___________
(10)向含4mlHCl的浓盐酸中,加入足量的MnO2,加热,充分反应后,生成NA个Cl2___________
(11)用含有1mlFeCl3的溶液充分反应后得的Fe(OH)3胶体中含有NA个Fe(OH)3胶粒___________
【答案】正确 正确 正确 正确 错误 错误 错误 错误 错误 错误 错误
【解析】
(1)常温常压下,3.2gO2所含的原子数为=0.2NA,正确;
(2)标准状况下,18gH2O所含的氧原子数目为=NA,正确;
(3)室温下,1mlCH4中含有5NA原子,正确;
(4)常温常压下,1mlCO2与SO2的混合气体中含氧原子数为2NA,正确;
(5)2g石墨晶体中,含有的质子数目为=NA,错误;
(6)2mlSO2和1mlO2的反应为可逆反应,混合物的分子数不等于2NA,错误;
(7)密闭容器中2amlNO与amlO2充分反应生成2amlNO2,但是2NO2N2O4,产物的分子数不为2aNA,错误;
(8)标准状况下,Cl2溶于水是可逆反应,转移的电子数目不为0.1NA,错误;
(9)氨水是一元弱碱,部分电离,错误;
(10)浓盐酸变稀溶液后不再反应,不会生成NA个Cl2,错误;
(11)胶粒是多个分子的聚集体,错误;
28.(2021·浙江·高三专题练习)正误判断
(1)1 ml·L-1 NaCl溶液是指此溶液中含有1 ml NaCl______
(2)用100 mL水吸收0.1 ml HCl气体所得溶液的物质的量浓度恰好是1 ml·L-1______
(3)1 L水中溶解5.85 g NaCl所形成的溶液的物质的量浓度是0.1 ml·L-1______
(4)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25%______
(5)将40 g SO3溶于60 g水中所得溶质的质量分数为49%______
(6)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3∶2∶1,则浓度之比为3∶2∶3______
(7)0.5 ml·L-1的稀H2SO4溶液中c(H+)为1.0 ml·L-1______
(8)1.0 L 1.0 ml·L-1的NaAlO2水溶液中含有的氧原子数为2NA______
(9)2 L 0.5 ml·L-1硫酸钾溶液中阴离子所带电荷数为NA______
(10)欲配制1.00 L 1.00 ml·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中______
(11)1 ml·L-1NaCl溶液含有NA个Na+______
(12)常温下,1 L 0.1 ml·L-1的NH4NO3溶液中氮原子数为0.2NA______
(13)含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 ml·L-1 ______
【答案】错 错 错 错 对 错 对 错 错 错 错 对 错
【解析】
(1)1 ml·L-1 NaCl溶液是指此1L该溶液中含有1 ml NaCl,该说法错误;
(2)100 mL水吸收0.1 ml HCl气体所得溶液体积不是100mL,因此无法计算浓度,该说法错误;
(3)1 L水中溶解5.85 g NaCl所形成的溶液体积不是1L,因此无法计算浓度,该说法错误;
(4)25 g CuSO4·5H2O中CuSO4的质量为160g/ml×=16g,溶于75 g水中所得溶质的质量分数为=16%,该说法错误;
(5)40 g SO3的物质的量为=0.5ml,SO3+H2O=H2SO4,生成H2SO4的物质的量也是0.5ml,质量为0.5ml×98g/ml=49g,H2SO4的质量分数为=49%,该说法正确;
(6)同浓度的Na2SO4、MgSO4、Al2(SO4)3,浓度之比为1×1∶1×1∶1×3=1:1:3,该说法错误;
(7)0.5 ml·L-1的稀H2SO4溶液中c(H+)=2×0.5 ml·L-1=1 ml·L-1,该说法正确;
(8)1.0 L 1.0 ml·L-1的NaAlO2水溶液中有大量的H2O,H2O中也含有O,但这些H2O的物质的量未知,无法计算O的数目,该说法错误;
(9)2 L 0.5 ml·L-1硫酸钾溶液中阴离子为,所带电荷数的物质的量为2×2 L×0.5 ml·L-1=2ml,电荷数为2NA,该说法错误;
(10)58.5 g NaCl溶于1.00 L水中,溶液的体积不是1L,因此浓度不是1ml/L,该说法错误;
(11)1 ml·L-1NaCl溶液体积未知,无法计算物质的量,该说法错误;
(12)1 L 0.1 ml·L-1的NH4NO3溶液中NH4NO3的物质的量为1 L ×0.1 ml·L-1=0.1ml,故氮原子数为0.2NA,该说法正确;
(13) 含NA个Na+的Na2O溶解于1 L水中,溶液体积不是1L,无法计算浓度,该说法错误。
29.(2021·全国·高三专题练习)用NA表示阿伏加德罗常数,判断下列说法是否正确。
(1)在常温常压下,18 g H2O与18 g D2O所含电子数均为10NA___________
(2)17 g —OH与17 g OH-所含电子数均为10NA___________
(3)30 g SiO2中含有硅氧键个数为NA___________
(4)32g甲醇中所含共价键数目为5NA___________
(5)常温常压下,32gO2和O3的混合气体中含有的原子数为2NA___________
(6)56 g乙烯中所含共用电子对数目为12NA___________
(7)78 g苯中含有3NA碳碳双键___________
(8)60℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6NA___________
【答案】错 错 错 对 对 对 错 对
【解析】
(1)在常温常压下,18 g H2O所含电子数为10NA,与18 g D2O所含电子数为=9NA,故错误;
(2)17 g OH-所含电子数为10NA,17 g —OH所含电子数为9NA,故错误;
(3)每个硅原子都以单键与周围的四个氧原子直接相连,30 g SiO2中含有硅氧键个数为2NA,故错误;
(4)32g甲醇(物质的量为1ml)中所含共价键数目为5NA,故正确;
(5)直接计算氧原子的物质的量,常温常压下,32gO2和O3的混合气体中含有氧原子的物质的量为2ml,所含有的原子数为2NA,故正确;
(6)乙烯中碳碳双键是两对共用电子对,乙烯分子中共用电子对数目为6个,56 g乙烯(物质的量为2ml)中所含共用电子对数目为12NA,故正确;
(7)苯分子中不含碳碳双键,含有特殊的碳碳键,故错误;
(8)混合气体抽出特定组合“NO2”,其摩尔质量为46 g·ml-1,故正确。
30.(2021·全国·高三专题练习)用NA表示阿伏加德罗常数,判断下列说法是否正确。
(1)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA___________
(2)0.1 ml Zn与含0.1 ml HCl的盐酸充分反应,转移的电子数目为0.2NA___________
(3)1 ml Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA_____
(4)1 ml Na2O2与足量CO2充分反应转移的电子数为2NA___________
(5)向FeI2溶液中通入适量Cl2,当有1 ml Fe2+被氧化时,共转移电子的数目不小于3NA___________
(6)1 ml Cl2参加反应转移电子数一定为2NA___________
(7)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA___________
(8)0.3 ml NO2与足量的水反应转移电子数目为0.2NA___________
【答案】错 错 对 错 对 错 对 对
【解析】
(1)当铁粉过量时生成Fe2+,故错;
(2)盐酸不足,Zn不能完全反应,故错;
(3)不论是哪种氧化物,钠均是从0价变为+1价,转移的电子数为NA,故对;
(4)该反应为Na2O2中-1价氧元素的歧化反应,1 ml Na2O2反应转移1 ml电子,故错;
(5)I-的还原性比Fe2+强,Cl2首先氧化I-,故对;
(6)1 ml氯气与水、碱发生歧化反应时转移电子数为NA,故错;
(7)1 ml Cl2与足量镁反应得到2 ml电子,常温常压下,22.4 L Cl2的物质的量小于1 ml,故对;
(8)由3NO2+H2O=2HNO3+NO知,3 ml NO2转移2 ml e-,故0.3 ml NO2转移0.2 ml e-,故对。
反应
物质变化量
转移电子的物质的量或数目
Na2O2+CO2 (或H2O)
1 ml Na2O2
1 ml或NA
1 ml O2
2 ml或2NA
Cl2+NaOH
1 ml Cl2
1 ml或NA
Cl2+Fe
1 ml Cl2
2 ml或2NA
1 ml Fe
3 ml或3NA
第2题 阿伏加德罗常数NA-2024年高考化学专题复习: 这是一份第2题 阿伏加德罗常数NA-2024年高考化学专题复习,共21页。试卷主要包含了5NA,NA是阿伏加德罗常数的值等内容,欢迎下载使用。
新高考化学一轮复习讲义 第2章 第7讲 包罗万象的阿伏加德罗常数(NA): 这是一份新高考化学一轮复习讲义 第2章 第7讲 包罗万象的阿伏加德罗常数(NA),共13页。试卷主要包含了全面,扎实训练学科基本技能,培养学生积极的学习态度,有计划等内容,欢迎下载使用。
01 阿伏加德罗常数(NA)(附答案解析)-备战高考化学大二轮专题突破系列(全国通用): 这是一份01 阿伏加德罗常数(NA)(附答案解析)-备战高考化学大二轮专题突破系列(全国通用),共16页。












