


人教版九年级下册课题2 酸和碱的中和反应优秀第2课时达标测试
展开浓度为1%的盐酸,和浓度为10%的盐酸哪个酸性更强呢?你能用什么方法区分两种溶液呢?石蕊可以吗?
不能。石蕊只能判断溶液是酸性还是碱性(酸碱性),不能指示溶液酸碱强弱的程度。
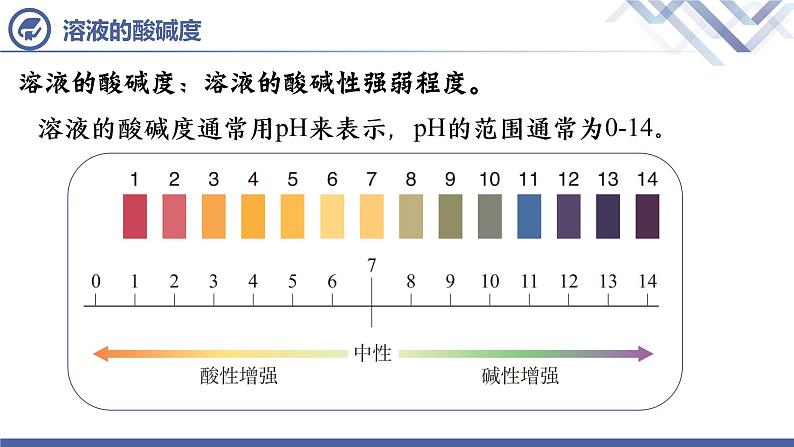
溶液的酸碱度:溶液的酸碱性强弱程度。
溶液的酸碱度通常用pH来表示,pH的范围通常为0-14。
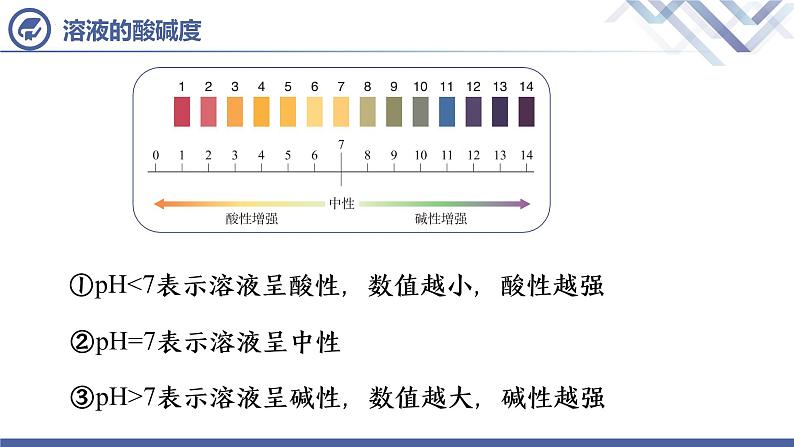
①pH<7表示溶液呈酸性,数值越小,酸性越强
②pH=7表示溶液呈中性
③pH>7表示溶液呈碱性,数值越大,碱性越强
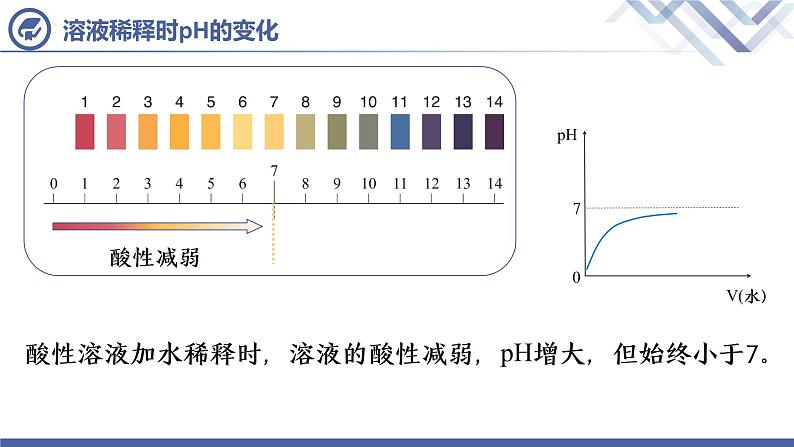
酸性溶液加水稀释时,溶液的酸性减弱,pH增大,但始终小于7。
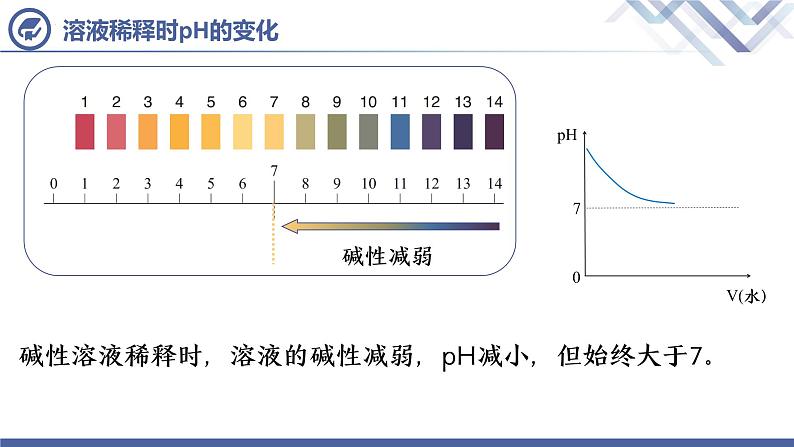
碱性溶液稀释时,溶液的碱性减弱,pH减小,但始终大于7。
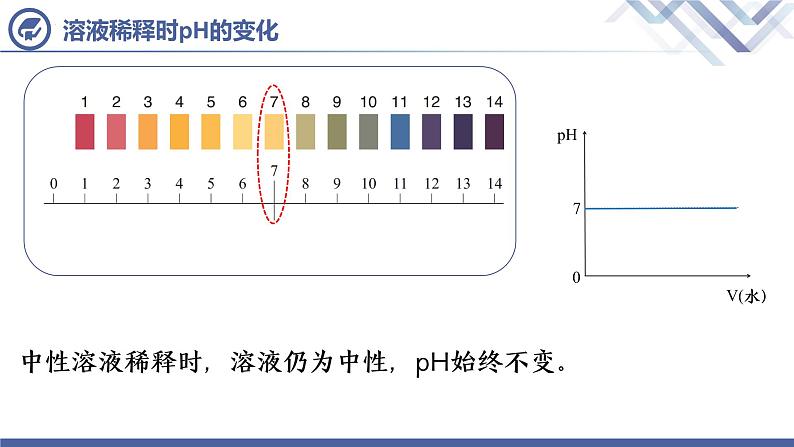
中性溶液稀释时,溶液仍为中性,pH始终不变。
在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取待测溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。
1.测定溶液的pH时,能否将pH试纸润湿?对测定结果有什么影响?
不能将pH试纸润湿。否则会导致测定酸性溶液的pH偏大,测定碱性溶液的pH偏小。
2. 能否将pH试纸直接放入溶液中测量?
不能。会污染瓶中的试剂。
3. 读数时间通常要在30S之内,时间不能过长,为什么?
时间长了,水蒸发导致试纸变色,读出的数值不准确。
不能。用pH试纸测得的pH为0~14的整数,不能估读。要精确测定溶液的pH,可用pH计。
4. pH试纸能否精确测量溶液的酸碱度?
中和反应时溶液的pH的变化
1. 向酸溶液中滴加碱溶液时,溶液的pH逐渐升高
2. 向碱溶液中滴加酸溶液时,溶液的pH逐渐降低
4. 两溶液刚好中和时的点附近,溶液 pH 变化较快。
3. C点表示酸和碱恰好完全中和,此时pH为7
测定生活中一些物质的pH(可根据实际情况选择生活中的一些物质进行实验)
1.化工生产中许多反应必须在一定pH溶液里才能进行
2.在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长
若土壤呈酸性或碱性则需进行改良
3.测定雨水的pH,可以了解空气的污染情况;
正常雨水(因为溶有CO2)的pH约为5.6,酸雨是指pH小于5.6的雨水。
SO2 、NO2会导致酸雨的产生
4.测定人体内或排出的液体的pH,可以了解人体的健康状况。
探究洗发剂和护发剂的酸碱性
洗发剂和护发剂的酸碱性 头发的主要成分是蛋白质,容易受碱性溶液的侵蚀。选择几种平常使用的洗发用品(洗发剂、护发剂或洗护合一的洗发液),测一测它们的pH。
根据实验及所学知识,讨论∶
3.从清洁效果和保护头发的角度考虑,你认为怎样选择洗发用品比较好。为什么?
2.有的洗发用品分为洗发剂(洗发香波)和护发剂(护发素)。洗发时,在用过洗发剂后再使用护发剂,这样对头发有保护作用。你能解释这是为什么吗?
1.一般情况下,我们使用的洗发用品是酸性的还是碱性的?
头发的主要成分是蛋白质,容易受碱性溶液的侵蚀.所以我们洗发时,在用过洗发剂后再使用弱酸性的护发剂,这样对头发有保护作用.
1 、现有如下三种物质∶①pH试纸 ②无色酚酞溶液 ③紫色石蕊溶液,其中能用于鉴别盐酸和氢氧化钠溶液的是: 。
2、用 pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较的结果是: A. 偏低 B. 偏高 C.相等 D.无法比较
3、某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确 的是: A.用pH试纸润湿后再测定溶液的酸碱度 B.用pH试纸直接蘸取待测溶液 C.用普通pH试纸测得石灰水的pH=9.5 D.用pH试纸测得盐酸的pH=1
4、不同物质的酸碱性不同,根据表中各物质的pH,判断下列说法 正确的是:
A.pH<7的溶液一定是酸溶液 B.pH>7的溶液一定是碱溶液C.pH=7的溶液一定是盐溶液 D.盐溶液可能显酸性、碱性或中性
5、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图示。 (1)该实验操作是将 滴加到 溶液中。(2) 当加入溶液的质量为a g时,所得溶液中的溶质为 。(3)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
NaOH+HCl=NaCl+H2O
1.溶液酸碱度可用 pH 来表示(1)pH 范围:0~14(2)pH 和溶液酸碱性的关系: pH<7,溶液呈酸性,pH 越小,酸性越强 pH=7,溶液呈中性 pH>7,溶液呈碱性,pH 越大,碱性越强(3)测定溶液 pH 的方法2.了解溶液酸碱度的意义
人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应精品第2课时当堂达标检测题: 这是一份人教版九年级下册<a href="/hx/tb_c9871_t7/?tag_id=28" target="_blank">第十单元 酸和碱课题2 酸和碱的中和反应精品第2课时当堂达标检测题</a>,文件包含酸和碱的中和反应第2课时pptx、用pH试纸测定溶液的pHmp4、身边一些物质的pHmp4等3份试卷配套教学资源,其中试卷共0页, 欢迎下载使用。
人教版课题2 酸和碱的中和反应第2课时课堂检测: 这是一份人教版<a href="/hx/tb_c9871_t7/?tag_id=28" target="_blank">课题2 酸和碱的中和反应第2课时课堂检测</a>,文件包含课题2酸和碱的中和反应第2课时分层练习原卷版docx、课题2酸和碱的中和反应第2课时分层练习解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
初中化学人教版九年级下册课题2 酸和碱的中和反应第1课时课后作业题: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t7/?tag_id=28" target="_blank">课题2 酸和碱的中和反应第1课时课后作业题</a>,文件包含课题2酸和碱的中和反应第1课时分层练习原卷版docx、课题2酸和碱的中和反应第1课时分层练习解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。














