



鲁科版 (2019)必修 第二册第2节 元素周期律和元素周期表授课ppt课件
展开物质世界尽管丰富多彩、变化无穷,但一切物质都是由元素组成的。人类在长期的生产活动和科学实验中,逐渐认识了元素间的内在联系和元素性质变化的规律性,并以一定的方式将它们表示出来。
目前已经发现的元素有110多种。在元素周期表中,元素是有序排列的。你是否想过 :元素为什么会按照这样的顺序在元素周期表中排列?它们之间存在着什么关系?人们是怎样描述这种关系的?
原子序数是元素在元素周期表中的序号,其数值等于原子核内的质子数或原子核外的电子数。研究原子序数为1~18的元素,可以帮助我们认识元素之间的内在联系和元素性质变化的规律性。
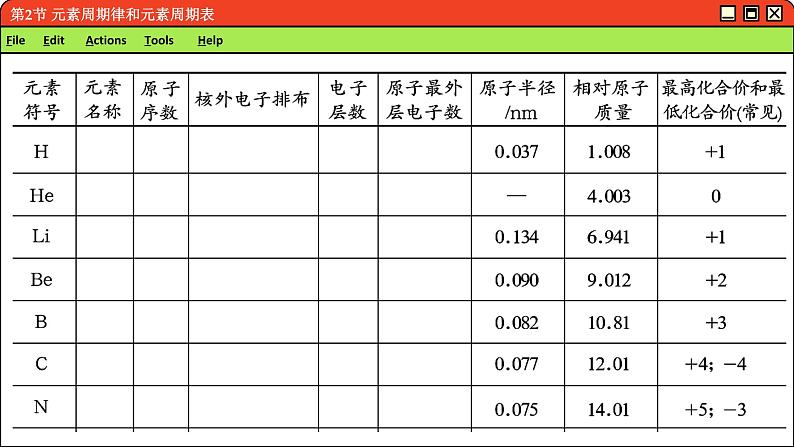
元素周期律初探1.下表所列的是部分元素的有关信息,请将表中所缺内容补充完整
2。请对表中的各项内容进行比较、分析,寻找其中的规律(1)以元素的原子序数为横坐标、原子的最外层电子数为纵坐标,绘出柱状图
(2)以元素的原子序数为横坐标、元素的原子半径为纵坐标,绘出折线图。
(3)以元素的原子序数为横坐标、元素的最高化合价和最低化合价为纵坐标,用不同颜色的笔绘出折线图。
通过以上探究,你发现1~18号元素之间有什么内在联系?它们的性质具有怎样的变化规律?你将如何描述这些联系和规律?
怎样处理科学实验得到的数据?图表是帮你整理数据、发现其中规律的一种重要工具。
人类对元素周期律的认识人类对元素周期律的认识经历了一个漫长的过程。自道尔顿提出原子学说和原子量( 现称相对原子质量)概念之后,测定各种元素原子量的工作进展迅速,到19世纪中叶,已经获得了60多种元素的原子量数据。
以此为基础,科学家们开始研究原子量与元素性质之间的关系。门捷列夫和迈尔等科学家根据原子量的大小对元素进行分类排列发现元素性质随原子量的递增呈现明显的周期性变化。这就是人们对元素周期律的早期认识。
门捷列夫根据元素周期律预言了三种新元素及其有关性质,这三种元素随后皆被发现,它们分别是1875年发现的(Ga)、1879年发现的航(Sc)和1886年发现的锗(Ge),它们的原子量、密度和有关性质都与门捷列夫的预言惊人地相符。
门捷列夫去世后,英国物理学家莫斯莱应用X射线测定了原子核所带正电荷的数目,指出元素原子的核电荷数是这种元素的根本特征,原子序数是根据原子的核电荷数确定的。这样,元素周期律就有了更科学的基础。
直到20世纪30年代运用量子力学方法弄清了各元素原子的核外电子排布之后,才实现了对元素周期律实质的认识。现在人们已经知道,元素在元素周期表中的位置与原子的核外电子排布特别是最外层电子排布密切相关。
元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在变化规律元素周期表是元素周期律的具体表现形式,它是学习和研究化学的重要工具。
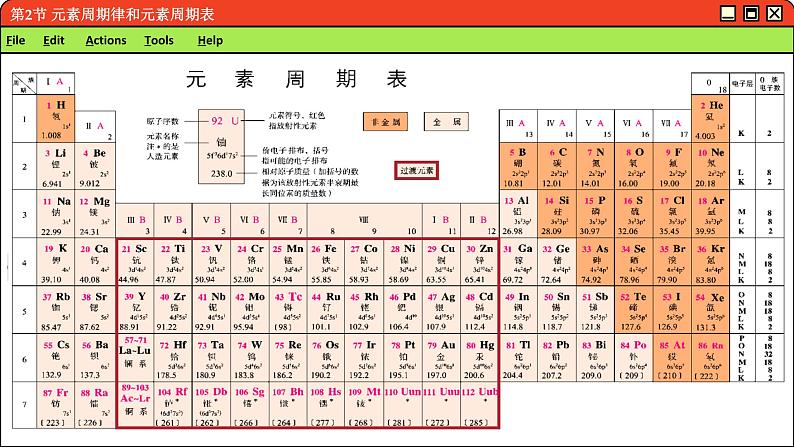
通过元素周期表,可以了解关于某元素的名称、元素符号、相对原子质量、原子序数等信息。元素周期表还对金属元素和非金属元素进行了分区.
如果沿着元素周期表中硼、砷、啼、破与铝、锗、锐、针的交界处画一条虚线,虚线的左侧是金属元素,右侧是非金属元素;位于虚线附近的元素,既表现金属元素的某些性质,又表现非金属元素的某些性质。
在元素周期表中,行称为周期,列称为族。
请仔细观察元素周期表 (见附录),回答问题:1.元素周期表有多少个周期? 每个周期各有多少种元素?2.以第2周期、第3周期元素为例分析: 元素周期表中位于同一周期的元素的原子结构有什么相同之处?它们是怎样递变的?
3.以第1列、第17列元素为例分析: 元素周期表中位于同一列(族)的元素的原子结构有什么相同之处? 它们又是怎样递变的?
4.在元素周期表中,找出你熟悉的元素的位置。5.关于元素周期表,你还有哪些问题?
除第1和第7周期外,每一周期的元素都是从原子最外层电子数为1的元素开始逐渐过渡到原子最外层电子数为7的元素,最后以原子最外层电子数为8的稀有气体元素结束.
元素周期表中共有18个纵列,其中第8、9、10三个纵列称为Ⅷ族。第18纵列由稀有气体元素组成。稀有气体元素的化学性质不活泼,化合价通常为零,因而这一族称为0族。
其余14个纵列,每个纵列为一族。族有主族和副族之分:由短周期元素和长周期元素共同组成的族称为主族,符号为A,
序数用罗马数字表示,如ⅠA、ⅡA、ⅢA等,仅由长周期元素组成的族称为副族,符号为 B,序数也用罗马数字表示,如ⅠB、ⅡB、ⅢB 等。
镧系和锕系在第6周期中,从57号元素铜( La )到71号元素( Lu ),原子的最外层和次外层电子层结构及元素的化学性质十分相似,这15种元素总称为镧系元素。
同样道理,第7周期中89 号元素锕(Ac)到103号元素铹(Lr)这15种元素总称为锕系元素。为了使元素周期表的结构紧凑,将镧系元素和锕系元素分别放在第6周期和第7周期的同一格内,并按原子序数递增的顺序,把它们分两行单独列在表的下方。
在元素周期表中位于同一主族的元素的原子最外层电子数相同,而且最外层电子数与族序数相同,它们按照电子层数递增的顺序自上而下依次排列。因此,每一主族的各元素具有相似的性质。
例如,ⅡA族包括䥽(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等元素,人们称它们为碱土金属元素(图1-2-5)
焰色反应及其应用焰色反应是某些金属或它们的化合物在灼烧时火焰呈现特征颜色的反应。根据焰色反应可以判断某种元素的存在、制造焰火等。
形式不同的元素周期表自1869年门捷列夫给出第一张元素周期表以来,至少已经出现了700多种不同形式的元素周期表总的来说,人们制作元素周期表的目的是为研究元素周期律提供方便但研究的侧重点不同,给出的元素周期表的形式也就不同。
短式周期表 元素周期表有短表和长表之分。20世纪前半叶广泛使用的是短表,图1-2-7给出的就是一种短式元素周期表。
门捷列夫起初制作的元素周期表是最原始的短式元素周期表。当时,稀有气体元素和很多其他元素尚未被发现,因此在他制作的元素周期表里没有它们的位置。
三角形元素周期表 1930年以后广泛使用的长式元素周期表有很多种形式,我们现在经常使用的就是一种长式元素周期表(见附录)。图1-2-8给出的这种三角形元素周期表也是一种长式元素周期表,它能直观地展现元索性质的周期性发展,但不能很好地反映纵列元索的相互关系。
1.元素之间是存在相互联系和内在变化规律的,元素周期律揭示了这种相互联系和内在变化规律。什么是元素周期律?元素周期律的实质是什么?
2。元素周期表是元素周期律的具体表现形式。常见的元素周期表的结构是怎样的?金属元素和非金属元素可怎样分区? 同周期、同主族元素的原子结构各有什么特点?3。利用元素周期表归纳总结你所学过的元素化合物知识。
1,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素
(1)表中所列元素中:属于短周期元素的有_____________________属于主族元素的有____________________________e元素在元素周期表中的位置是_________周期,_______族
(2)下列组元素的单质可能都是电的良导体。A.b,c,iB.a,g,kC.c,g,1D.d,e,f(3)将元素a,b,C,f,1的原子半径按从小到大的顺序排列:_______________________________________
(4)i元素属于__________(填“金属”或“非金属”)元素,它的最高化合价是________ 最低化合价是它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出i的单质与氧气反应的化学方程式:________________________________
2.请你利用元素周期律和元素周期表的有关知识,回答下列问题:(1)下列各组元素性质或原子结构递变情况错误的是 ( )A . Li、Be、B原子最外层电子数依次增多B . P、S、C1元素最高正化合价依次升高C . N、0、F原子半径依次增大D . Na、K、Rb的电子层数依次增多
(2)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B 元素 ( )A .一定是第2周期元素B .一定是同一主族元素C .可能是第2、3周期元素D .可以相互化合形成化合物
3.动手实践:比较原子的大小在这个活动中,你要用模型来比较元素周期表中同族元素原子的大小材料圆规,计算器,元素周期表。
活动过程根据元素周期表,预测同族元素从上到下原子半径是增大、不变还是减小。(2)查看IA 族中每种元素的原子半径。
(3)以ⅡA 族元素中原子半径最小的锁元素为标准,计算每种原子的相对半径(精确到小数点后一位)。(4)根据计算的相对半径值,用圆规画出代表各种原子的圆,各圆的半径以厘米为单位。
分析(1)根据你的模型,你第 (1)步的预测正确吗? 请予以解释(2)元素周期表中每一族中原子半径最大的元素在哪个位置?
化学选择性必修2第3节 液晶、纳米材料与超分子优秀课件ppt: 这是一份化学选择性必修2第3节 液晶、纳米材料与超分子优秀课件ppt,共8页。
化学第1节 认识晶体优秀ppt课件: 这是一份化学第1节 认识晶体优秀ppt课件,共11页。
2021学年第3节 饮食中的有机化合物一等奖课件ppt: 这是一份2021学年第3节 饮食中的有机化合物一等奖课件ppt,文件包含新教材精创332乙酸课件2-鲁科版高中化学必修第二册共21张PPTpptx、新教材精创332乙酸学案2-鲁科版高中化学必修第二册docx、新教材精创332乙酸教学设计2-鲁科版高中化学必修第二册docx、新教材精创332乙酸练习2原卷版docx、新教材精创332乙酸练习2解析版docx等5份课件配套教学资源,其中PPT共20页, 欢迎下载使用。













