
河北省秦皇岛市青龙满族自治县青龙部分学校2023-2024学年高一上学期1月期末联考化学试题(含答案)
展开分值:100分 考试时间:75分钟
第I卷 选择题(共39分)
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.下列原子(离子)的结构示意图正确的是( )
A.①②B.②③
C.③④D.①④
2.下列排列顺序正确的是
A.微粒半径:Mg2+>F-B.稳定性:HI>HBr
C.熔点:Al>NaD.酸性:H2SO4>HClO4
3.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
A.AB.BC.CD.D
4.下列有关实验操作或方法正确的是
A.金属Na可保存在盛有油的玻璃瓶中
B.实验室配制溶液时,用托盘天平称取6.0g胆矾固体
C.除去中少量的杂质,加入足量NaOH溶液后过滤
D.向、溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀
5.氯气用途广泛,是一种重要的化工原料。下列关于氯气的说法正确的是
A.液氯可以储存在钢瓶中
B.将氯气通入碳酸钠溶液中,制取较高浓度的次氯酸溶液
C.通入氯气使品红溶液褪色,取褪色后溶液加热可恢复红色
D.若氯气发生泄漏,逃离现场时,可以用浸有一定浓度的NaOH溶液的毛巾捂住口鼻
6.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
7.下列电离方程式书写正确的是
A.B.
C.D.
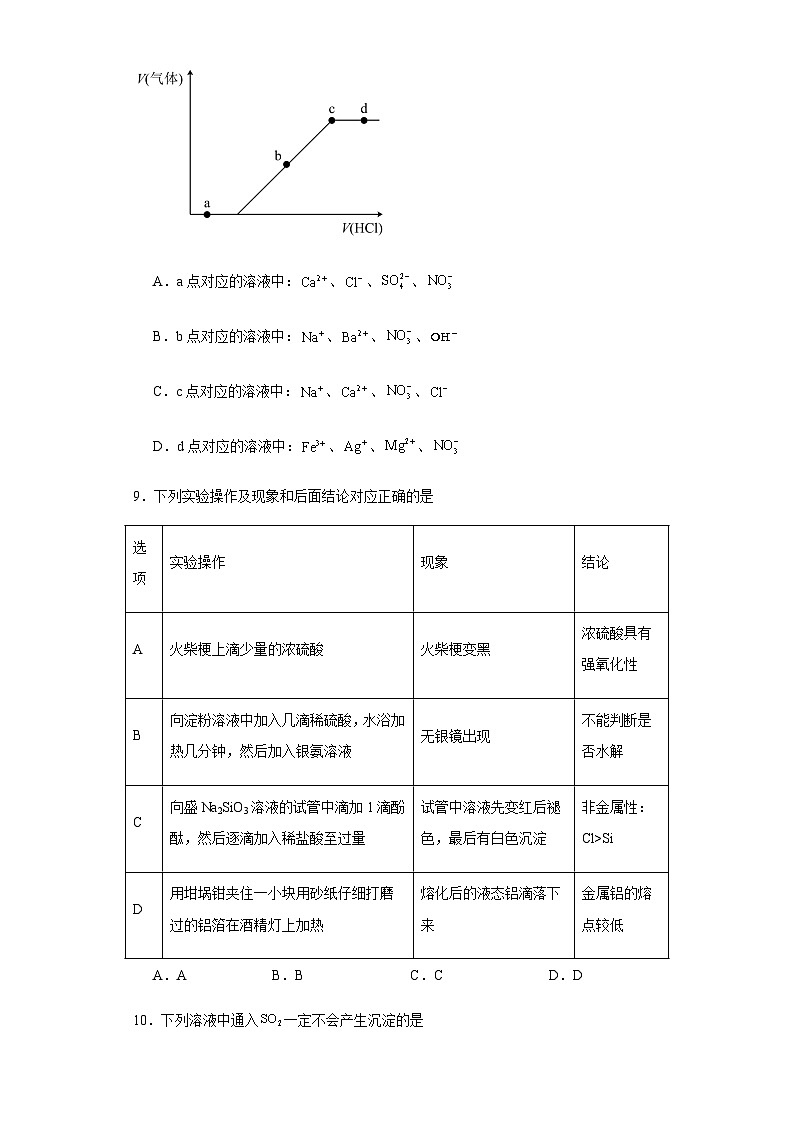
8.向、混合溶液中逐滴加入稀盐酸,生成气体的体积随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中:、、、
B.b点对应的溶液中:、、、
C.c点对应的溶液中:、、、
D.d点对应的溶液中:、、、
9.下列实验操作及现象和后面结论对应正确的是
A.AB.BC.CD.D
10.下列溶液中通入一定不会产生沉淀的是
A.B.澄清石灰水C.D.
11.用NA表示阿伏加 德罗常数的值,下列叙述正确的是( )
A.7.8gNa2O2与足量的H2O反应转移的电子数为0.2NA
B.分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA
C.常温常压下,11.2LN2中含有的分子数为0.5NA
D.1ml/LNaCl的溶液中含有NA个钠离子
12.工业合成氨以及氨氧化制硝酸的流程如图。下列说法错误的是
A.M为O2
B.氨分离器中利用了氨易液化的性质
C.氧化炉氨的催化氧化反应中氧化剂与还原剂的物质的量之比为4﹕5
D.可使用氢氧化钠溶液或氨气处理尾气
13.相同条件下,等物质的量Na2CO3和NaHCO3固体分别与相同浓度的过量稀盐酸反应,下列叙述正确的是( )
A.两者放出的CO2一样多
B.Na2CO3放出的CO2多
C.NaHCO3消耗的盐酸多
D.Na2CO3反应剧烈
14.某种硅溶胶的结构如图所示,下列说法错误的是
A.用激光笔照射该分散系,在入射光侧面可观察到光亮的通路
B.若硅溶胶中混有少量硝酸钾,可用滤纸过滤提纯
C.硅溶胶区别于悬浊液的本质特征是分散质微粒大小不同
D.对硅溶胶通电,硅溶胶粒子做定向移动
第Ⅱ卷 非选择题(共58分)
二、填空题(本题包括4个小题,共58分)
15.(12分)回答下列问题:
(1)已知反应:,该反应中只发生如下变化过程:
①中Cr元素的化合价是 ,该反应中的还原剂是 (填化学式)。
②该反应中,生成1ml 转移电子的数目是 。
(2)某无色溶液中可能含有、、、、、中的一种或几种离子。为确定其成分,进行以下实验:
甲:向此溶液中滴加足量稀盐酸无明显现象。
乙:向甲的溶液并加入足量的溶液,有23.3g白色沉淀产生。
丙:向乙的溶液中加入足量的NaOH溶液,有5.8g白色沉淀产生。
根据实验结果判断:
①原溶液中不能确定是否含有的离子是 。
②实验乙中反应的离子方程式为 。
③由题中数据计算的物质的量,下列选项一定正确的是 。
A.等于0.4ml B.大于或等于0.4ml C.等0.2ml
16.(14分)A、B、C、D、E是原子序数依次增大的短周期主族元素,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质在不同条件下反应可生成不同的物质甲和乙,其中甲是一种淡黄色的固体,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,C为 。(填元素名称)
(2)A与B形成的一种化合物与甲反应的化学方程式为 。
(3)A、B两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)D的最高价氧化物对应的水化物和A的单质反应的化学方程式为
(5)写出物质甲的电子式 ,用电子式表示物质乙的形成过程: 。
(6)E的最高价氧化物的化学式为 。
(7)写出C、E最高价氧化物的水化物反应的离子方程式 。
17.(16分)工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等)制备MnSO4•H2O的一种工艺流程如图:
已知:浸出液中阳离子主要有Mn2+、Fe2+、Al3+等,浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4。
回答下列问题:
(1)物质X最好选用 。
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如图所示,为提高SO2的吸收效率,酸浸适宜的条件是pH为 ,温度为 。
(3)流程中“氧化”步骤主要反应的离子方程式是 。
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5)用MnSO4可测定水中溶解氧,方法是:取100mL水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3ml•L-1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液12.0mL时反应完全.有关化学反应方程式如下:
①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③I2+2S2O=S4O+2I-。
计算水样中溶解氧的浓度(以mg•L-1为单位),写出计算过程 。
18.(16分)实验室由硫铁矿烧渣(主要成分为、、)制备软磁性材料。主要转化流程如下:
(1)制绿矾。烧渣到绿矾的工艺中涉及“酸浸”“还原”“除杂”“结晶”等实验流程。
①酸浸。写出烧渣酸浸时与稀硫酸反应的化学方程式 。
②还原。向“酸浸”后的溶液中加入过量铁粉,使完全转化为,该过程除生成外,还会生成 (填化学式);检验是否还原完全的实验操作是 。
③除杂。向“还原”后滤液中加入NaOH溶液,调节pH为 ,使除去完全。[已知:时沉淀完全,时开始沉淀。]
④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得晶体的实验操作。向溶液中再加入稀硫酸酸化, ,过滤,少量冰水洗涤,低温干燥,得到晶体。
(2)制。将溶液与氨水混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
①分液漏斗中的溶液是 ;生成的离子方程式为 。
②生成的沉淀需“洗涤完全”,检验方法是 。
(3)制。将纯净的放入管式炉内煅烧2h,获得产品。下图为其他条件相同时不同煅烧温度对产品中质量分数的影响,当煅烧温度高于800℃时,产品中质量分数降低,铁元素质量分数升高,其可能原因是 。
事实
推测
A
与水反应缓慢,与水反应较快
与水反应会更快
B
与高温时反应,S与加热能反应
P与在高温时能反应
C
在时分解,在时分解
的分解温度介于二者之间
D
高氯酸是强酸,高溴酸是强酸
氟最高价氧化物对应水化物一定是强酸
选项
实验操作
现象
结论
A
火柴梗上滴少量的浓硫酸
火柴梗变黑
浓硫酸具有强氧化性
B
向淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入银氨溶液
无银镜出现
不能判断是否水解
C
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色,最后有白色沉淀
非金属性:Cl>Si
D
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
参考答案:
1.D2.C3.D4.C5.A6.D7.B8.C9.B10.D11.B12.C13.A14.B
15.(1) +6 2
(2) B
16. 碳 钠 2Na2O2+2CO2===2Na2CO3+O2 共价 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O Cl2O7 H+ + OH— = H2O
17.(1)b
(2) 3左右 40℃左右
(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(4)取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽
(5)n(S2O)= 5.00×10-3ml·L-1 × 12.0×10-3 L = 6.00×10-5 ml,由化学方程式可得:O2~2I2~4 S2O,n(O2)= n(S2O)=1.50×10-5 ml,水样中溶解氧的浓度=1.50×10-5 ml × 32 g·ml-1×103 mg/g÷0.10 L =4.80mg·L-1。
18.(1) Fe2O3+3H2SO4=Fe2(SO4) 3+3H2O H2 取少量清液于试管中,向其中滴加几滴KSCN溶液,观察溶液是否变为红色 5—5.8 蒸发浓缩得到60℃饱和溶液,冷却至0℃结晶
(2) 氨水—NH4HCO3混合溶液 Fe2++NH3·H2O+HCO=FeCO3↓+NH+ H2O 取最后一次洗涤液少许置于试管中,加入BaC12溶液,若无白色沉淀生成,说明沉淀洗涤干净
(3)高温条件分解生成Fe3O4
河北省秦皇岛市青龙满族自治县部分中学2023-2024学年高二上学期1月期末考试化学试题(含答案): 这是一份河北省秦皇岛市青龙满族自治县部分中学2023-2024学年高二上学期1月期末考试化学试题(含答案),共11页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
19,河北省秦皇岛市青龙满族自治县青龙部分学校2023-2024学年高三上学期1月期末化学试题: 这是一份19,河北省秦皇岛市青龙满族自治县青龙部分学校2023-2024学年高三上学期1月期末化学试题,共11页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
河北省秦皇岛市青龙满族自治县实验中学等2校联考2023-2024学年高一上学期12月月考化学试题含答案: 这是一份河北省秦皇岛市青龙满族自治县实验中学等2校联考2023-2024学年高一上学期12月月考化学试题含答案,共20页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。













