








化学选择性必修1实验活动5 制作简单的燃料电池授课课件ppt
展开电池在日常生活中的应用随处可见
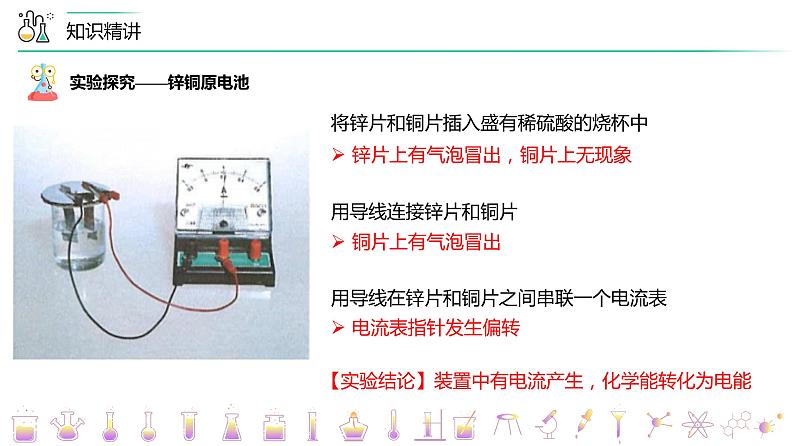
将锌片和铜片插入盛有稀硫酸的烧杯中
锌片上有气泡冒出,铜片上无现象
用导线在锌片和铜片之间串联一个电流表
【实验结论】装置中有电流产生,化学能转化为电能
实验探究——锌铜原电池
一、原电池的基本概念1.概念:原电池是将化学能转化为电能的装置。2.本质:氧化反应和还原反应分别在两个不同的区域进行。3.电极:(1)负极:________电子,发生________反应; (2)正极:________电子,发生________反应。
一、原电池的基本概念4.构成原电池的条件:(1)自发进行的氧化还原反应;(2)两个活动性不同的电极;(3)电解质溶液(或熔融电解质);(4)形成闭合回路。
二、锌铜原电池的工作原理
Zn - 2e- === Zn2+
2H+ + 2e- === H2↑
Zn + 2H+ === Zn2+ + H2↑
负 正
正 负
三、盐桥的作用(1)形成闭合回路;(2)平衡电荷,使溶液呈电中性;(3)避免电极与电解质溶液直接反应,减少电流的衰减,提高原电池的工作效率。
四、原电池的应用1.比较金属活动性两种金属分别作原电池的两极时,一般作负极的金属比正极的金属活泼。
有两种金属a和b,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生。则:金属_____是负极,金属_____是负极;金属活动性:________。
四、原电池的应用2.加快氧化还原反应的速率一个氧化还原反应,构成原电池时的反应速率比直接接触的反应速率快。
铁和稀 H2SO4 反应时,若加入少量 CuSO4溶液,Fe 与 CuSO4 反应生成 Cu,形成 Fe | 稀硫酸 | Cu 原电池,加快产生H2的速率。
四、原电池的应用3.设计原电池理论上,任何一个自发的氧化还原反应,都可以设计成原电池。利用原电池原理设计和制造原电池,可以将化学能直接转化为电能。
将反应2Fe3++Cu === 2Fe2++Cu2+设计成原电池。
【变2】控制适合的条件,将反应2Fe3++2I- 2Fe2++I2 设计成如下图所示的原电池。下列判断错误的是A.反应开始时,甲中的石墨电极为正极B.反应开始时,乙中的石墨电极上I-发生氧化反应C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
题型一:原电池的工作原理
【变3-1】高密度储能电池锌溴电池如图所示,放电时总反应为Zn+Br2=ZnBr2。下列说法错误的是A.放电时,电极M为正极B.放电时,负极的电极反应式为Zn-2e-=Zn2+C.充电时,ZnBr2溶液的浓度增大D.充电时,每转移2mle-,理论上有1mlZn2+通过离子交换膜从左向右扩散
题型二:带离子交换膜的原电池
【例5】3.25 g锌与100 mL 1 ml·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是A.滴加几滴浓盐酸B.滴加几滴浓硝酸C.滴加几滴硫酸铜溶液D.加入少量锌粒
【变6】设计原电池装置证明Fe3+的氧化性比Cu2+强。(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:___________。(2)若要将上述反应设计成原电池,电极反应式分别是:①负极:___________②正极:___________。(3)画出装置图,指出电极材料和电解质溶液:①不含盐桥 ②含盐桥
【答案】(1)2Fe3++Cu=2Fe2++Cu2+(2) Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+
人教版 (2019)第四节 化学反应的调控图文ppt课件: 这是一份人教版 (2019)<a href="/hx/tb_c4002422_t3/?tag_id=26" target="_blank">第四节 化学反应的调控图文ppt课件</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第12讲化学反应的调控PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第12讲化学反应的调控学生版+教师版docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第三节 化学反应的方向教课课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002421_t3/?tag_id=26" target="_blank">第二章 化学反应速率与化学平衡第三节 化学反应的方向教课课件ppt</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第11讲化学反应的方向PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第11讲化学反应的方向学生版+教师版docx等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡背景图课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡背景图课件ppt</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第09讲化学平衡常数PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第09讲化学平衡常数学生版+教师版docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。













