
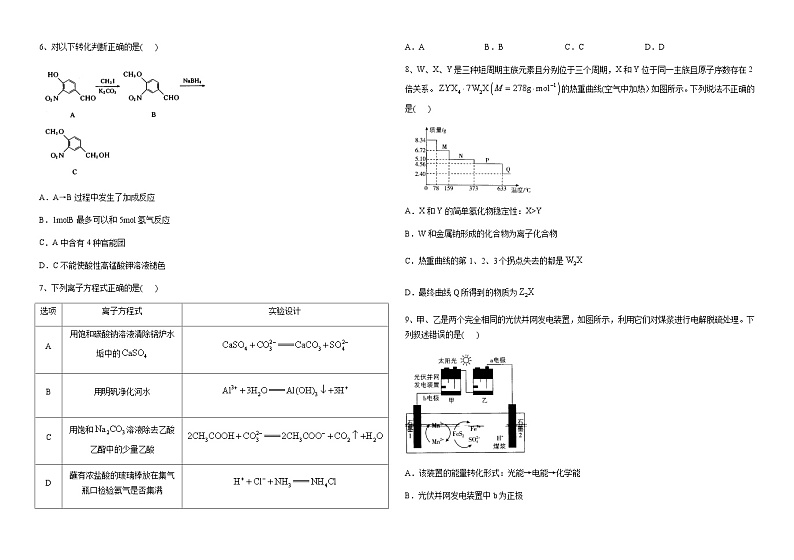
河南省鲁山县第一高级中学2023-2024学年高三上学期阶段检测化学试题(12月)含答案
展开1、化学与生活密切相关。下列说法错误的是( )
A.AB.BC.CD.D
2、据古代文献记载:“慈石治肾家诸病,而通耳明目。”“慈石,色轻紫,石上皲涩,可吸连针铁。”“慈石”的主要成分是。若将“慈石”溶于足量的稀硫酸中得到稀溶液M,在M溶液中下列离子能大量共存的是( )
A.B.
C.D.
3、物质M可用作牙膏、牙粉的稳定剂,其化学式为(不溶于水)。已知X、Y、Z为原子序数依次增大的短周期元素,基态Z原子的3p轨道半充满,基态X原子的s能级电子总数与p能级电子总数相等,Y主要用于制造轻金属合金、科学仪器和格氏试剂等。下列说法正确的是( )
A.Z的最高价含氧酸的酸性强于硫酸
B.电负性:X>Z>Y
C.Y和X元素形成的简单二元化合物易溶于水
D.M溶液中易水解生成
4、下列实验方案能达到实验目的的是( )
A.用甲装置配制一定物质的量浓度的硫酸
B.用乙装置制备并收集纯净的
C.粗盐提纯后,用丙装置蒸发结晶得到NaCl晶体
D.丁装置制备溴苯时,通过硝酸银溶液变浑浊证明该反应为取代反应
5、下列离子方程式书写正确的是( )
A.向含氯化铝的氯化镁溶液中加入氧化镁:
B.工业上用过量氨水吸收尾气:
C.向中加入酸化的
D.1ml/L的溶液和2.5ml/L的盐酸等体积混合:
6、对以下转化判断正确的是( )
A.A→B过程中发生了加成反应
B.1mlB最多可以和5ml氢气反应
C.A中含有4种官能团
D.C不能使酸性高锰酸钾溶液褪色
7、下列离子方程式正确的是( )
A.AB.BC.CD.D
8、W、X、Y是三种短周期主族元素且分别位于三个周期,X和Y位于同一主族且原子序数存在2倍关系。的热重曲线(空气中加热)如图所示。下列说法不正确的是( )
A.X和Y的简单氢化物稳定性:X>Y
B.W和金属钠形成的化合物为离子化合物
C.热重曲线的第1、2、3个拐点失去的都是
D.最终曲线Q所得到的物质为
9、甲、乙是两个完全相同的光伏并网发电装置,如图所示,利用它们对煤浆进行电解脱硫处理。下列叙述错误的是( )
A.该装置的能量转化形式:光能→电能→化学能
B.光伏并网发电装置中b为正极
C.脱硫反应原理为
D.石墨1上消耗0.5ml,甲、乙中各转移1ml电子
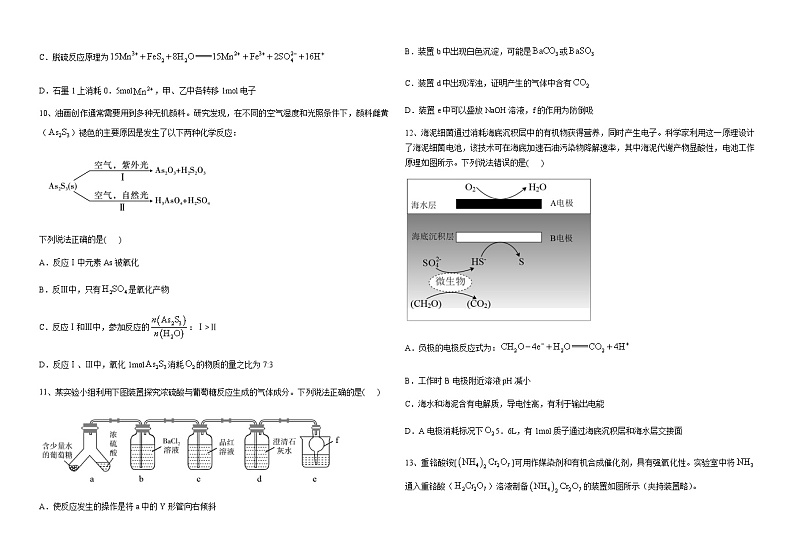
10、油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄()褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是( )
A.反应Ⅰ中元素As被氧化
B.反Ⅲ中,只有是氧化产物
C.反应Ⅰ和Ⅲ中,参加反应的:Ⅰ>Ⅱ
D.反应Ⅰ、Ⅲ中,氧化1ml消耗的物质的量之比为7:3
11、某实验小组利用下图装置探究浓硫酸与葡萄糖反应生成的气体成分。下列说法正确的是( )
A.使反应发生的操作是将a中的Y形管向右倾斜
B.装置b中出现白色沉淀,可能是或
C.装置d中出现浑浊,证明产生的气体中含有
D.装置e中可以盛放NaOH溶液,f的作用为防倒吸
12、海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术可在海底加速石油污染物降解速率,其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是( )
A.负极的电极反应式为:
B.工作时B电极附近溶液pH减小
C.海水和海泥含有电解质,导电性高,有利于输出电能
D.A电极消耗标况下5.6L,有1ml质子通过海底沉积层和海水层交接面
13、重铬酸铵[]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将通入重铬酸()溶液制备的装置如图所示(夹持装置略)。
已知:。
下列说法错误的是( )
A.装置X可控制通入的速度且能观察装置Y中是否堵塞
B.仪器a的作用是防止倒吸
C.装置Y中溶液的pH不宜过大,否则会有生成
D.仪器b中装入的试剂为碱石灰,目的是吸收过量的
14、25℃时,RCOOH溶液中酸分子(RCOOH)分布分数;X酸()与Y酸(YCOOH)中酸分子的分布分数与pH的关系如图所示。下列说法正确的是( )
A.酸性强弱:XCOOH
C.等体积pH=3的XCOOH溶液和YCOOH溶液分别和等浓度的NaOH溶液反应,XCOOH溶液消耗的NaOH溶液体积大
D.等物质的量的XCOOH和YCOOH加入NaOH溶液恰好中和,所得溶液中:
二、非选择题:本题共5小题,共58分。
15、(12分)对氯甲苯是生产农药、医药染料的重要中间体,实验室常用对甲基苯胺和亚硝酸钠在冷的无机酸溶液中生成重氮盐,制得的重氮盐再进一步取代即可制得对氯甲苯,其反应原理如下:
实验相关数据:
实验步骤:
(一)重氮盐溶液的制备
在烧杯中依次加入15 mL水、15 mL浓盐酸、5.35 g对甲基苯胺,加热至固体充分溶解,将溶液置于冰盐浴中,用玻璃棒不断搅拌至糊状,在0 ℃条件下边搅拌边滴入80% 溶液,用淀粉-KI试纸检验混合液,若试纸变蓝则不必再加溶液。
(二)对氯甲苯的制备
将制好的对甲基苯胺重氮盐滴加至装有冷的CuCl-HCl溶液的烧瓶中,滴加完毕后,室温放置30 min,有大量气体X逸出,在55 ℃水浴中使气体X释放完全,向烧瓶A中加入适量蒸馏水,进行水蒸气蒸馏,当不再有油滴馏出时停止加热。将馏出液转移至分液漏斗,分离出有机层(粗产品),用环己烷萃取水层两次,将萃取所得有机层与粗产品合并,分别用10% NaOH溶液、水、浓硫酸、水洗涤,再用无水干燥后蒸馏,控制温度在158~162 ℃收得馏分3.8 g。
回答下列问题:
(1)制备重氮盐溶液时,用淀粉-KI试纸检验混合液,试纸变蓝且产生无色气体,该气体遇空气变红棕色,导致试纸变蓝的反应的化学方程式为_________。
(2)仪器C的名称为________,A中玻璃管的作用为________。
(3)用环己烷萃取水层时,所得有机层从分液漏斗________(填“上口”或“下口”)放出,将萃取所得有机层与粗产品合并的目的是________。
(4)粗产品经干燥后,先用________(填序号)蒸馏由低沸点杂质,再控制温度在158~162 ℃改用________(填序号)收集馏分。
A.直形冷凝管B.球形冷凝管C.空气冷凝管
(5)对氯甲苯的产率为________(保留两位有效数字)。
16、(12分)高纯在电子工业中有重要的应用,工业上利用软锰矿(主要成分是,还含有等杂质)制取碳酸锰的流程如图所示:
已知:还原焙烧主反应为。
可能用到的数据如表所示:
根据要求回答下列问题:
(1)在实验室进行步骤A,用到的主要由硅酸盐产品制成的仪器有___________。“浸取”时温度控制在90~95℃之间,并且要连续搅拌的目的是___________。
(2)步骤C中的滤渣为___________。
(3)步骤D发生反应的离子方程式为___________。
(4)步骤E中调节pH的范围为___________,其目的是___________。
(5)步骤G中恰好沉淀完全时测得溶液中的浓度为,则________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中完全转化为(其中完全转化为);加入稍过量的硫酸铵,发生反应以除去;加入稀硫酸酸化,再加入60.00mL0.500硫酸亚铁铵溶液,发生的反应为;用5.00mL0.500酸性溶液恰好除去过量的。
①写出酸性溶液与反应的离子方程式:___________;
②试样中锰元素的质量分数为___________。
17、(12分)甲醇不仅是重要的化工原料,还是性能优良的车用燃料。工业上以、CO为原料一般采用下列两种反应合成甲醇:
反应Ⅰ:
反应Ⅱ:
(1)在以上制备甲醇的两个反应中,反应Ⅰ优于反应Ⅱ,其原因为 。
(2)已知反应Ⅱ合成甲醇可分两步进行:
第1步:
第2步:
①反应过程中作催化剂的物质化学式为 。
②第2步反应几乎不影响总反应达到平衡所用的时间,下图能量变化可正确表示反应Ⅱ过程的是 (选填标号);反应Ⅱ属于反应 (选填“放热”或“吸热”)。
A.B.C.D.
(3)一定温度下将和充入一密闭恒容容器中,充分反应达到平衡。若容器体积不变,下列措施可提高反应Ⅱ中甲醇产率的是 。
a.增加的量或的量
b.充入He
c.升高温度
d.按原比例再充入和
(4)为研究反应Ⅱ在不同温度下催化剂的反应活性,保持其他条件不变,测得在相同时间内的的转化率和的选择性与温度的关系如图1所示。
①由图1可知合成甲醇的最佳温度为 。
②500℃以上时,的选择性降低的可能原因是 。(填标号)。
A.平衡常数变大B.催化剂活性降低C.反应活化能减小
(5)在物理化学上许多反应的温度对反应速率的影响可通过Arrhenius经验公式进行研究。反应Ⅱ的Arrhenius经验公式的实验数据如图2中a线所示,计算该反应的活化能 。当改变外界条件时,实验数据如图中b线所示,则改变的外界条件可能是 。已知:经验公式为 (其中为反应的活化能,k为速率常数,R和C为常数)。
18、(12分)钕铁硼磁铁是常使用的稀土磁铁,被广泛应用于电子产品中。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他物质。请回答下列问题:
(1)钕(Nd)为60号元素,在元素周期表中位于第______周期;基态价电子的轨道表示式为__________。
(2)实验测得的实际存在形式为,其分子的球棍模型如图所示。
①该分子中Al原子采用________杂化。
②与过量NaOH溶液反应生成中存在的化学键有__________(填字母)。
A.离子键
B.极性共价键
C.金属键
D.非极性共价键
E.氢键
(3)FeO是离子晶体,其晶格能可通过如下循环计算得到。
基态Fe原子的第一电离能为_______,FeO的晶格能为_______。
(4)因材料中含有大量的钕和铁,容易锈蚀是钕铁硼磁铁的一大弱点,可通过电镀镍(Ni)等进行表面涂层处理。已知Ni可以形成化合物四羰基镍,其为无色易挥发剧毒液体,熔点为-19.3 ℃,沸点为43 ℃,不溶于水,易溶于乙醇、苯、四氯化碳等有机溶剂,四羰基镍的晶体类型是__________,写出与配体互为等电子体的分子和离子的化学式______、________(各写一种)。
(5)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为,阿伏加德罗常数的值为,则晶体的密度为__________(列式即可,用含a、的代数式表示)。
19、(10分)联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如图:
(1)沉淀池中发生反应的离子方程式为__________。
(2)X是__________,Y是__________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其他溶质还有__________;排出液W中的溶质除了氢氧化钙外,还有__________。
(4)从理论上分析,在氨碱法生产过程中__________(填“需要”或“不需要”)补充氨气。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确的是__________(填字母)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高的浓度,促进碳酸氢钠结晶析出
答案以及解析
1、答案:B
解析:杭州亚运会奖牌表面材质为金、银、铜,属于金属材料,A正确;炒糖色过程中,白砂糖在较高温度下发生脱水等反应,产生黑褐色物质,发生化学反应,B错误;切开的土豆放置后切面变色是因为土豆中的酚类被氧化,产生大量的醌类物质,新生的醌类物质能使植物细胞迅速地变成褐色,C正确;秸秆燃烧会产生大量氮氧化物、二氧化硫及烟尘等,D正确。
2、答案:C
解析:和不能大量共存,且酸性条件下与不能大量共存,故A错误;与不能大量共存,且与能发生双水解也不能大量共存,故B错误;该组离子与以及过量的均不能发生反应,可以大量共存,故C正确;钙离子与碳酸根离子不能共存,和发生中和反应,同时均与反应生成沉淀不能大量共存,故D错误。
3、答案:B
解析:由信息梳理可知,化合物M为。为中强酸而非强酸,酸性弱于硫酸,A错误;同周期主族元素从左到右,电负性逐渐增强,同主族元素从上到下,电负性逐渐减弱,故电负性:O>N>P>Mg,即电负性:O>P>Mg,B正确;Y和X元素形成的简单二元化合物为MgO,难溶于水,C错误;由题给信息可知,不溶于水,D错误。
4、答案:C
解析:容量瓶不能用于稀释溶液,A错误;用乙装置收集氨气时,应将导管口伸到试管底部以排出空气,B错误;粗盐提纯后,用丙装置进行蒸发结晶可得到NaCl晶体,C正确;挥发出来的溴单质也可以与硝酸银反应使溶液变浑浊,故不可证明该反应为取代反应,D错误。
5、答案:C
解析:向含氯化铝的氯化镁溶液中加入氧化镁,反应的离子方程式为,A错误;工业上用过量氨水吸收尾气,反应的离子方程式为,B错误;高锰酸钾在酸性环境下能够氧化过氧化氢生成氧气,向中加入酸化的,反应的离子方程式为,C正确;1ml/L的溶液和2.5ml/L的盐酸等体积混合,反应的离子方程式为,D错误。
6、答案:B
解析:A→B过程中发生了取代反应,故A错误;B的不饱和度是6(硝基1,苯环4,醛基1),1ml B与4ml氢气发生加成反应,1mlB上的硝基与1ml氢气发生还原反应,所以1mlB最多可以和5ml氢气反应,故B正确;A中只含有3种官能团(羟基、硝基和醛基),故C错误;C中含有羟基,能使酸性高锰酸钾溶液褪色,故D错误。
7、答案:A
解析:和反应生成更难溶的碳酸钙,A正确;明矾电离出的铝离子水解生成氢氧化铝胶体而不是氢氧化铝沉淀,氢氧化铝胶体具有吸附性,可吸附河水中的杂质,达到净水的目的,正确的离子方程式为,B错误;乙酸少量,发生的反应为,C错误;检验氨气时,浓盐酸挥发出的HCl气体和反应生成固体小颗粒,D错误。
8、答案:D
解析:根据“W、X、Y是三种短周期主族元素且分别位于三个周期”推出其中一定有H;又根据“X和Y位于同一主族且原子序数存在2倍关系”推出X和Y为O和S,则W为H,结合化合物的化学式,知X为O,Y为S。根据的,推出乙的摩尔质量为,故Z为Fe,该物质为。同一主族元素自上而下简单氢化物的热稳定性逐渐减弱,故稳定性:,A正确;NaH是由和构成的离子化合物,B正确;8.34g的的物质的量为0.03ml,结合M、N、P的质量计算,第一个拐点失去0.09ml,第二个拐点失去0.09ml,第三个拐点失去0.03ml,C正确;最终剩余的是Fe的氧化物,其中Fe的物质的量为0.03ml,质量为1.68g,则O的质量为0.72g,物质的量0.045ml,,故最终曲线Q所得物质为,D错误。
9、答案:D
解析:由题图可知,光伏并网发电装置先将太阳能转化为电能,再利用电解过程将电能转化为化学能,A正确;由题图可知,石墨1上发生氧化反应生成,则石墨1为阳极,b为正极,B正确;由题图可知,阳极生成的与反应生成,从而实现脱硫,反应原理为,C正确;石墨1上的电极反应式为,消耗0.5ml,电路中转移0.5ml电子,甲、乙装置是串联模式,故甲、乙中各转移0.5ml电子,D错误。
10、答案:C
解析:反应Ⅰ的方程式为:,反应Ⅱ的方程式为:;
A选项:反应Ⅰ中As元素化合价不变;
B选项:反应Ⅱ中氧化产物为和;
C选项:反应Ⅰ中,反应Ⅱ中,故Ⅰ>Ⅱ;
D选项:反应Ⅰ、Ⅱ中,氧化1ml消耗的物质的量之比为3:7。
11、答案:D
解析:A.葡萄糖为固体,浓硫酸和葡萄糖混合,将Y形管向左倾斜,浓硫酸倒入含少量水的葡萄糖中,A项错误;
B.和和氯化钡溶液均不反应,若装置b中出现白色沉淀,是和和氯化钡反应生成的,B项错误;
C.c中的品红溶液不能完全吸收,、均能使澄清石灰水变浑浊,C项错误;
D.污染性尾气为,可以用NaOH溶液吸收,球形干燥管的作用为防倒吸,D项正确;
故选D。
12、答案:A
解析:A.由分析可知,负极反应为,A错误;
B.工作时B电极附近生成氢离子,酸性增强,溶液pH减小,B正确;
C.海水和海泥含有电解质,导电性高,有利于形成闭合电路输出电能,C正确;
D.A电极反应为,消耗标况下5.6L,为0.25ml氧气,根据电子守恒可知,有1ml质子通过海底沉积层和海水层交接面,D正确;
故选A。
13、答案:D
解析:可以通过观察通入装置X中产生气泡的多少来控制通入的速度,若装置Y中堵塞则装置X中长颈漏斗的液面会上升,A正确;由于极易溶于水,仪器a可以防止倒吸,B正确;若装置Y中溶液的pH过大,平衡正向移动,有生成,C正确;碱石灰主要用来干燥碱性或中性气体,不能吸总收过量的,应选用或无水,D错误。
14、答案:B
解析:结合图像及可知,pH=2.8时,,pH=3.75时,,则,,,则XCOOH酸性较强,A错误;,B正确;酸性,等体积pH=3的XCOOH溶液和YCOOH溶液,YCOOH溶液的物质的量浓度大,消耗的NaOH溶液体积大,C错误;等物质的量的XCOOH和YCOOH加入NaOH溶液恰好中和,所得溶液中溶质为等物质的量的XCOONa、YCOONa,因酸性:XCOOH>YCOOH,则水解程度:,故D错误。
15、答案:(1)
(2)直形冷凝管;平衡气压
(3)上口;提高对氯甲苯的产率
(4)A;C
(5)60%
解析:(1)用淀粉-KI试纸检验混合液,试纸变蓝,说明生成了,产生的无色气体遇空气变红棕色,说明反应生成了NO,由得失电子守恒和质量守恒可书写反应的化学方程式。
(2)玻璃管与空气连通,作用为平衡气压。
(3)环己烷密度小于水,用环己烷作萃取剂萃取分液时,先从下口放出水层,再从上口倒出有机层,将萃取所得有机层与粗产品合并,可以减少产物损耗,提高对氯甲苯的产率。
(4)直形冷凝管冷凝效果好,但是馏分沸点高于140 ℃时,直形冷凝管内外温差大,容易碎裂,应该换成空气冷凝管,故粗产品经干燥后,先用直形冷凝管蒸馏出低沸点杂质(环己烷),再控制温度在158~162 ℃改用空气冷凝管收集馏分。
(5)产率。
16、答案:(1)酒精灯、泥三角、坩埚;加快反应速率,使软锰矿粉充分反应,提高软锰矿中锰的浸出率
(2)Cu、和C
(3)
(4);使转化为而除去,而不影响
(5)
(6)①;②25%
解析:(1)硅酸盐产品包括陶瓷、水泥、玻璃等,在实验室进行步骤A(焙烧)时,用到的主要由硅酸盐产品制成的仪器有酒精灯、泥三角、坩埚。升温、搅拌都可以加快反应速率,浸出时温度控制在90~95℃之间,并且要连续搅拌,目的是加快反应速率,使软锰矿粉充分反应,提高软锰矿中锰的浸出率。
(2)还原焙烧后得到固体混合物为Cu、Fe、C、MnO、 CaO,硫酸浸取时C、Cu和稀硫酸不反应,CaO与稀硫酸反应生成微溶的,故步骤C中的滤渣为Cu、和C。
(3)步骤D中氧化剂为,还原剂为,反应的离子方程式为。
(4)步骤E调节pH的目的是使转化为而除去,而不影响,因此调节pH的范围为。
(5)步骤G中恰好沉淀完全时,测得溶液中的浓度为,则。
(6)①根据得失电子守恒、电荷守恒和原子守恒,配平酸性溶液与反应的离子方程式为。②加入的硫酸亚铁铵中的亚铁离子分两部分参加反应,分别与和反应,与反应的,,,根据Mn原子守恒,则,质量分数=。
17、答案:(1)反应Ⅰ符合“原子经济性”原则,即原子利用率为100%
(2)Cu/ZnO;C;放热
(3)ad
(4)500℃;B
(5)24;更换了更高效的催化剂
解析:(1)反应Ⅰ中反应物完全转化,原子利用率为100%,符合“原子经济性”原则,而反应Ⅱ原子利用率不到100%,因此反应Ⅰ优于反应Ⅱ。
(2)①催化剂能改变化学反应速率,但反应前后质量和化学性质不变,由反应历程可知,催化剂为:Cu/ZnO。
②由题意可知,第2步反应几乎不影响总反应达到平衡所用的时间,说明第二步的活化能很小,比第一步的活化能小,但能量仍然比初始反应物的能量高,符合条件的为图C,答案选C;由图示可知,反应物的总能量大于生成物的总能量,该反应为放热反应。
(3)a.增加二氧化碳或氢气的量,反应物浓度增加,平衡正向移动,甲醇产率增大,a正确;
b.恒容条件下充入He,容器内总压强增大,但参与反应各物质浓度不变,平衡不移动,甲醇产率不变,b错误;
c.此反应为放热反应,升高温度,平衡逆向移动,甲醇产率减小,c错误;
d.按原比例再充入二氧化碳和氢气,由等效平衡可知,平衡正向移动,甲醇产率增大,d正确;
答案选ad。
(4)①由图1可知,该体系温度为500℃左右时,二氧化碳的转化率和甲醇的选择性都很高,因此最佳温度为500℃。
②A.催化剂对化学平衡移动无影响,A错误;
B.催化剂的活性在一定温度范围内最大,高于或低于这个温度范围,催化剂的活性降低,导致选择性降低,B正确;
C.使用催化剂,降低反应活化能,催化剂的活性降低,活化能应增大,C错误;
答案选B。
(5)根据图象并结合公式可得:,,联立方程,解得;当改变外界条件时,实验数据如图中的曲线b所示,此时满足:,,联立方程,解得,活化能减小,则实验改变的外界条件是更换了更高效的催化剂。
18、答案:(1)6;
(2)①
②B
(3)762.5;3902
(4)分子晶体;;
(5)立方BN晶体是共价晶体,B—N键键能大,所以质地坚硬;
解析:(1)Nd为60号元素,由于元素周期表中各个周期包含的元素种数分别是2、8、8、18、18、32、32,则Nd在元素周期表中位于第6周期第ⅢB族;Fe是26号元素,原子核外电子排布式为,则核外电子排布式为,价电子的轨道表示式为。
(2)①为双聚分子,结构式为,由题图知,每个Al原子价电子对数是4,根据价电子对互斥理论判断Al原子杂化类型为杂化。②中Al原子和O原子之间存在配位键、O—H原子之间存在极性键,配位键也属于共价键,故合理选项是B。
(3)Fe原子的第一电离能为Fe(g)原子失去1个电子形成(g)所需要的能量,故基态Fe原子的第一电离能为;FeO的晶格能是(g)与(g)形成1 ml FeO晶体时释放的能量,根据图示可知FeO的晶格能为。
(4)化合物四羰基镍为无色易挥发剧毒液体,熔点为-19.3 ℃,沸点为43 ℃,不溶于水,易溶于乙醇、苯、四氯化碳等有机溶剂,说明其构成微粒之间作用力小,具有分子晶体的特点,故四羰基镍的晶体类型是分子晶体,四羰基镍的配体是CO,含有2个原子,电子总数为14,所以根据等电子体的含义可知与CO互为等电子体的分子为,离子为。
(5)立方BN晶体硬度很大,其原因是立方BN晶体是共价晶体,原子半径小,B—N键键能大,断裂消耗能量高,故质地坚硬,熔、沸点高。根据BN晶体结构可知,在一个晶胞中含有的B原子数为,含有的N原子数,即一个晶胞中含有4个BN分子,晶胞中最近的B、N原子之间的距离为,该距离等于晶胞体对角线长度的,晶胞体对角线长度为,晶胞棱长为,晶胞体积,阿伏加德罗常数的值为。
19、答案:(1)
(2);
(3);
(4)不需要
(5)b
解析:(1)依据流程图分析可知,联碱法和氨碱法生产流程沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,且析出的均是,反应的化学方程式是,则离子方程式为。
(2)两种方法中煅烧炉内发生反应的化学方程式均是,可循环的X是;氨碱法生产中的母液中含有,加入CaO后,CaO和反应生成,与反应生成可循环利用,故Y是。
(3)联碱法中,母液中含有(少量),则Z中除了含有溶解的氨气、食盐外,还含有;氨碱法中,母液中含有(少量),向母液中加入CaO后,生成,与反应生成可循环利用,排出液W中主要含有、NaCl。
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气。
(5)常温时氯化铵的溶解度比氯化钠大,故a错误;通氨气使的浓度增大,使更多地析出,故b正确;加入食盐细粉的目的是提高的浓度,促进氯化铵结晶析出,故c错误。
A杭州亚运会奖牌表面材质属于金属材料
B炒糖色过程中白砂糖变为焦糖,该过程未发生化学反应
C切开的土豆放置后切面变色是因为土豆中的酚类被氧化
D焚烧秸秆时,产生二氧化硫、二氧化氮等污染性气体
选项
离子方程式
实验设计
A
用饱和碳酸钠溶液清除锅炉水垢中的
B
用明矾净化河水
C
用饱和溶液除去乙酸乙酯中的少量乙酸
D
蘸有浓盐酸的玻璃棒放在集气瓶口检验氨气是否集满
物质
相对分子质量
密度
沸点/℃
溶解度
对甲基苯胺
107
0.97
197.4
微溶于水
环己烷
84
0.78
80.7
难溶于水
对氯甲苯
126.5
1.07
159.2
难溶于水,易溶于乙醚、环己烷等有机溶剂
氢氧化物
开始沉淀pH
1.5
6.5
4.2
8.1
沉淀完全pH
3.7
9.7
7.4
10.1
江苏省前黄高级中学2023-2024学年高三上学期11月阶段检测化学试题含答案: 这是一份江苏省前黄高级中学2023-2024学年高三上学期11月阶段检测化学试题含答案,共15页。试卷主要包含了由含硒废料制取硒的流程如下等内容,欢迎下载使用。
江苏省南通市海安市高级中学2023-2024学年高三上学期11月阶段检测化学试题含答案: 这是一份江苏省南通市海安市高级中学2023-2024学年高三上学期11月阶段检测化学试题含答案,共14页。试卷主要包含了015等内容,欢迎下载使用。
河南省驻马店高级中学2023-2024学年高三上学期12月阶段检测化学试题含答案: 这是一份河南省驻马店高级中学2023-2024学年高三上学期12月阶段检测化学试题含答案,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












