





- 新教材2023版高中化学第1章化学反应与能量变化微项目1设计载人航天器用化学电池与氧气再生方案课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第1章化学反应与能量变化第1节化学反应的热效应第1课时化学反应的反应热内能变化与焓变课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第1章化学反应与能量变化第2节化学能转化为电能__电池第1课时原电池的工作原理课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第1章化学反应与能量变化第2节化学能转化为电能__电池第2课时化学电源课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第1章化学反应与能量变化第3节电能转化为化学能__电解第1课时电解的原理课件鲁科版选择性必修1 课件 0 次下载
鲁科版 (2019)选择性必修1第1节 化学反应的热效应教课内容ppt课件
展开素养新目标1. 理解盖斯定律的内容。2.能运用盖斯定律进行有关反应焓变的简单计算。3.通过盖斯定律的应用,体会其在科学研究中的意义。
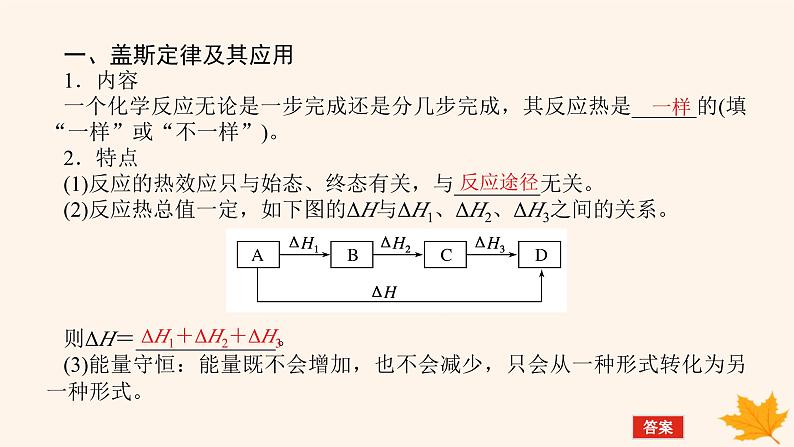
一、盖斯定律及其应用1.内容一个化学反应无论是一步完成还是分几步完成,其反应热是______的(填“一样”或“不一样”)。2.特点(1)反应的热效应只与始态、终态有关,与________无关。(2)反应热总值一定,如下图的ΔH与ΔH1、ΔH2、ΔH3之间的关系。 则ΔH=_____________。(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
ΔH1+ΔH2+ΔH3
3.应用(1)意义 (2)方法若一个化学反应的热化学方程式可由另外几个化学反应的热化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反应焓变的代数和。
a.虚拟路径: b.应用盖斯定律求解:ΔH1=________则:ΔH=___________________________________________________。
ΔH1-ΔH2=-393.5 kJ·ml-1-(-283.0 kJ·ml-1)=-110.5 kJ·ml-1
状元随笔 (1)盖斯定律的两个关键:①化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关。②利用盖斯定律可间接计算某些反应的反应热。(2)盖斯定律中的两个关系①总反应方程式=分反应方程式之和②总反应的焓变=分反应的焓变之和下图表示始态到终态的焓变,则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。 (3)盖斯定律可以间接计算某些反应的反应热。
二、能源1.定义:自然界中,能为人类提供_____的物质或物质运动统称为能源。2.分类
3.我国能源现状(1)我国目前使用最多的能源是_________,包括_____、______、______等,属于_________能源,并且能源利用率总体偏低。(2)开源节流:即一方面开发核能、风能、太阳能等新能源,另一方面大力实施节能减排,提高能源利用效率。
【即学即练】1.判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)摩尔燃烧焓的生成物是做实验的人随便指定的。( )(2)计算摩尔燃烧焓时生成物的状态一定是气态。( )
2.下列说法中正确的是( )A.ΔH>0表示放热反应,ΔH<0表示吸热反应B.热化学方程式中的化学计量数只表示物质的量,可以是分数C.同一化学反应的热化学方程式中的化学计量数改变,反应的焓变不变D.1 ml H2与0.5 ml O2反应放出的热量就是H2的燃烧热
解析:放热反应的焓变小于0,吸热反应的焓变大于0,故ΔH>0表示吸热反应,ΔH<0表示放热反应,A项错误;热化学方程式中的化学计量数只表示物质的量,所以可用分数表示,B项正确;同一化学反应的焓变随热化学方程式中的化学计量数的改变而改变,C项错误;燃烧热是指在101 kPa下,1 ml纯物质完全燃烧生成指定产物时所放出的热量,此时生成的水必须为液态,而1 ml氢气和0.5 ml氧气反应生成的水的状态未知,故放出的热量不一定是燃烧热,D项错误。
3.强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1。分别向1 L 0.5 ml·L-1的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH1<ΔH3C.ΔH1=ΔH2=ΔH3 D.ΔH1>ΔH3>ΔH2
解析:醋酸是弱电解质,电离时吸热,浓硫酸溶于水时放热,所以恰好完全反应时放出的热量Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因为放热反应中ΔH为负值,所以ΔH2<ΔH3<ΔH1。
5.在298 K、100 kPa时,已知:(1)C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·ml-1(2)2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·ml-1(3)2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2 599 kJ·ml-1则相同条件下,由C(s,石墨)和H2(g)生成1 ml C2H2(g)反应的焓变ΔH4是( )A.-226.7 kJ·ml-1 B.-326 kJ·ml-1C.+226.7 kJ·ml-1 D.+326 kJ·ml-1
解析:依据燃烧热数据结合图像分析,金刚石能量高于石墨,能量越高越活泼,故石墨比金刚石稳定,A项错误;结合图像可知,金刚石的能量比石墨的能量高,ΔH=ΔH1-ΔH2=-393.5 kJ·ml-1-(-395.0 kJ·ml-1)=+1.5 kJ·ml-1,B项正确;由图像分析,金刚石燃烧放出热量高,焓变为负值,放出的热量越多,焓变越小,则ΔH1>ΔH2,C项错误;催化剂只改变化学反应速率,不改变反应焓变,故ΔH1和ΔH2都不变,D项错误。
关键能力反应热大小的比较方法(1)比较ΔH的大小时,要注意ΔH的数值和符号,即要带符号(“+”或“-”)进行比较。若为放热反应,放出热量越多,ΔH越小;若为吸热反应,吸收热量越多,ΔH越大。(2)若没有给出ΔH的具体数值,则需注意反应物和产物的聚集状态(固态、液态、气态)及各反应间的联系,利用盖斯定律比较其大小。①同一反应,产物状态不同,如:A(g)+B(g)===C(g) ΔH1<0A(g)+B(g)===C(l) ΔH2<0因为C(g)===C(l) ΔH3<0,又ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。
(3)SiHCl3在催化剂作用下发生反应:2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·ml-13SiH2Cl2(g)===SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·ml-1则反应4SiHCl3(g)===SiH4(g)+3SiCl4(g)的ΔH为________ kJ·ml-1。(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.5 kJ·ml-1Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.4 kJ·ml-1Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3ΔH3=________kJ·ml-1。
解析: (3)令①2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·ml-1②3SiH2Cl2(g)===SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·ml-1根据盖斯定律,①×3+②得:4SiHCl3(g)===SiH4(g)+3SiCl4(g) ΔH=+114 kJ·ml-1。(4)根据盖斯定律可得:Ⅲ=Ⅰ-Ⅱ,则ΔH3=ΔH1-ΔH2=-49.5 kJ·ml-1-(-90.4 kJ·ml-1)=+40.9 kJ·ml-1。
状元随笔 应用盖斯定律计算反应焓变的方法(1)热化学方程式中的各项同乘以某一个数时,反应焓变数值也必须乘以该数。(2)热化学方程式相加减时,同种物质之间可相加减,反应焓变也随之相加减。(3)将一个热化学方程式左右颠倒时,ΔH的“+”“-”号必须随之改变(“+”可省略)。
关键能力利用盖斯定律进行问题分析的方法(1)热化学方程式加减法:根据需要将热化学方程式进行代数转换,然后相加减,得出所需要的热化学方程式。转换时应注意各物质的系数与ΔH的数值同等倍数的改变,ΔH的符号也作相应的改变。(2)虚拟途径法:先根据题意虚拟转化过程,然后根据盖斯定律列式求解,即可求得待求的反应焓变。(3)叠加各反应式时,有的反应要逆向写,ΔH的符号也相反。(4)比较反应热大小时,反应热所带“+”“-”均具有数学意义,参与大小比较。(5)利用键能计算反应热时,要注意物质中化学键的个数。
2.(双选)下列说法正确的是( )A.根据盖斯定律,可计算某些难以直接测得的反应焓变B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同C.如图中ΔH1=ΔH2+ΔH3 D.相同条件下,等质量的C按a、b两种途径完全转化,途径a与途径b放出相等热能,
3.化学反应过程可视为旧化学键断裂和新化学键形成的过程,H—H键的键能为436 kJ·ml-1,Cl—Cl键的键能为243 kJ·ml-1,H—Cl键的键能为431 kJ·ml-1。已知H2(g)+Cl2(g)===2HCl(g) ΔH=-Q kJ·ml-1,则Q等于( )A.-183 B.183C.-862 D.862
4.(双选)已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.0 kJ·ml-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下: 过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g) ΔH=+313.2 kJ·ml-1过程Ⅱ:……
下列说法正确的是( )A.过程Ⅰ中每消耗232 g Fe3O4转移4 ml电子B.过程Ⅱ热化学方程式为3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=+128.9 kJ·ml-1C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能D.铁氧化合物循环制H2具有成本低、产物易分离等优点
5.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 ml NH3(g)过程中能量的变化示意图,请写出1 ml N2(g)和H2(g)反应的热化学方程式:_______________________________________。(2)若已知下列数据:根据表中及图中数据计算N—H键的键能是____ kJ·ml-1。
N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·ml-1
解析:(1)由图像可知,该反应为放热反应,且生成1 ml NH3(g)时,放出的热量为(300-254) kJ=46 kJ。故N2和H2反应的热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·ml-1。(2)设N—H键的键能为x,故反应热ΔH=-92 kJ·ml-1=(3×435+943) kJ·ml-1-6×x,解得x=390 kJ·ml-1。
(3)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:4NH3(g)+3O2(g)===2N2(g)+6H2O(g)ΔH1=-a kJ·ml-1 ①N2(g)+O2(g)===2NO(g)ΔH2=-b kJ·ml-1 ②求:若1 ml NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·ml-1(用含a、b的式子表示)。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文课件ppt,共48页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,保温作用,反应容器,-CT2-T1,聚集状态,反应热,Q+W等内容,欢迎下载使用。
化学选择性必修1第1节 化学反应的热效应完美版课件ppt: 这是一份化学选择性必修1第1节 化学反应的热效应完美版课件ppt,共24页。PPT课件主要包含了学习目标,相应加减等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应集体备课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应集体备课课件ppt,共47页。PPT课件主要包含了内容索引,知识铺垫,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案C,已知反应,答案D等内容,欢迎下载使用。













