

2023-2024学年黑龙江省哈尔滨市高三上学期11月期中化学模拟试题(含答案)
展开可能用到的相对原子质量:H :1 B:11 C: 12 O: 16 Na: 23 Mg: 24 Al: 27
选择题(每小题只有1个选项符合题意,每题4分,共60分)
1.生活中处处有化学,下列叙述正确的是
A.HB铅笔芯的成分为二氧化铅 B.碳酸氢钠可做食品膨松剂
C.青铜和黄铜是不同结构的单质铜 D.焰火中红色来源于钠盐灼烧
2. 《新修本草》是我国古代中药学著作之一,其中关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”。“青矾”的主要成分FeSO4· 7H2O,属于
A. 酸 B. 碱 C. 盐 D.氧化物
3.下列有关物质的性质与用途具有对应关系的是
A.Al2O3 熔点高,可用作耐高温材料 B NH4HCO3受热易分解,可用作氮肥
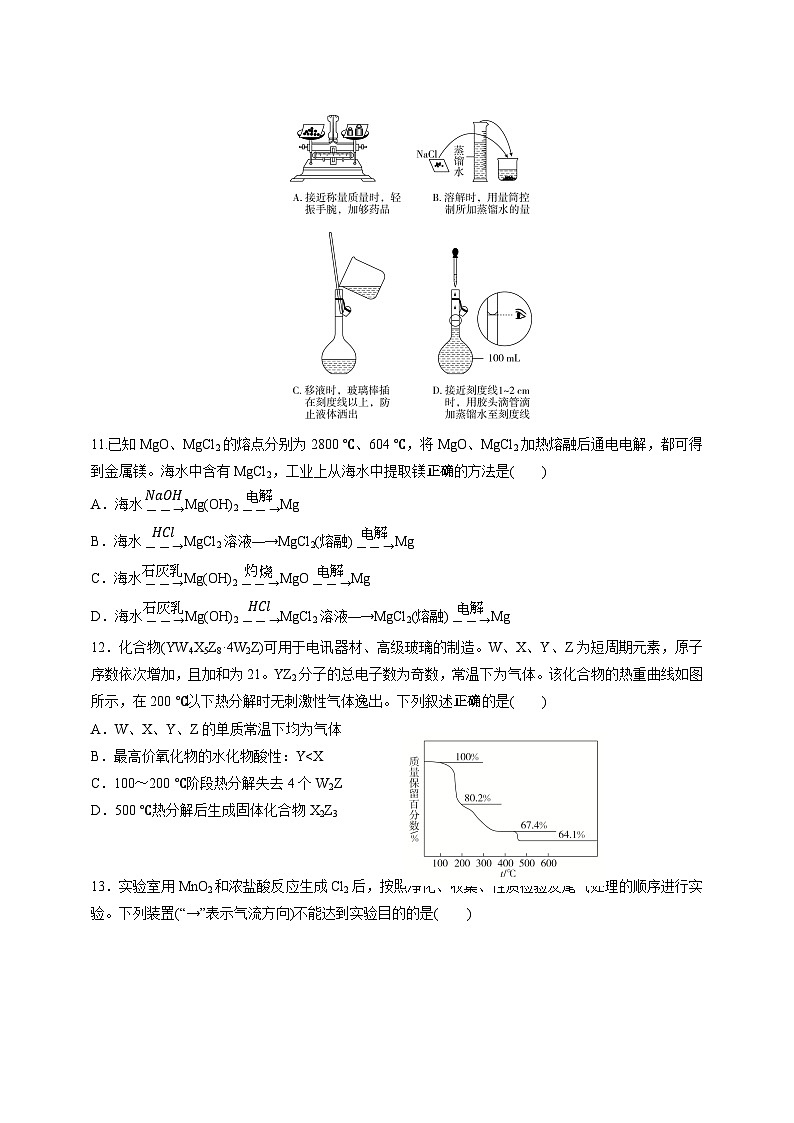
C. 明矾易溶于水,可用作净水剂 D.SO2 具有还原性,可用于漂白纸浆
4. 下列生产活动中涉及的化学原理正确的是
5. 下列实验操作不能达到实验目的的是
6. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液:Al3+、K+、HCO3-、Cl-
B. pH=2的溶液:Na+、MnO4-、SO42-、I-
C. c(NaAlO2])=0.1 ml·L-1的溶液:K+、OH-、Cl-、SO42-
D.中性溶液中:Fe3+、Mg2+、SO42-、NO3-
7.下列离子方程式错误的是
A. 向NaClO溶液中通入少量SO2 :2ClO-+SO2+H2O=2HClO+SO32-
B. 高锰酸钾与浓盐酸反应制氯气:2MnO4-+10Cl-+16H+ =2Mn2+ +5Cl2↑+ 8H2O
C. FeBr2通入少量的Cl2:2Fe2++Cl2 =2Fe3++2Cl-
D. 向Na2SO3的酸性溶液中加入Na2S:2S2-+SO32-+6H+=3S↓+3H2O
8.用NA表示阿伏伽德罗常数,下列说法正确的是
A. 标准状况下,11.2 L的HF中所含分子数为0.5NA
B. 标准状况下,11.2LCH4和C2H4混合气体中含氢原子数目为2NA
C. 密闭容器中,2mlSO2和1mlO2催化反应后分子总数为2NA
D. 100mL1ml/LFeCl3溶液中含Fe3+的数目为0.1NA
9.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
10.配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
11.已知MgO、MgCl2的熔点分别为2800 ℃、604 ℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁正确的方法是( )
A.海水NaOH――→Mg(OH)2电解――→Mg
B.海水HCl――→MgCl2溶液―→MgCl2(熔融)电解――→Mg
C.海水石灰乳――→Mg(OH)2灼烧――→MgO电解――→Mg
D.海水石灰乳――→Mg(OH)2HCl――→MgCl2溶液―→MgCl2(熔融)电解――→Mg
12.化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:Y
D.500 ℃热分解后生成固体化合物X2Z3
13.实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
13题图 14题图
14.若将铜丝插入热浓硫酸中进行如上图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.a处变红,说明SO2是酸性氧化物
B.Cu与浓硫酸反应,只体现H2SO4的酸性
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
15.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )
A.NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B.汽车尾气中的主要大气污染物为NO、SO2和PM2.5
C.植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
D.工业废气中的SO2可采用石灰法进行脱除
非选择题(共40分)
16.(10分)金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的原子结构示意图表示式为_____,在周期表中的位置是 。
(2)Na2O2的电子式为___________。Na2O2可作供氧剂,写出Na2O2与CO2反应的化学方程式___________。若有1mlNa2O2参加反应则转移电子的物质的量为___________ml。
(3)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过___________、___________(填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应: ______MnO+_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式;该反应说明Na2O2具有___________性(选填“氧化”,“还原”或“漂白”)。
(5)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1mlNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为___________g。
17.(7分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O26SO2+Fe3O4,氧化产物为 ,若有3 ml FeS2参加反应,转移 ml电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)。
18.(11分)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式_______。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_______。
(3)“母液①"中Mg2+浓度为_______ml·L-1。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是_______。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
19.(12分)二草酸合铜(Ⅱ)酸钾(K2[Cu(C2O4)2])可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的CuSO4溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由CuSO4·5H2O配制Ⅰ中的CuSO4溶液,下列仪器中不需要的是________(填仪器名称)。
(2)长期存放的CuSO4·5H2O中,会出现少量白色固体,原因是________。
(3)Ⅰ中的黑色沉淀是________(写化学式)。
(4)Ⅱ中原料配比为n(H2C2O4):n(K2CO3)=1.5:1,写出反应的化学方程式________。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入K2CO3应采取________的方法。
(6)Ⅲ中应采用________进行加热。
(7)Ⅳ中“一系列操作”包括________。
化学试题 答案
选择题(每小题只有1个选项符合题意,每题5分,共60分)
4.B 5.B 6.D 7.A 8.B 9.A 10.C
11.D 12.D 13.D 14.B 15.D
二、非选择题(共40分)
16、(10分)(1)① ②第三周期第ⅠA族
(2)①. ②. ③ 1
(3)①. c ②. a
(4)①. ②. 还原性
(5)159
17.(7分)(1) SO2、Fe3O4 32
(2) 2Fe3++Cu=2Fe2++Cu2+
(3)Fe3++3H2OFe(OH)3(胶体)+3H+
18.(11分) (1).
(2). (3). (4). 硫酸 (5). (6).
19.(12分)(1)分液漏斗和球形冷凝管
(2)风化失去结晶水生成无水硫酸铜
(3)CuO (4)3H2C2O4+2K2CO3=2KHC2O4+K2C2O4+2H2O+2CO2↑
(5)分批加入并搅拌 (6)水浴
(7)冷却结晶、过滤、洗涤
选项
生产活动
化学原理
A
从石油中得到直馏汽油
烷烃发生裂化反应
B
侯氏制碱法得到NaHCO3沉淀
NaHCO3溶解度较小
C
利用FeCl3溶液刻蚀印刷电路板
Fe的活动性比Cu强
D
用焦炭还原石英砂制粗硅
C的氧化性比Si强
实验目的
实验操作、现象
A
制备Fe(OH) 3胶体
将饱和的FeCl3溶液滴入沸水中,并加热至溶液呈红褐色为止
B
除去MgCl2溶液中的AlCl3
在MgCl2溶液中加入适量NaOH溶液搅拌、过滤
C
除去Cu粉中混有的CuO
在混合物中加入足量稀硫酸,充分反应后过滤、洗涤、干燥
D
比较氯和碘的非金属性
将少量氯气通入碘化钾溶液中,加入少量四氯化碳液体,振荡、静置,溶液分层,下层为紫色
金属离子
Fe3+
Al3+
Mg2+
Ca2+
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全的pH
3.2
4.7
11.1
13.8
2023-2024学年黑龙江省哈尔滨市高三上学期12月月考化学模拟试题(含答案): 这是一份2023-2024学年黑龙江省哈尔滨市高三上学期12月月考化学模拟试题(含答案),共11页。
黑龙江省哈尔滨市第九中学校2023-2024学年高三上学期期中考试化学试卷: 这是一份黑龙江省哈尔滨市第九中学校2023-2024学年高三上学期期中考试化学试卷,共9页。
黑龙江省哈尔滨市2023-2024学年度铁人中学高一学年上学期期中化学测试题和答案: 这是一份黑龙江省哈尔滨市2023-2024学年度铁人中学高一学年上学期期中化学测试题和答案,共9页。












