

必考点5 化学能与热能-【对点变式题】2021-2022学年高一化学下学期期中期末必考题精准练(人教版2019)(原卷版)
展开题型一 化学反应与热能的转化
例题1
下列关于化学反应与能量的说法正确的是( )
A.化学反应中一定有物质变化,但不一定有能量变化
B.CaO+H2O=Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量
C.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需加热就能发生,说明该反应是放热反应
D.由H2→2H的过程需要吸收能量
例题2
反应A+B→C(放热)分两步进行:①A+B—→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A.B.
C.D.
题型二 利用化学键计算化学反应中的能量变化
例题1
已知断裂中的键需要吸收436kJ的能量,断裂1ml中的共价键需要吸收498kJ的能量,生成中的1ml键能放出462.8kJ的能量。下列说法正确的是( )
A.断裂1ml中的化学键需要吸收925.6kJ的能量
B.,1ml参与应放出能量481.2kJ
C.,该反应放出能量471.6kJ
D.,1ml参与反应放出能量240.6kJ
例题2
依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 ml理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·ml-1,是指使1 ml H2分子变成2 ml H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·ml-1,下列叙述正确的是_______(填字母,下同)。
A.每生成1 ml H-Cl键放出431 kJ能量
B.每生成1 ml H-Cl键吸收431 kJ能量
C.每拆开1 ml H-Cl键放出431 kJ能量
D.每拆开1 ml H-Cl键吸收431 kJ能量
(2)已知键能:H-H键为436 kJ·ml-1;H-F键为565 kJ·ml-1;H-Cl键为431 kJ·ml-1;H-Br键为366 kJ·ml-1。则下列分子受热时最稳定的是_______。
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是_______。
A.氮气的化学性质比氧气稳定
B.常温常压下溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 ml N原子和3 ml H原子生成1 ml NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(2)0.5 ml N2(g)和1.5 ml H2(g)生成1 ml NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(3)1 ml NH3(l)生成1 ml N原子和3 ml H原子的过程_______(填“吸收”或“放出”)_______kJ能量。
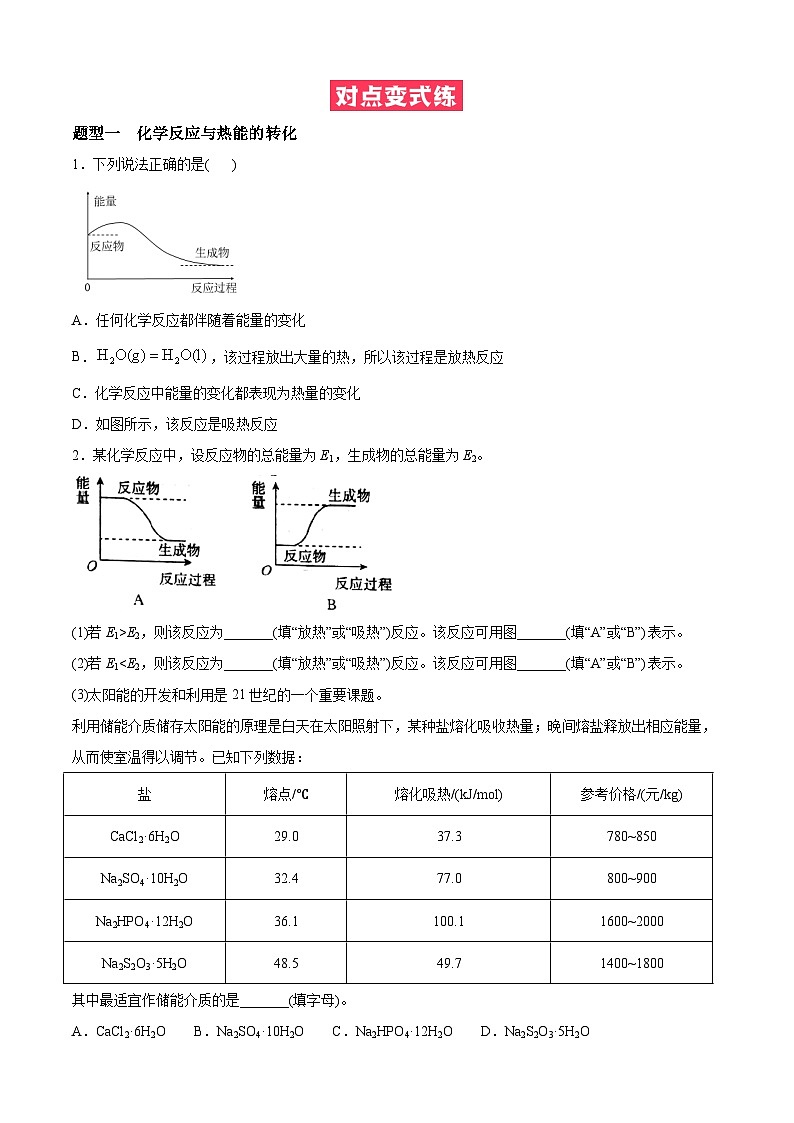
题型一 化学反应与热能的转化
1.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.,该过程放出大量的热,所以该过程是放热反应
C.化学反应中能量的变化都表现为热量的变化
D.如图所示,该反应是吸热反应
2.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
(1)若E1>E2,则该反应为_______(填“放热”或“吸热”)反应。该反应可用图_______(填“A”或“B”)表示。
(2)若E1
利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
其中最适宜作储能介质的是_______(填字母)。
A.CaCl2·6H2O B.Na2SO4·10H2O C.Na2HPO4·12H2O D.Na2S2O3·5H2O
题型二 利用化学键计算化学反应中的能量变化
3.下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.拆开2mlH2 (g)和1 mlO2(g)中的化学键成为H、O原子,共放出1368 kJ能量
B.由H、O原子形成2 mlH2O(g),共吸收1852 kJ能量
C.2 mlH2(g)和1 mlO2 (g)反应生成2 ml H2O(1),共吸收484 kJ能量
D.2 mlH2 (g)和1 mlO2(g)反应生成2 mIH2O(g),共放出484 kJ能量
4.已知化学反应的能量变化如图所示,下列叙述正确的是( )
A.每生成2分子吸收能量
B.该反应属于吸热反应
C.该反应中反应物的总能量高于生成物的总能量
D.断裂键和键,放出能量
5.根据要求回答下列问题:
(1)下列过程不一定释放能量的是________。
A.化合反应 B.分解反应 C形成化学键 D.燃料燃烧 E.酸碱中和 F.炸药爆炸
(2)等质量的下列物质分别完全燃烧生成,放出热量较多的是__________。
A.硫蒸气 B.硫固体
(3)已知和反应生成是放热反应,且断开1ml H-H键、1ml Cl-Cl键、1ml H-Cl键需吸收的能量分别为kJ、kJ、kJ。由此可以推知下列关系正确的是_______(填序号)。
A. B. C. D. E. F.
1.(2021·黑龙江·大兴安岭实验中学高一期中)下列说法不正确的是
A.当今社会人们所需的能量绝大部分是由化学反应产生的
B.目前,全球仍处于化石能源时代
C.人体生命活动所需要的能量,是由氧化还原反应提供的
D.凡是放出热量的化学反应均可用来造福人类
2.下列说法正确的是
A.已知石墨转化为金刚石是吸热反应,所以石墨比金刚石稳定
B.凡是需要加热的反应都是吸热反应
C.灼热的炭与CO2的反应既是氧化还原反应又是放热反应
D.干冰易升华,这与分子中C=O键的键能大小有关
3.下列化学变化中,反应物的总能量低于生成物的总能量的是( )
A.2H2+O2=2H2O
B.CaO+H2O=Ca(OH)2
C.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
D.Fe+2HCl=FeCl2+H2↑
4.下列关于反应能量的说法中正确的是( )
A.化学反应中的能量变化,都表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知反应:Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量
D.相同条件下,如果1 ml氢原子所具有的能量为E1,1 ml氢分子的能量为E2,则2E1=E2
5.(2021·福建福州·高一期末)某同学按图1所示装置,探究盐酸与NaOH溶液反应的热效应,测得烧杯中溶液温度随加入a溶液的体积变化关系如图2所示。下列判断错误的是
A.a可能是NaOH溶液
B.x、y、z三点对应的溶液中,参加反应的酸、碱质量比不变
C.由图2可知该反应存在化学能转化为热能
D.往y点对应溶液中加入Fe粉,有气泡产生
6.不同条件下,可发生反应,,转化过程中能量变化如图所示。下列说法正确的是( )
A.是放热反应
B.、、三种物质中最不稳定的是
C.反应中反应物的总键能大于生成物的总键能
D.若可转化为,则转化为的反应是放热反应
7.根据如图所示示意图,下列说法不正确的是( )
A.反应C(s)+H2O(g)=CO(g)+H2(g),能量减少(b-a)kJ/ml
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.1mlC(s)和1mlH2O(g)反应生成1 mlCO(g)和1mlH2(g)吸收的热量为131.3kJ
D.1mlC(s)、2mlH、1mlO转变成1mlCO(g)和1mlH2(g)放出的热量为a kJ
8.化学反应中不仅有物质变化而且伴随着能量变化。
(1)以下实验中属于吸热反应的是________(填序号)。
(2)下图中,表示放热反应能量变化的是_______(填字母)。
(3)从微观角度分析化学反应中能量变化的原因:
图中①和②分别为_____________、_____________(填“吸收”或“释放”)。氢气与氧气反应生成1ml水蒸气时,释放________kJ能量。
(4)当前,很多地区倡导用天然气替代煤作为家用燃料,根据下表从尽可能多的角度分析其原因是______________________________________。
盐
熔点/℃
熔化吸热/(kJ/ml)
参考价格/(元/kg)
CaCl2·6H2O
29.0
37.3
780~850
Na2SO4·10H2O
32.4
77.0
800~900
Na2HPO4·12H2O
36.1
100.1
1600~2000
Na2S2O3·5H2O
48.5
49.7
1400~1800
燃料
燃烧释放的能量(每1千克)
天然气
55812kJ
煤
20908kJ
必考点7 化学反应的速率与限度-【对点变式题】2021-2022学年高一化学下学期期中期末必考题精准练(人教版2019)(原卷版): 这是一份必考点7 化学反应的速率与限度-【对点变式题】2021-2022学年高一化学下学期期中期末必考题精准练(人教版2019)(原卷版),共1页。
必考点07 -羧酸-【对点变式题】2021-2022学年高二化学下学期期中期末必考题精准练(人教版2019选择性必修3) (原卷版): 这是一份必考点07 -羧酸-【对点变式题】2021-2022学年高二化学下学期期中期末必考题精准练(人教版2019选择性必修3) (原卷版),共1页。试卷主要包含了羧酸的结构,羧酸的性质及与应用等内容,欢迎下载使用。
必考点7 化学反应的速率与限度-【对点变式题】2021-2022学年高一化学下学期期中期末必考题精准练(人教版2019)(解析版): 这是一份必考点7 化学反应的速率与限度-【对点变式题】2021-2022学年高一化学下学期期中期末必考题精准练(人教版2019)(解析版),共1页。












