

03 考向3 离子共存及应用(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用)
展开离子共存及应用
【知识网络•悉考点】
【研析真题•明方向】
1.(2022·湖北卷)下列各组离子在给定溶液中能大量共存的是( )
A.在0.1 mol·L-1氨水中:Ag+、Cu2+、NO、SO
B.在0.1 mol·L-1氯化钠溶液中:Fe3+、I-、Ba2+、HCO
C.在0.1 mol·L-1醋酸溶液中:SO、NH、Br-、H+
D.在0.1 mol·L-1硝酸银溶液中:K+、Cl-、Na+、CO
2.(2021·湖南卷)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
粒子组
判断和分析
A
Na+、Al3+、Cl-、NH3·H2O
不能大量共存,因发生反应:
Al3++4NH3·H2O===AlO+4NH+2H2O
B
H+、K+、S2O、SO
不能大量共存,因发生反应:2H++S2O===S↓+SO2↑+H2O
C
Na+、Fe3+、SO、H2O2
能大量共存,粒子间不反应
D
H+、Na+、Cl-、MnO
能大量共存,粒子间不反应
3.(2021·天津卷)常温下,下列各组离子在给定溶液中能大量共存的是( )
A. pH=1的溶液:Fe2+、Mg2+、SO、NO B. pH=12的溶液:K+、Na+、NO、CO
C. pH=7的溶液:Na+、Cu2+、S2-、Cl- D. pH=7的溶液:Al3+、K+、Cl-、HCO
4.(2020·江苏卷)常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1氨水溶液:Na+、K+、OH-、NO
B.0.1 mol·L-1盐酸溶液:Na+、K+、SO、SiO
C.0.1 mol·L-1 KMnO4溶液:NH、Na+、NO、I-
D.0.1 mol·L-1 AgNO3溶液:NH、Mg2+、Cl-、SO
5.(2019·江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO、AlO
B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO、MnO
C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 mol·L-1 H2SO4溶液:K+、NH、NO、HSO
6.(2018·江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 KI溶液:Na+、K+、ClO-、OH-
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.0.1 mol·L-1 HCl溶液:Ba2+、K+、CH3COO-、NO
D.0.1 mol·L-1 NaOH溶液:Mg2+、Na+、SO、HCO
【重温知识•固基础】
1.离子不能共存的四种类型
(1)发生复分解反应而不能大量共存
①生成难溶物或微溶物
a.Ag+与Cl-、Br-、I-、CO
b.Ba2+与SO、CO、SO、SiO
c.Ca2+与CO、SO、F-、SiO
d.H+ 与SiO、AlO、S2O
e.OH-与Mg2+、Al3+、Zn2+、Fe3+、Cu2+、Fe2+
f.S2-与Cu2+、Fe2+
g.四种微溶物:Ca(OH)2、Ag2SO4、MgCO3、CaSO4
②生成气体或挥发性物质
a.H+与CO、HCO、SO、HSO、S2-、HS-、S2O
b.NH和OH-生成NH3(加热)
③生成难电离物质
a.生成水不能大量共存:OH-与HCO、HS-、HSO
b.生成弱酸不能大量共存:H+与CO、S2-、SO、ClO-、F-、CH3COO-、HCO、HS-、HSO
c.生成弱碱不能大量共存:OH-与NH
(2)发生氧化还原反应而不能大量共存:一般情况下,具有较强氧化性离子与具有较强还原性离子,会发生氧化还原反应而不能大量共存
①常见的氧化性离子:ClO-、MnO(H+)、NO(H+)、Fe3+、Cr2O、FeO
②常见的还原性的离子:S2-(HS-)、SO(HSO)、I-、Fe2+
a.Fe3+可氧化S2-(HS-)、SO(HSO)、I-
b.NO(H+)可氧化S2-(HS-)、SO(HSO)、I-、Fe2+
c.ClO-在碱性条件下可氧化S2-(HS-)、SO(HSO)、I-、Fe2+
d.ClO-(H+)、MnO(H+)、Cr2O可氧化S2-(HS-)、SO(HSO)、I-、Fe2+
③NO与I-、S2-与SO、Cl-与ClO-等在酸性条件下不能共存,而在碱性条件下可共存
(3)发生相互促进的水解反应而不能大量共存:某些弱碱阳离子与某些弱酸酸根离子因发生相互促进的水解反应而不能大量共存
①Al3+和CO、HCO3-、S2-、SO 、HS-、AlO2-、SiO、ClO-
②Fe3+和CO、HCO3-、AlO2-、SiO、ClO-
③Al3+、Fe3+因其在水溶液中当pH为3~4左右时即能完全水解成Al(OH)3、Fe(OH)3沉淀,所以Al3+、Fe3+几乎与所有的弱酸根离子都不能大量共存
④NH4+和AlO、SiO [AlO、SiO与所有的弱碱阳离子全部双水解]
⑤NH与CH3COO-、CO,Mg2+与HCO等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存
(4)发生络合反应而不能大量共存
①Fe3+与SCN-因生成Fe(SCN)3而不能大量共存
②Ag+、Cu2+与NH3·H2O因生成[Ag(NH3)2]+、[Cu(NH3)4]2+而不能大量共存
2.离子推断的“四项基本原则”
(1)肯定性原则:根据现象推断溶液中肯定存在或肯定不存在的离子(记住常见有色离子)
(2)互斥性原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在(注意题目中的隐含条件,如酸性、碱性、指示剂变化、水的电离情况等)
(3)电中性原则:溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中正电荷总数与负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)
(4)进出性原则:指在实验过程中反应生成的离子或引入的离子对后续实验的干扰
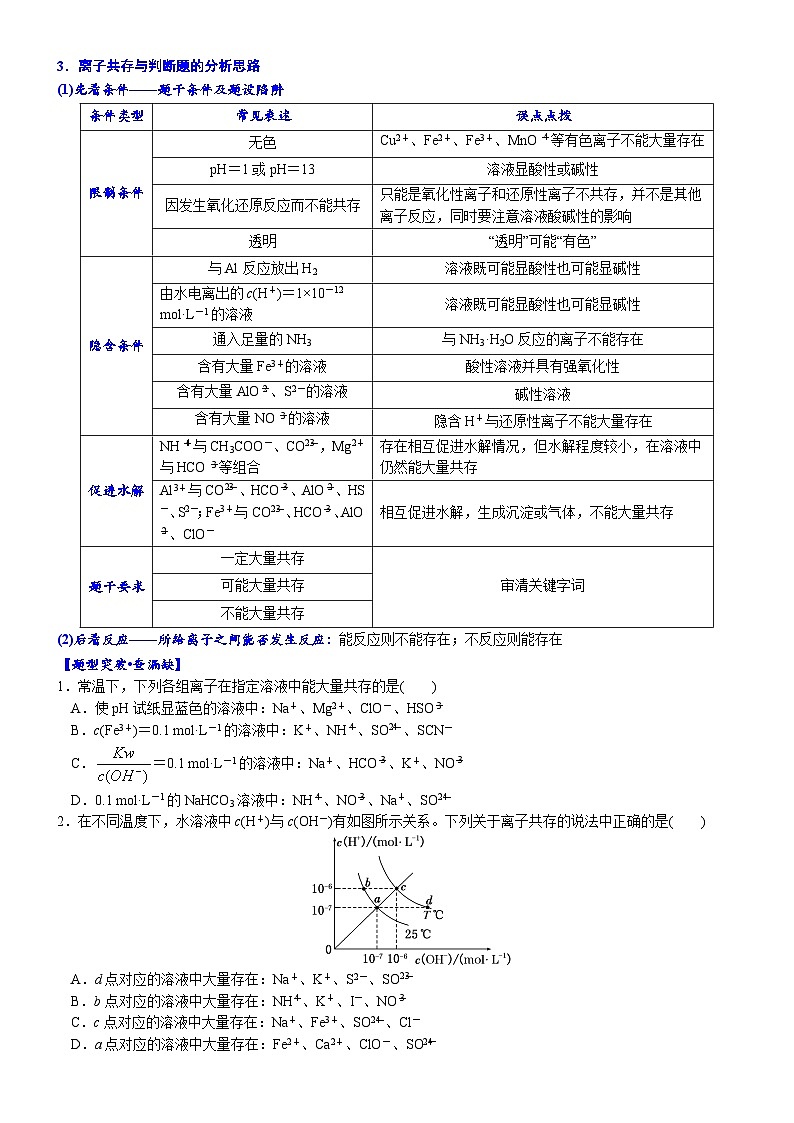
3.离子共存与判断题的分析思路
(1)先看条件——题干条件及题设陷阱
条件类型
常见表述
误点点拨
限制条件
无色
Cu2+、Fe2+、Fe3+、MnO等有色离子不能大量存在
pH=1或pH=13
溶液显酸性或碱性
因发生氧化还原反应而不能共存
只能是氧化性离子和还原性离子不共存,并不是其他离子反应,同时要注意溶液酸碱性的影响
透明
“透明”可能“有色”
隐含条件
与Al反应放出H2
溶液既可能显酸性也可能显碱性
由水电离出的c(H+)=1×10-12 mol·L-1的溶液
溶液既可能显酸性也可能显碱性
通入足量的NH3
与NH3·H2O反应的离子不能存在
含有大量Fe3+的溶液
酸性溶液并具有强氧化性
含有大量AlO、S2-的溶液
碱性溶液
含有大量NO的溶液
隐含H+与还原性离子不能大量存在
促进水解
NH与CH3COO-、CO,Mg2+与HCO等组合
存在相互促进水解情况,但水解程度较小,在溶液中仍然能大量共存
Al3+与CO、HCO、AlO、HS-、S2-;Fe3+与CO、HCO、AlO、ClO-
相互促进水解,生成沉淀或气体,不能大量共存
题干要求
一定大量共存
审清关键字词
可能大量共存
不能大量共存
(2)后看反应——所给离子之间能否发生反应:能反应则不能存在;不反应则能存在
【题型突破•查漏缺】
1.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO
B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH、SO、SCN-
C.=0.1 mol·L-1的溶液中:Na+、HCO、K+、NO
D.0.1 mol·L-1的NaHCO3溶液中:NH、NO、Na+、SO
2.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列关于离子共存的说法中正确的是( )
A.d点对应的溶液中大量存在:Na+、K+、S2-、SO
B.b点对应的溶液中大量存在:NH、K+、I-、NO
C.c点对应的溶液中大量存在:Na+、Fe3+、SO、Cl-
D.a点对应的溶液中大量存在:Fe2+、Ca2+、ClO-、SO
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、Cl-、SO
B.能溶解Al2O3的溶液:Na+、K+、Cl-、SiO
C.无色透明溶液中:Al3+、Cu2+、Cl-、HCO
D.使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol· L-1 FeSO4溶液:Na+、K+、Cl-、NO
B.滴入酚酞变红色的溶液:K+、Ca2+、HCO、CO
C.加入铁粉放出氢气的溶液:NH、Fe3+、ClO-、SO
D.水电离的c(H+)=1×10-13 mol· L-1的溶液:K+、Mg2+、I-、C6H5O-
5.常温下,下列各离子组在指定溶液中能大量存在的是( )
A.无色溶液中:K+、MnO、NO、Cl-
B.c(Fe3+)=0.1 mol·L-1的溶液中:H+、I-、Br-、SO
C.使石蕊变红的溶液中:Na+、NH、NO、SO
D.pH=13的溶液中:Na+、ClO-、CO、SO
6.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.NaHCO3溶液:K+、SO、Cl-、AlO
B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO
C.=1012的溶液中:NH、Al3+、NO、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN-
7.某溶液可能含有Cl-、SO、CO、NH、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子 B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO、NH一定存在,Cl-可能不存在 D.CO、Al3+一定不存在,K+可能存在
8.有一混合物的水溶液可能含有以下离子中的若干种:Na+、NH、Cl-、Ba2+、HCO、SO,现取两份100 mL的该溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到标准状况下的气体448 mL
②第二份加足量Ba(OH)2溶液,得沉淀4.30 g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33 g
根据上述实验,下列推测正确的是( )
A.Ba2+一定存在 B.100 mL该溶液中含0.01 mol HCO
C.Na+不一定存在 D.Cl-不确定,可向原溶液中加入AgNO3溶液进行检验
9.某溶液中可能含有SO、NO、CO、NH、Fe2+、Fe3+、Al3+、Na+中的几种,且所含阴离子浓度相同(忽略OH-和H+)。某化学兴趣小组设计了如下实验方案以确定该溶液中所含离子成分,下列说法正确的是( )
A.该溶液中一定含有SO、NH、Fe3+、Na+
B.溶液中一定只含有三种阳离子
C.通过计算,溶液中一定含有Fe2+,且其浓度可能与Fe3+相等
D.向溶液中加入少量盐酸,一定会有红棕色气体产生
【题型特训•练高分】
1.室温下,下列各组离子在指定溶液中能共存的是( )
A.0.1 mol·L-1 NaHCO3溶液:K+、Al3+、NO、SO
B.使蓝色石蕊试纸变红的溶液:Mg2+、Na+、SO、NO
C.滴加KSCN溶液显红色的溶液:NH、K+、Cl-、I-
D.由水电离产生的c(H+)=1×10-12 mol·L-1的溶液:NH、Ca2+、Cl-、AlO
2.实验室欲配制一种仅含4种离子(不考虑水电离出的离子)的溶液,且溶液中4种离子的浓度均为1 mol·L-1,能达到此目的的是( )
A.Al3+、K+、SO、NO B.ClO-、I-、H+、Na+
C.Na+、Mg2+、SO、Cl- D.Ba2+、OH-、CO、K+
3.常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.c(Fe3+)=0.1 mol·L-1的溶液中:Cu2+、NH、NO、SCN-
B.=1012的溶液中:Ca2+、Ba2+、HCO、NO
C.使酚酞变红色的溶液:Na+、K+、AlO、Cr2O
D.由水电离的c(H+)=1×10-12 mol·L-1的溶液中:Na+、NH、I-、SO
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在新制饱和氯水中:NH、Na+、SO、SO
B.在能使红色石蕊试纸变蓝的溶液中:Cu2+、K+、HCO、CO
C.在加入铝粉能产生H2的溶液中:Fe2+、Na+、SO、NO
D.在c(H+)=1×10-11 mol·L-1的溶液中:Na+、K+、S2-、SO
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol· L-1的氨水:Cu2+、Na+、SO、NO
B.0.1 mol· L-1的CaCl2溶液:Na+、K+、Cl-、NO
C.0.1 mol· L-1的Na2SO3溶液:K+、H+、SO、NO
D.0.1 mol· L-1的NaHCO3溶液:K+、Na+、NO、OH-
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在新制饱和氯水中:NH、Na+、SO、SO
B.在能使红色石蕊试纸变蓝的溶液中:Cu2+、K+、HCO、CO
C.在加入铝粉能产生H2的溶液中:Fe2+、Na+、SO、NO
D.在c(H+)=1×10-11mol·L-1的溶液中:Na+、K+、S2-、SO
7.室温下,下列各组离子在指定溶液中不能大量共存的是( )
A.能使石蕊变红的无色溶液:NH、Ba2+、Al3+、Cl-
B.0.1mol·L-1碘水:Na+、NH、SO、Cl-
C.0.1mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
D.pH=2的溶液中:K+、NO、ClO、Fe3+
8.在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO
B.滴入KSCN溶液显血红色的溶液中:NH、Mg2+、SO、Cl-
C.=1012的溶液中:NH、Al3+、NO、CO
D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH、AlO、HCO
9.水溶液中能大量共存的一组离子是( )
A.NH、Ba2+、Br-、CO B.Cl-、SO、Fe2+、H+
C.K+、Na+、SO、MnO D.Na+、H+、NO、HCO
10.下列离子组能大量共存且加入(或通入)试剂发生反应的离子方程式正确的是( )
选项
离子组
试剂
离子方程式
A
Mg2+、Fe3+、Cl-
足量Cu粉
Fe3++Cu===Fe2++Cu2+
B
K+、SO、Cl-
少量Cl2
3SO+Cl2+H2O===2Cl-+SO+2HSO
C
H+、Fe2+、SO
少量Ba(NO3)2
Ba2++SO===BaSO4↓
D
Fe3+、NH、OH-
足量NaOH溶液
Fe3++3OH-===Fe(OH)3↓
11.下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
选项
微粒组
加入试剂
发生反应的离子方程式
A
K+、Na+、HCO、SiO
少量HCl
2H++SiO===H2SiO3↓
B
NH、Fe2+、Br-、SO
过量H2S
Fe2++H2S===FeS↓+2H+
C
HClO、Na+、Fe3+、SO
过量CaCl2
Ca2++ SO===CaSO3↓
D
I-、Cl-、H+、SO
适量NaNO3
6I-+2NO+8H+===2NO↑+4H2O+3I2
12.X溶液中含有下表所示离子中的某5种,且其离子浓度均为0.1 mol·L-1(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子
Na+、Fe3+、Ba2+、Fe2+、Mg2+、Al3+
阴离子
OH-、NO、CO、SO、Cl-
A.原溶液中一定含有Mg2+
B.X溶液中不可能含有CO
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子方程式为3Fe2++NO+4H+===3Fe3++NO↑+2H2O
13.某固体混合物中可能含有:K+、Na+、Cl-、CO、SO等离子,将该固体溶解所得到的溶液进行了如下实验,下列说法正确的是( )
A.该混合物一定是K2CO3和NaCl B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3 D.该混合物一定是Na2CO3和NaCl
14.实验室中有一瓶无色透明的溶液,可能含有Na+、NH、Cu2+、Al3+、NO、Cl-、SO、CO中的一种或几种,且该溶液所含阴离子的浓度相同。某化学学习小组为确定该溶液的成分,做了如下实验探究,下列判断正确的是( )
实验
实验操作及现象
①
取该未知溶液100 mL,加入过量NaOH溶液,并加热,得到0.02 mol气体,无沉淀析出
②
在实验①后的溶液中通入足量CO2,得到白色沉淀,将沉淀过滤、洗涤、灼烧,得到1.02 g固体
③
另取该未知溶液100 mL,加入足量Ba(NO3)2溶液,得到4.66 g不溶于硝酸的沉淀
A.溶液中一定不存在Cu2+、Cl-、CO
B.不能确定溶液中是否存在Na+、NO
C.原溶液存在5种离子,浓度均为0.2 mol·L-1
D.向该溶液中滴加少量FeCl2溶液,则溶液中的阴离子的总物质的量减小
【离子共存及应用】答案
【研析真题•明方向】
1.C。解析:A.氨水显碱性,会与Ag+、Cu2+反应,不能大量共存,A项错误;B.Fe3+、I-会发生氧化还原反应,不能大量共存,B项错误;C.醋酸显酸性,在醋酸溶液中SO、NH、Br-、H+均不会发生反应,能大量共存,C项正确;D.硝酸银中的银离子会与氯离子反应生成沉淀,不能大量共存,D项错误;答案选C。
2.B。解析:Al3+与NH3·H2O反应产生Al(OH)3沉淀,不产生AlO,A错误;H+与S2O不能共存,发生反应的离子方程式为2H++S2O===S↓+SO2↑+H2O,B正确;Fe3+可催化H2O2分解,不能大量共存,C错误;酸性条件下,MnO可将Cl-氧化为Cl2,D错误。
3.B。解析A.pH=1的溶液中,NO在酸性条件下与Fe2+会发生氧化还原反应,不能大量共存,故A错误;
B.pH=12的溶液中,K+、Na+、NO、CO均不能发生反应,能大量共存,故B正确;C.pH=7的溶液中,Cu2+、S2-会发生反应生成沉淀,不能大量共存,故C错误;D.pH=7的溶液中,Al3+、HCO会发生双水解,不能大量共存,故D错误;故选B。
4.A。解析:A项,氨水与各离子以及各离子之间均不发生反应,能大量共存。B项,H+和SiO可以结合生成H2SiO3沉淀,不能大量共存。C项,MnO具有氧化性,与I-之间发生氧化还原反应,不能大量共存。D项,Ag+与Cl-、SO因生成沉淀而不能大量共存。
5.A。解析:A项,题给四种离子在碱性条件下均能大量存在;B项,MnO可以氧化Fe2+,故本组离子不能大量共存;C项,CO与Ba2+会发生反应生成BaCO3沉淀,故本组离子不能大量共存;D项,H+可以与HSO反应生成SO2,且酸性条件下NO会氧化HSO生成SO,故本组离子不能大量共存。
6.B。解析:ClO-与I-能发生氧化还原反应,A项不符合题意;H+与CH3COO-会结合成弱电解质CH3COOH,C项不符合题意;OH-与Mg2+反应生成Mg(OH)2沉淀,OH-与HCO反应生成CO和H2O,D项不符合题意。
【题型突破•查漏缺】
1.D。解析:A项,ClO-具有强氧化性,HSO 具有还原性,两者可以发生氧化还原反应,pH试纸变蓝,说明溶液显碱性,Mg2+与OH-会生成Mg(OH)2沉淀,错误;B项,Fe3+与SCN-会反应生成Fe(SCN)3,错误;C项,c(H+)=0.1 mol·L-1,pH=1,溶液显酸性,HCO与H+反应会生成CO2和H2O,错误。
2.A。解析:B项,b点为酸性,I-可以被NO氧化;C项,c点为中性,Fe3+发生水解,不能大量共存;D项,a点为中性,Fe2+与ClO-反应。
3.D。解析:KNO3溶液中H+、NO与Fe2+发生氧化还原反应,不能共存;溶解Al2O3的溶液,可能是强酸溶液,也可能是强碱溶液,SiO不能存在于强酸性溶液中;Cu2+为蓝色;使甲基橙变红色的溶液为酸性溶液,Mg2+、K+、Cl-、SO可以大量共存。
4.A。解析:0.1 mol· L-1 FeSO4溶液中:Na+、K+、Cl-、NO、Fe2+、SO各离子之间相互不反应,能大量共存,选项A正确;滴入酚酞变红色的溶液呈碱性,HCO不能大量存在,且Ca2+与CO反应生成碳酸钙沉淀而不能大量共存,选项B错误;加入铁粉放出氢气的溶液呈酸性,ClO-不能大量存在,选项C错误;水电离的c(H+)=1×10-13 mol· L-1的溶液可能为酸性溶液也可能为碱性溶液,酸性条件下C6H5O-不能大量存在,碱性条件下Mg2+不能大量存在,选项D错误。
5.D。解析:MnO显紫红色,A错误;Fe3+可以氧化I-,B错误;使石蕊变红的溶液显酸性,酸性条件下NO可以氧化SO,C错误;pH=13的溶液显碱性,Na+、ClO-、CO、SO四种离子可以共存,D正确。
6.C。解析:在NaHCO3溶液中,AlO可与HCO发生反应生成氢氧化铝沉淀和碳酸根离子,不能大量共存,A错误;由水电离出的c(H+)=1×10-14 mol·L-1的溶液呈现强酸性或强碱性,HCO在强酸性或强碱性条件下均不能存在,且Ca2+和HCO在碱性条件下反应也不能大量共存,B错误;=1012的溶液显酸性,该组离子不反应,可大量共存,C正确;c(Fe3+)=0.1 mol·L-1的溶液中,SCN-会与Fe3+发生络合反应而不共存,D错误。
7.B。解析:由于加入过量NaOH溶液,加热,得到0.02 mol气体,说明溶液中一定有NH,且物质的量为0.02 mol;同时产生红褐色沉淀,说明一定有Fe3+,1.6 g固体为氧化铁,物质的量为0.01 mol,有0.02 mol Fe3+,一定没有CO;4.66 g不溶于盐酸的沉淀为硫酸钡,一定有SO,物质的量为0.02 mol;根据电荷守恒,一定有Cl-,且至少为0.02 mol×3+0.02 mol-0.02 mol×2=0.04 mol,物质的量浓度至少为c(Cl-)=0.04 mol÷0.1 L=0.4 mol·L-1。至少存在Cl-、SO、NH、Fe3+四种离子,A项错误;根据电荷守恒,至少存在0.04 mol Cl-,即c(Cl-)≥0.4 mol· L-1,B项正确,C项错误;Al3+无法判断是否存在,D项错误。
8.B。解析:根据题意,Ba2+和SO可发生离子反应生成BaSO4沉淀,因此两者不能大量共存。第一份加足量NaOH溶液加热后,收集到气体448 mL,即产生NH3为0.02 mol,可得NH也为0.02 mol。第二份加足量氢氧化钡溶液后得干燥沉淀4.30 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。部分溶于盐酸的沉淀为BaCO3,部分不溶于盐酸的沉淀为BaSO4,因此溶液中一定存在HCO、SO,一定不存在Ba2+。由条件可知BaSO4为2.33 g,物质的量为0.01 mol,BaCO3为4.30 g-2.33 g=1.97 g,物质的量为0.01 mol,根据原子守恒,100 mL该溶液中含0.01 mol HCO。由上述分析可得,溶液中一定存在HCO、SO、NH,其物质的量分别为0.01 mol、0.01 mol、0.02 mol,根据溶液中电荷守恒可知Na+一定存在,而钡离子一定不存在,A、C错误;100 mL该溶液中含0.01 mol的碳酸氢根离子,B正确;不能确定氯离子是否存在,向原溶液中加入AgNO3溶液不能检验氯离子是否存在,因为存在硫酸根离子,硫酸银是白色沉淀,干扰氯离子检验,D错误。
9.C。解析:加入NaOH溶液有气体产生,所以有NH且为0.01 mol;有红褐色沉淀, 所以一定有Fe3+,但Fe2+无法确定,因为生成的少量白色沉淀会被红褐色沉淀掩盖,根据灼烧后有1.6 g固体Fe2O3,即0.01 mol,可知铁元素为0.02 mol,根据离子共存可知不会有CO;由于加入了过量NaOH溶液,所以原溶液中是否含有Na+无法确定;如果有Al3+,则滤液中通入CO2会有沉淀,故可排除Al3+;根据加入BaCl2所得沉淀质量,可知含有SO且n(SO)=0.02 mol;若溶液中没有Na+,则阳离子所带正电荷大于0.01 mol+0.02 mol×2=0.05 mol,小于0.01 mol+0.02 mol×3=0.07 mol,则一定存在NO,阴离子浓度相同,阴离子所带负电荷为0.02 mol×2+0.02 mol=0.06 mol,根据电荷守恒,则一定含有Fe2+,设为x mol,则0.06=0.01+2x+3×(0.02-x),x=0.01,Fe2+与Fe3+浓度相等;若含有Na+,则n(Fe2+)>0.01 mol,n(Fe3+)<0.01 mol,故溶液中可能含有四种阳离子;溶液中一定含有Fe2+,且其浓度可能与Fe3+相等;溶液中NO的浓度不大,因此加入少量盐酸,与Fe2+反应产生NO无色气体。
【题型特训•练高分】
1.B。解析:A项,HCO与Al3+发生相互促进的水解反应而不能共存,错误;B项,蓝色石蕊试纸变红,溶液显酸性,四种离子可以共存,正确;C项,遇KSCN溶液显红色,说明含有Fe3+,Fe3+会氧化I-,错误;D项,水的电离受到抑制,可能是外加酸或碱,若为碱性,NH不可共存,若为酸性,AlO不可共存,且NH与AlO本身也不能共存,错误。
2.C。解析:在溶液中4种离子可以大量共存,但当物质的量相等时,不满足电荷守恒,A不符合;ClO-、I-、H+在溶液中发生氧化还原反应,不能大量共存,B不符合;4种离子在溶液中可以大量共存,当物质的量相等时,满足电荷守恒,C符合;Ba2+、CO在溶液中结合生成碳酸钡白色沉淀,不能大量共存,D不符合。
3.D。解析:Fe3+与SCN-反应生成Fe(SCN)3,故不能大量共存,A错误;=1012的溶液显酸性,H+与HCO反应生成二氧化碳和水,故不能大量共存,B错误;使酚酞变红色的溶液显碱性,反应Cr2O+H2O2CrO+2H+正向进行,故不能大量共存,C错误;由水电离的c(H+)=1×10-12mol·L-1的溶液可能显碱性,也可能显酸性,显碱性时,NH不能大量共存,显酸性时,离子之间均不反应,能大量共存,故该组离子可能大量共存,D正确。
4.D。解析:A项,新制氯水中含Cl2、HClO、ClO-等强氧化性微粒,SO不能存在,错误;B项,红色石蕊试纸变蓝,说明溶液呈碱性,HCO不能存在,错误;C项,加入铝粉产生H2,溶液有两种情况,强酸性:H+、NO与Fe2+发生氧化还原反应不能共存,强碱性:Fe2+不能存在,错误。
5.B。解析:氨水显碱性,与Cu2+之间发生反应生成氢氧化铜沉淀,在溶液中不能大量共存,故A项错误;Na+、K+、Cl-、NO之间不反应,且都不与CaCl2溶液反应,在溶液中能够大量共存,故B项正确;硝酸根离子在酸性条件下具有强氧化性,能够氧化亚硫酸根离子,故C项错误;NaHCO3溶液中的HCO与OH-会反应生成CO与H2O而不共存,故D项错误。
6.D。解析:在新制饱和氯水中含有Cl2、HClO,与SO会发生氧化还原反应,A项错误;能使红色石蕊试纸变蓝的溶液为碱性溶液,在碱性溶液中,OH-与Cu2+、HCO会发生反应,而且Cu2+、CO也会反应产生CuCO3沉淀,B项错误;加入铝粉能产生H2的溶液可能显酸性,也可能显碱性,在酸性条件下,H+、Fe2+、NO会发生氧化还原反应,在碱性条件下,OH-与Fe2+会反应生成Fe(OH)2,C项错误;=1×10-11mol·L-1的溶液是碱性溶液,OH-与选项中的离子不能发生任何反应,D项正确。
7.B。解析:I2能够将SO氧化:H2O+SO+I2===SO+2I-+2H+,故选B。
8.B。解析:滴加甲基橙试剂显红色的溶液为酸性溶液,Fe2+、NO在酸性条件下能发生氧化还原反应而不能大量共存,A项错误;滴入KSCN溶液显血红色的溶液中含有Fe3+,在该溶液中四种离子能大量共存,B项正确;=1012的溶液为强碱性溶液,NH、Al3+不能大量存在,且Al3+与CO能发生相互促进的水解反应而不能大量共存,C项错误;由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中水的电离受到抑制,该溶液为强酸性溶液或强碱性溶液,NH、HCO在强碱性溶液中不能大量存在,AlO、HCO在强酸性溶液中不能大量存在,且NH、AlO能发生相互促进的水解反应:NH+AlO+2H2O===NH3·H2O+Al(OH)3↓而不能大量共存,D项错误。
9.C。解析:A.Ba2+与CO能反应生成BaCO3沉淀,不能大量共存。B.SO与H+能反应生成SO2和H2O,SO与Fe2+能生成沉淀FeSO3,不能大量共存。C.离子之间不反应,可以大量共存。D.H+与HCO能反应生成CO2和H2O,不能大量共存。
10.B。解析:A项,离子方程式中的电荷不守恒,错误;C项,酸性条件下NO氧化Fe2+,错误;D项,NH与OH-也反应,错误。
11.D。解析:由于酸性HCO>H2SiO3,所以在溶液中会发生反应:2HCO+SiO===H2SiO3↓+2CO,二者不能大量共存,A错误;因FeS可与强酸反应,所以不能发生Fe2+与过量H2S的反应,B错误;HClO、Fe3+都具有强的氧化性,可将SO氧化为SO,不能大量共存,C错误;四种离子互不反应,在溶液中可以大量共存,I-具有还原性,在酸性条件下,H+ 、I-、NO发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得方程式为6I-+2NO+8H+===2NO↑+4H2O+3I2,D正确。
12.C。解析:加入HCl,阴离子种类不变,原溶液一定有Cl-,没有OH-、CO,产生气体可能是因为发生反应:3Fe2++NO+4H+===3Fe3++NO↑+2H2O,则溶液中有Fe2+、NO和Cl-,为了保持电荷守恒,溶液中必须含有SO,这样溶液中最后一种离子只能是Mg2+,C项错误。
13.B。解析:焰色试验显黄色,说明一定存在钠离子,可能有钾离子。加入过量的硝酸钡溶液产生白色沉淀,白色沉淀完全溶解在盐酸中,说明一定存在碳酸根,不存在硫酸根。滤液中加入硝酸酸化的硝酸银得到白色沉淀,说明含有氯离子,即一定存在Na+、Cl-、CO,一定不存在SO,可能含有K+。
14.C。解析:无色透明溶液说明溶液中无Cu2+;实验①产生的气体为NH3,则100 mL溶液中含0.02 mol NH,c(NH)=0.2 mol·L-1;实验②说明溶液中存在Al3+,则n(Al3+)=2n(Al2O3)=2×=0.02 mol,c(Al3+)=0.2 mol·L-1,由此可推出溶液中不存在CO;实验③说明溶液中含SO,n(SO)=n(BaSO4)==0.02 mol,即c(SO)=0.2 mol·L-1。100 mL溶液中已确定存在的阳离子所带电荷为0.02 mol+3×0.02 mol=0.08 mol,阴离子所带电荷为0.04 mol,根据电荷守恒可知溶液中存在其他阴离子,又因溶液中阴离子的浓度相等,故溶液中一定含有NO、Cl-,进而推断溶液中一定不含Na+。综上所述,A、B项错误,C项正确。原溶液中阳离子水解显酸性,加入FeCl2溶液,Fe2+被NO氧化,NO的物质的量减小,但Cl-的物质的量增大,且增加量大于NO的减小量,故阴离子的总物质的量增大,D项错误。
05 考向5 物质的分离和提纯(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份05 考向5 物质的分离和提纯(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共28页。
03 考向3 利用物质的特殊性质推断元素(文字描述型)(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份03 考向3 利用物质的特殊性质推断元素(文字描述型)(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共28页。
03 考向3 常见有机物的官能团异构体找法(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份03 考向3 常见有机物的官能团异构体找法(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共28页。












